专业设计实验
丙酮碘化反应级数的测定
陈黎
湖北师范学院
丙酮碘化反应级数的测定
【实验背景及原理】
复杂反应不是经过简单的一步就能完成的,而是要通过生成中间产物的许多步骤来完成的,其中每一步都是一个基元反应。常见的复杂反应有对峙反应,平行反应和连续反应等。
大多数化学反应是复杂反应,反应级数是根据实验的结果而确定的,并不能从化学计量方程式简单的利用质量作用定律推得。反应级数的确定是很重要的,它不仅告诉我们浓度是怎样影响反应速度,从而通过调整浓度来控制反应速度,而且可以帮助我们推测反应机理,了解反应真实过程。
确定反应级数的方法通常有孤立法(微分法)、半簑期法、积分法,其中孤立法是动力学研究中的常用方法。本实验用孤立法确定丙酮碘化反应级数,从而确定丙酮碘化反应速率方程。
酸催化的丙酮碘化反应是一个复杂反应,初始阶段反应为:
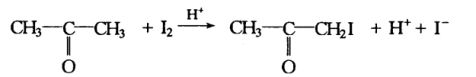
(丙酮)A (碘化丙酮)
H是反应的催化剂,因丙酮碘化反应本身有H+生成,所以,这是一个自催化反应。一般认为该反应的反应机理包括下列两步:
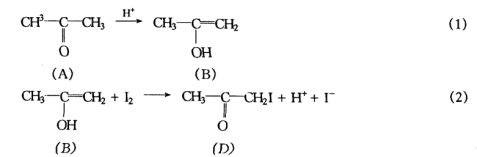
+
这是一个连续反应。反应(1)是丙酮的烯醇化反应,它是一个可逆反应,
进行得很慢。反应(2)是烯醇的碘化反应,它是一个快速且能进行到底的反应。由于反应(1)速率很慢,而反应(2)的速率又很快,中间产物烯醇一旦生成又马上消耗掉了。根据连续反应的特点,该反应的总反应速率由反应(1)所决定。
设反应动力学方程为:
dcI2xy??kcAcH+cIz2 (1) dt
式中:cA,cH+,cI2分别为碘化丙酮(A)、丙酮、碘、盐酸的浓度,mol·L-1;x,y,z
分别代表丙酮、氢离子、碘的反应级数,k为速率系数。将上式两边取对数得:
?dcI2?lg????lgk?xlgcA?ylgcH+?zlgcI2 (2) dt??
?dcI?从上式可以看出,反应级数x,y,z分别是lg??2?对lgcA、lgcH+、lgcI2的偏微?dt?
分,如果用图解法,我们可以这样处理:在三种物质中,固定两种物质的浓度,?dcI?配制出第三种物质浓度不同的一系列溶液,以lg??2?对该组分浓度的对数作
?dt?
图,所得斜率即为该物质在此反应中的反应级数。
因碘在可见光区有一个很宽的吸收带。而在此吸收带中盐酸、丙酮、碘化丙酮和氯化钾溶液则没有明显的吸收,所以可采用分光光度法直接观察碘浓度随时I1间的变化关系。根据朗伯比尔定律:A?lg?lg0??bcI2 TI
从而有: A??bIc (3) 2
式中:A为吸光度,T为透光率,I和I0分别为某一波长的光线通过待测溶液和空白溶液的光强度,ε为吸光系数,b为比色皿厚度。测出反应体系不同时刻的吸光度,作A-t图,其斜率为:
dcI2dcI2dA1dA??b??? 或 ? (4) dtdtdt?bdt
如已知ε和b(b=1cm),即可算出反应速率。
若反应物I2是少量的,而丙酮和酸对碘是过量的,则反应在碘完全消耗以前,
丙酮和酸的浓度可认为基本保持不变,即cA?cH???cI2(本实验浓度范围:丙酮浓度为0.1~0.4 mol·L-1,氢离子浓度为0.1~0.4 mol·L-1,碘的浓度为0.0001~0.01
-1
mol·L),实验发现A-t图为一条直线,说明反应速率与碘的浓度无关,所以,z=0,同时,可认为反应过程中cA和cH+保持不变,对速率方程(1)两边积分得:
xy
cI21?cI22?kcAcH+?t2?t1?
将A??bcI2代入上式并整理得:
?A?A2?11
k??1?? ?xy
?t2?t1??bcAcH?
A?A1dA
因A-t图为直线,2,所以 ?
t2?t1dt
1?dA?1
k??????xy (5)
?dt??bcAcH+
【仪器与试剂】
722s型分光光度计1台;比色皿2个;秒表1块;酸碱滴定管1套(带滴定架);500mL棕色容量瓶2个;250mL容量瓶3个;100mL容量瓶3个;50mL容量瓶8个;5mL移液管3支;10mL移液管3支;25mL移液管2支;30mL移液管2支。 纯碘,纯溴,碘化钾,溴化钾,硫代硫酸钠标准,碘标准溶液(0.05 mol?L-1),丙酮,盐酸,淀粉指示剂;丙酮溶液2.00mol.L-1 ,盐酸2.00 mol?L-1,碘溶液0.02 mol?L-1 (含2℅ KI)
【实验过程】
1用Na2S2O3标定碘的水溶液 1.1碘溶液的配制
称取1.5g碘及4.5g碘化钾,溶于少量水中,然后移入500mL棕色试剂瓶中,加水稀释至500mL,摇匀。
1.2标定 1.2.1原理
2Na2S2O3 + I2 → 2NaI + Na2S4O6
1.2.2标定
准确量取20ml~25ml碘液,加50ml水、30ml 0.1C(HCl)盐酸,摇匀,用 0.1 C(Na2S2O3)的Na2S2O3标准溶液滴定近终点(微黄色)时加30ml 0.5%淀粉指示剂,继续滴定至溶液兰色消失为终点。
1.2.3计算
V1×C1
V
式中:
V1 ― 滴定消耗Na2S2O3标准溶液体积,mL;
C1 ― Na2S2O3标准溶液浓度,mol/L;
V ― 吸取碘液体积,mL。
2调整分光光度计
将可见分光光度计波长调到500nm处,用光径长为1cm的比色皿装蒸馏水,调透光率为100%。
3.测量
3.1测定吸光系数
用50ml容量瓶配制0.001 mol·L-1碘水溶液,用少量的碘水溶液洗涤比色皿两次,再注入0.001 mol·L-1碘水溶液,测定吸光度A值,更换碘水溶液再重复测定二次,取平均值。
3.2反应溶液的配制及测定
3.2.1丙酮浓度不同的反应溶液
用移液管分别给 1~4号4只干净的50ml容量瓶各注入0.02 mol·L-1碘水溶液5ml、2.00 mol·L-1盐酸溶液5ml,再注入适量蒸馏水,置于25℃恒温水浴中恒温10min,另取一支移液管分别给1~4号4只50ml容量瓶依次加入已恒温25℃的2.00 mol·L-1丙酮溶液2.5ml、5.0ml、
7.5ml、10ml,加蒸馏水定容,混合均匀,测定不同时间的吸光度,每隔1分钟(或30秒)读一个吸光度数据,直到取得10个数据为止。
3.2.2氢离子浓度不同的反应溶液
用移液管分别给 1~4号4只干净的50ml容量瓶各注入0.02 mol·L-1碘水溶液5ml,同时依次加入2.00 mol·L-1 HCl溶液2.5ml、5.0ml、7.5ml、10ml,再注入适量蒸馏水,置于25℃恒温水浴中恒温10min以后,每个容量瓶依次加入5ml 2.00 mol·L-1丙酮溶液,加蒸馏水定容,混合均匀,测定不同时间的吸光度,每隔1分钟(或30秒)读一个吸光度数据,直到取得10个数据为止。
【结论】
1计算吸光系数
由测定已知浓度碘溶液的吸光度值,填入下表,由(3)式计算吸光系数(a?bcI2)。

2根据测得反应溶液不同时刻的A值,填入下表,画出A-t图
CH+=0.1 mol·L-1
CI2
=0.002 mol·L-1

2
CA=0.1 mol·L-1 CI=0.002 mol·L-1
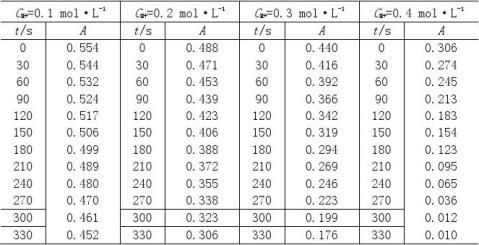
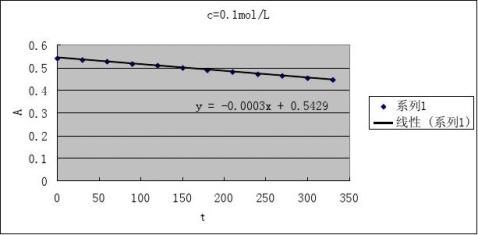
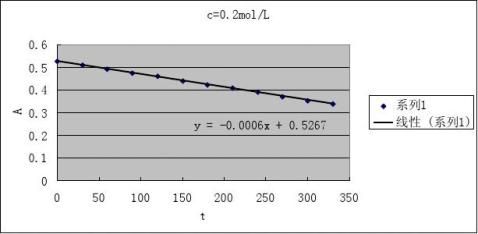
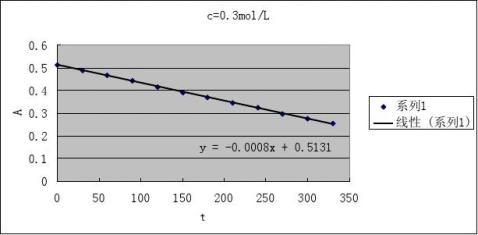
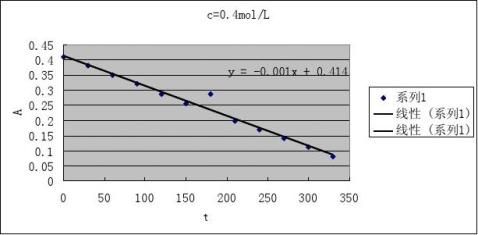
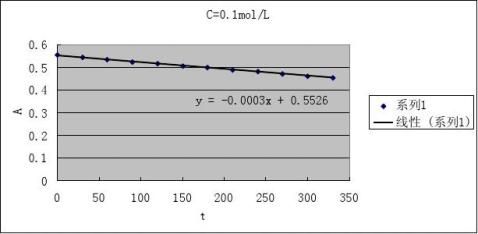
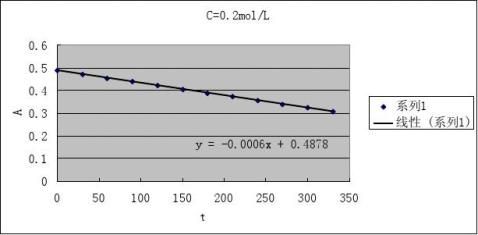
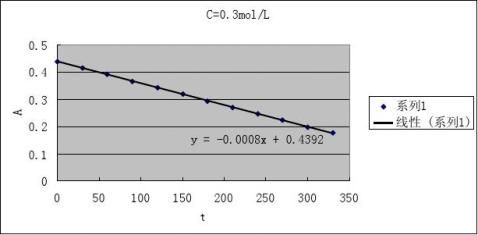
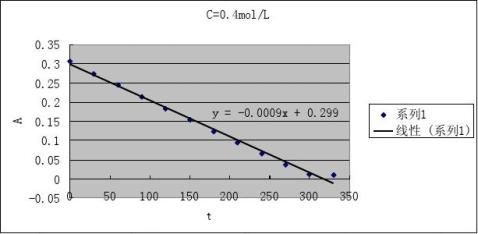
3由A-t图和(4)式求出下表有关数值
CH+=0.20 mol·L-1 CI=0.002 mol·L-1

2
CA=0.20 mol·L-1 CI2=0.002 mol·L-1
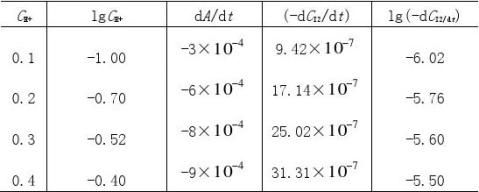
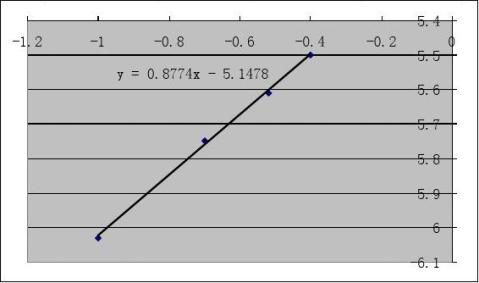
?dcI2
4作lg?
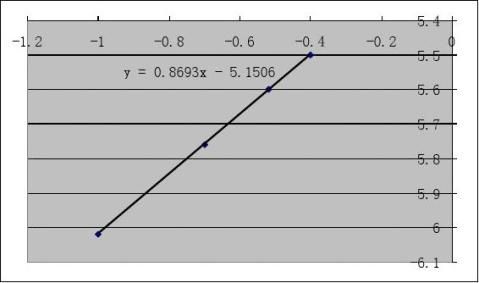
?
?dt
??dcI2??lgcA和lg????dt?
??lgcH+图,其斜率分别是丙酮、氢离子?
的反应级数x,y。
由图可得丙酮和氢离子的反应级数均为1。
5计算丙酮碘化反应速率系数
根据(5)式计算不同浓度反应溶液的ki值,然后取ki的平均值作为丙酮碘化反
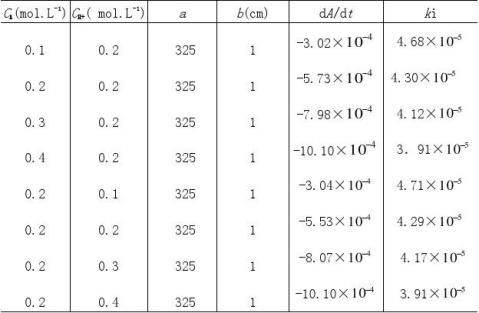
平均值(k)
4.26×10?5
丙酮碘化反应的动力学初步研究
【实验背景及原理】
丙酮碘化反应是测定化学反应速度和反应级数的实验。以往常常是通过滴定法来测定它的反应速率,此法操作烦琐且费时。最近,我们采用光栅光谱仪测定丙酮碘化反应的反应速率,由实验可求出反应速率常数。此法操作简单,耗样量少,速度快,图形直观,测得的实验数据线性较好,结果准确度较高。选择适当的反应条件,可以研究丙酮碘化反应初始阶段的反应。已经证实在酸的浓度较低的条件下,丙酮碘化反应对碘是零级反应。此时,反应速率为一常数。在本文研究的反应体系中,只有碘溶液在可见光区有宽的吸收带。通过郎泊-比耳定律和阿累尼乌斯关系式,则可以算出反应速率常数。
【仪器与试剂】
天津港东科技发展有限公司光栅光谱仪GWD8A;100 ml 容量瓶1 个,50 ml 容
量瓶3 个;
丙酮(纯度为A.R);蒸馏水;碘;浓盐酸;碘化钾;10 mL 移液管3 个;恒温箱。
【实验步骤】
1、利用光谱仪测出同一温度下不同时刻反应物的透光率,从而反映出反应物浓度随时间变化的关系并根据丙酮碘化反应的化学原理,继而求出该反应的反应速率常数。
2、光谱条件:调节光栅光谱仪波长至560 nm,先作出基线,然后进行浓度测定。
3、样品预处理取一50 mL 容量瓶,移入5 mL 2 mol/L 丙酮溶液,加少量蒸馏水,塞好,25 ℃恒温;另取一50 mL 容量瓶,移入5 mL 0.01 mol/L 碘溶液,5 mL 1 mol/L 盐酸溶液,塞好,25 ℃恒温,再取一100mL 容量瓶,放入约50 ml 蒸馏水,25 ℃恒温。
4、实验操作:恒温后,将丙酮溶液倒入盛有混合溶液的容量瓶,再用25 ℃时蒸馏水洗盛有丙酮溶液的容量瓶3~4 次,洗涤液倒入盛有混合溶液的容量瓶中,用25 ℃的蒸馏水稀释至刻度,震摇均匀后放入比色皿中,利用光谱仪测出同一温度下不同时刻反应物的透光率,每4 min 记录一次。
5、将恒温箱调到20 ℃,重复3、4,每8 min 记录一次。
[参考文献]
赵仲飚。光栅光谱仪测量丙酮碘化反应速率常数。浙江海洋学院学报(自然科学版),20xx年6月第28卷第2期
第二篇:物化实验报告-丙酮碘化
物理化学实验报告
丙酮碘化反应
2011011743 分1 黄浩
同组实验者:李奕
实验日期:2013-10-26 提交报告日期:2013-10-29
指导老师:王振华
1.引言
1.1 实验目的
1. 采用分光光度法测定用酸作催化剂时丙酮碘化反应的速率系数、反应级数和活化能。
2. 通过本实验加深对复合反应特征的理解。
3. 熟练掌握分光光度计的原理和使用方法。
1.2 实验原理
只有少数化学反应是由一个基元反应组成的简单反应,大多数化学反应并不是简单反应,而是由若干个基元反应组成的复合反应。大多数复合反应的反应速率和反应物浓度间的关系,不能用质量作用定律表示。因此用实验测定反应速率与反应物或产物浓度间的关系,即测定反应对各组分的分级数,从而得到复合反应的速率方程,乃是研究反应动力学的重要内容。
对于复合反应,当知道反应速率方程的形式后,就可以对反应机理进行某些推测。如该反应究竟由哪些步骤完成,各个步骤的特征和相互联系如何等等。
实验测定表明,丙酮与碘在稀薄的中性水溶液中反应是很慢的。在强酸(如盐酸)条件下,该反应进行得相当快。但强酸的中性盐不增加该反应的反应速率。在弱酸(如醋酸)条件下,对加快反应速率的影响不如强酸(如盐酸)。
酸性溶液中,丙酮碘化反应是一个复合反应,其反应式为:
H+-(CH3)2CO+I-???CHCOCHI+H+2I (1) 332+
该反应由H+催化,而反应本身又能生成H+,所以这是一个H+自催化反应,其速率方程
--dc?A?-dc?I3?dc?E?δ+===kcα?A?cβ?I-为:r=3?c?H? (2) dtdtdt
式中:r—反应速率;
k—速率系数;
cH+、cI-碘、氢离子、碘化丙酮的浓度,mol/dm3; c?A?、c?E?—分别为丙酮、3、????
?、?、?—分别为反应对丙酮、碘、氢离子的分级数。
反应速率、速率系数及反应级数均可由实验测定。
物理化学实验报告
丙酮碘化对动力学的研究是一个特别合适而且有趣的反应。因为I-
3在可见光区有一个
比较宽的吸收带,而在这个吸收带中,盐酸和丙酮没有明显的吸收,所以可以采用分光光度计测定光密度的变化(也就是I-
3浓度的变化)来跟踪反应过程。
虽然在反应(1)中没有其它试剂吸收可见光,但却存在下列一个次要却复杂的情况,
-θ即在溶液中存在I-、和的平衡,平衡常数其中I2在这个吸收带中也吸收IIK=700。32
-可见光。因此I-而且也与I2的浓度有关。根据朗3溶液吸收光的数量不仅取决于I3的浓度,
伯-比尔定律:
D=εLc (4)
式中:D—光密度(消光度);
ε—吸收系数;
L—比色皿的光径长度;
c—溶液的浓度。
含有I3和I2溶液的总光密度D可以表示为I3和I2两部分光密度的和,即:
--D=D?I-
3?+D?I2?=ε?I3?Lc?I3?+ε?I2?Lc?I2? (5) --
吸收系数εI3和ε?I2?是吸收光波长的函数。在特殊情况下,即波长λ=565nm时,-??
ε?I-
3?=ε?I2?,上式变为
-?-?D=D?I-
3?+D?I2?=ε?I3?L?c?I3?+c?I2?? (6)
也就是说,在565nm这一特定的波长条件下,溶液的光密度D与I3和I2浓度之和成正比。因为ε在一定的溶质、溶剂和固定的波长条件下是常数。使用固定的一个比色皿,L也是一定的,所以(6)式中,常数εI3L就可以由测定已知浓度碘溶液的光密度D而求出。
在本实验条件下,实验将证明丙酮碘化反应对碘是零级反应,即β=0。由于反应并不停留在一元碘化丙酮上,还会继续进行下去,因此反应中所用的丙酮和酸的浓度应大大过量。而所用的碘量很少。这样,当少量的碘完全消耗后,反应物丙酮和酸的浓度可以认为基本保持不变。
实验还进一步表明,只要酸度不很高,丙酮卤化反应的速率与卤素的浓度和种类(氯、溴、碘)无关(在百分之几误差范围内),因而直到全部碘消耗完以前,反应速率是常数,即: -??-
物理化学实验报告
r=
-dc?I-3?dt
dc?E?δ+αδ+
==kcα?A?cβ?I-3?c?H?=kc?A?c?H?=常数 (7)
dt
从(7)式可以看出,将cI3对时间t作图应为一条直线,其斜率就是反应速率r。 为了测定反应级数,例如指数α,至少需进行两次实验。在两次实验中丙酮的初始浓度不同,H+和I-3的初始浓度相同。若用“Ⅰ”、“Ⅱ”分别表示这两次实验,令:
-
c?A,Ι?=uc?A,ΙΙ?,cH+,Ι=cH+,ΙΙ,cI-3,Ι=cI3,ΙΙ
??
-
????????
由(7)式可得:
kcα?A,Ι?cδ?H+,Ι?rα
=α=u (8) rΙΙkc?A,ΙΙ?cδH+,ΙΙ取对数:
lg
r=αlgu (9) rΙΙlgrrΙΙ
(10)
α=
同理可求出指数?,若再做一次实验Ⅲ,使:
-
c?A,Ι?=c?A,????,cH+,Ι=wcH+,???,cI-3,Ι=cI3,???
????????
即可得到:
lg
?=
同样
rr???
(11)
-
c?A,Ι?=c?A,ΙV?,cH+,Ι=cH+,ΙV,cI-,Ι=xcI33,ΙV
???
rrΙV
?????
即可得到:
lgβ=
(12)
根据(2)式,由指数、反应速率和各浓度数据可以算出速率系数k。由两个或两个以上温度的速率系数,根据阿累尼乌斯公式
k=Ae-Ea/RT (13)
可以估算反应的表观活化能Ea。
物理化学实验报告
2. 实验操作
2.1 实验药品、仪器
实验仪器:计算机与接口1套;722S型分光光度计(比色皿1个);恒温槽1套;10ml移液管1支;5ml刻度移液管3支;5ml移液管1支;25ml容量瓶2个;洗瓶。
实验药品:0.02134 mol·dm-3碘溶液;1.436mol·dm-3HCl溶液;3.3738 mol·dm-3丙酮溶液。
2.2 实验条件
温度/℃ 17.6
压力/kpa 102.36
2.3 实验操作步骤及方法要点
1、 检查仪器和药品。 2、 接通电源。 3、 开启恒温槽,检查水路是否通畅和漏水。将装入已标定好的碘溶液、丙酮溶液、盐酸
溶液的玻璃瓶放入恒温槽中恒温,将盛有去离子水的玻璃瓶也放入恒温槽中。恒温槽温度设定在25℃。到达设定温度并恒定10分钟后开始实验。 4、 打开分光光度计电源开关,波长调至565nm,预热一段时间后,放入装有已恒温的去
离子水的比色皿,调100,再放入黑块,调零。 5、 测定εL值。准确移取2.5ml碘溶液于25ml容量瓶中,用已恒温的去离子水稀释至刻
度,摇匀,润洗比色皿3次,然后将装有2/3溶液的比色皿置于样品室光路通过处,盖好盖子。更换碘溶液再重复测定两次,取其平均值求εL值。 6、 测定四种不同配比溶液的反应速度。四种不同溶液的配比见表1。
表1 反应液的配比表
I(25℃) II(25℃) III(25℃) IV(25℃) V(35℃)
碘溶液 V/ml
5 5 5 7.5 7.5
丙酮溶液 V/ml
5 2.5 5 5 5
盐酸溶液 V/ml
5 5 2.5 5 5
7、 按表中的量,准确移取已恒温的三种溶液于25ml容量瓶中(碘溶液最后加),用去离
子水稀释至刻度,摇匀,润洗比色皿3次,然后将装有2/3溶液的比色皿置于样品室光路通过处,用计算机记录下20min内的吸光度曲线。 8、 首先做25℃下的四个实验,顺序建议为二、三、一、四,再升高恒温水浴温度到35℃
进行第五组的实验。
3 结果与讨论 3.1 原始实验数据
原始的A-t表格因数据量较大,在此略去。
3.2 计算的数据
3.2.1 εL的标定
物理化学实验报告
在实验中,配制的碘溶液浓度为2.134×10-3mol/L,测得的平均吸光度为0.379,因而:
εL=A/c=177.6L/mol
3.2.2 吸光度曲线的测定
实验1:
温度/℃
25 碘浓度/10-3(mol/L) 丙酮浓度(mol/L) 盐酸浓度(mol/L) 4.268 0.67476 0.2872
实验所得的A-t曲线及其拟合结果为:(已去掉了后半段的变化不明显的部分)

因为A-t直线的斜率=(-r) ×εL,因而:
r1=4.905×10-6mol/(L·s)
实验2:
温度/℃
25 碘浓度/10-3(mol/L) 4.268 丙酮浓度(mol/L) 0.33738 盐酸浓度
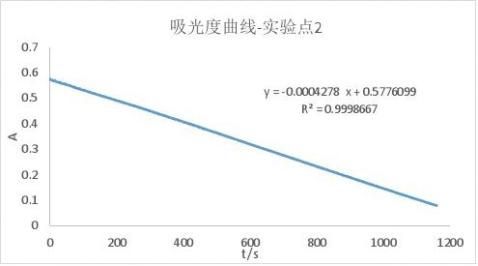
(mol/L) 0.2872
实验所得的A-t曲线及其拟合结果为:
同理:
r2=2.409×10-6mol/(L·s)
物理化学实验报告
实验3:
温度/℃
25 碘浓度/10-3(mol/L) 丙酮浓度(mol/L) 4.268 0.67476 盐酸浓度(mol/L) 0.1436
实验所得的A-t曲线及其拟合结果为:(已删去了前面的200s,因为在这之后斜率发生了变化,猜测可能是由于200s之后,温度才稳定下来)
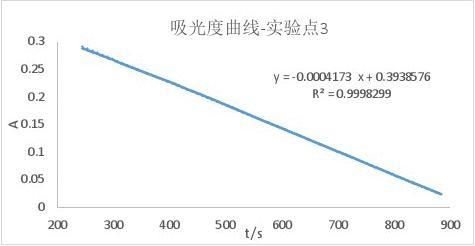
同理:
r3=2.350×10-6mol/(L·s)
实验4:
温度/℃
25 碘浓度/10-3(mol/L) 丙酮浓度(mol/L) 6.402 0.67476 盐酸浓度

(mol/L) 0.2872
实验所得的A-t曲线及其拟合结果为:(已删去了前面的200s,为了保证数据点的温度恒定,也删去了后面的一小段,因其变化已不明显,图像发生弯曲)
同理:
r4=4.916×10-6mol/(L·s)
实验5:
温度/℃ 碘浓度/10-3(mol/L) 丙酮浓度(mol/L)
35 6.402 0.67476 盐酸浓度(mol/L) 0.2872
物理化学实验报告
实验所得的A-t曲线及其拟合结果为:(已删去了前面的200s和后面的一小段,原因同上)
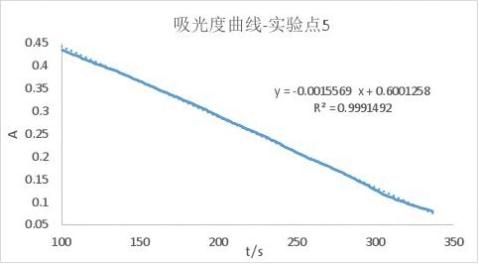
同理:
r5=8.766×10-6mol/(L·s)
3.3.3 数据汇总与处理
将之前拟合得到的各个实验点的r值整理如下: 实验点 1 2 3 4 5 因而:
α=
r1lg()r1lg()=1.026≈1
温度/℃ 25 25 25 25 35
碘浓度/10-3(mol/L)
丙酮浓度(mol/L) 0.67476 0.33738 0.67476 0.67476 0.67476
盐酸浓度(mol/L) 0.2872 0.2872 0.1436 0.2872 0.2872
r/ mol/(L·s) 4.905×10-6 2.409×10-6 2.350×10-6 4.916×10-6 8.766×10-6
4.268 4.268 4.268 6.402 6.402
δ==1.062≈1
r1lg(=0.0055≈0 β=即:
r=kc(A)c(?+)
可将五个实验点的反应速率系数求出:
物理化学实验报告
实验点 r/ mol/(L·s) 丙酮浓度(mol/L) 盐酸浓度(mol/L) k/ L/(mol·s)
1 4.905×10-6 0.67476
2 2.409×10-6 0.33738
3 2.350×10-6 0.67476
4 4.916×10-6 0.67476
5 8.766×10-6 0.67476
0.2872 2.53×10-5
0.2872 2.486×10-5
0.1436 2.425×10-5
0.2872 2.537×10-5
0.2872 4.523×10-5
于是,25℃下的平均速率系数为:2.4945×10-5 L/(mol·s) 根据公式:
ln(
可得:
Ea=45.455kJ/mol
3.3.4 使用实验室软件得到的拟合结果 实验点 R1/ mol/(L·s) k/ L/(mol·s)
1 -0.0008794 2.562×10-5
2 -0.0004341 2.529×10-5
3 -0.0004227 2.463×10-5
4 -0.0008771 2.555×10-5
5 -0.0001581 4.600×10-5
k1Ea11
=(?) k2RT1T2
而由此计算得到的各个参数为:
α=1.0187,β=-0.0065,δ=1.0568,Ea=45.756kJ/mol
3.3 讨论分析
3.3.1 结果分析
在数据处理过程中,我只使用了既得数据的一部分——中间段。之所以没有使用前段的原因,是因为前段的温度更接近室温,而偏离设定的反应温度会有一定的偏离,这体现在A-t曲线的前段斜率和中段斜率的不同,中段的斜率稍大;而没有使用末尾的几十个数据点的原因,是因为在反应终点附近,浓度已经很稀,吸光度测量偏差增加,体现为A-t曲线的“拖尾”。最终,无论是在实验室的软件中,还是在课后的数据处理时,我都使用的中段数据。
将自己使用excel处理的数据与实验室软件得到的结果进行对比:
excel处理的结果 实验室软件
α 1.026 1.0187
β 0.0055 -0.0065
δ 1.062 1.0568
Ea/(kJ/mol) 45.455 45.756
由上表可见,两种数据处理软件的得到的结果相似,这是由于它们都使用了同样的数据处理方法——线性拟合。而它们又有一些不同,这是由于取点方式不同导致的,在实验室取
1
实验室软件提供的r值,不是反应速率,而是吸光度的变化率,因而用R来代替,以与上文中的r相区别
物理化学实验报告
点时,我们更关注线性程度,因此取点范围较小,但更精准,而用excel拟合时,我只将数据点两端的不合理数据删除掉了,更关注数据的完整性,取点范围大,但线性程度略逊。
但本实验的结果还是比较令人满意的,因为A-t拟合的R2基本都达到了0.9998,说明线性程度很好。而且在本次实验中,只有我们组的β值达到了0.01以下,说明操作合理、标定准确,没有出现大的实验漏洞。
3.3.2 异常情况
本次实验中,发生了两个异常情况,但都较好地解决了。
第一个,是我在配制标准碘溶液的时候,看到了容量瓶的四周有一道裂纹,但没有在意,而在定容完盖塞子的时候,将该容量瓶从原来的裂纹处拧断了,这导致我们只能使用其他同学的棕色容量瓶进行εL的标定,耽误了一些时间。在实验结束之后,我进行了反思,虽然这个仪器的损坏责任不完全在我,是之前就有了明显的裂纹,但我在发现这个问题之后,抱有侥幸心理,觉得一般不会出问题,但恰恰就是这侥幸心理,最终给我们惹来了麻烦。
第二个,是我们在进行第一个实验点的测量之前,我忽然想到,在分光光度计的调零、调100时,没有将顶盖盖住,但反应速率的测量是将顶盖盖住的,这样就使得调零失去了其基准作用,这次我没有存有侥幸心理,及时向老师反映,并主动纠正了错误,重新调零。最终我们组是本次实验最准确的一组(β=-0.0065,最接近0)。
3.3.3 仪器装置改进
在数据处理的过程中,我发现第五组的A-t图像出现了一些“波动”,不像前四组实验,呈平稳的直线(中间段),我认为这是由于温度的不同导致的。因为室温为17.6℃,更接近前四组的反应温度,根据傅里叶定律,传热速率与温度梯度成正比,因此第五组的装置散热速率快,温度不易稳定,k发生变化,导致r的改变,因而出现了很多波动。因此,我认为如果能将前四组实验温度改为20℃、第五组改为30℃,这样在室温17.6℃的条件下,散热速率较小,效果会更好,活化能也能求的更准确。
4 实验结论
通过本次实验,我们测定了丙酮的一元碘化反应的反应速率、速率常数以及分级数、活化能,具体结果如下:(使用了实验室软件给出的结果,因其取点方式更可靠)
丙酮碘化反应是一个二级反应,其反应速率分别与丙酮浓度和酸浓度呈正比,而与碘的浓度无关。即
r=kc(A)c(?+)
该反应的活化能为45.756kJ/mol
在25℃下,速率常数(均值)为2.527×10-5 L/(mol·s),在35℃下,速率常数为4.600×10-5 L/(mol·s)
5 参考文献
物理化学实验报告
1. 《基础物理化学实验》,高等教育出版社,贺德华、麻英、张连庆,20xx年5月第1版
2. 《物理化学》,清华大学出版社,朱文涛,20xx年9月第1版
6 附录——思考题
6.1在动力学实验中,正确计量时间是很重要的。本实验中从反应开始到起算反应时间,中间有一段不算很短的操作时间。这对实验结果有无影响?为什么?
答:基本没有影响。丙酮碘化反应对于丙酮和盐酸分别是一级反应,而对碘而言是零级反应,即r=kc(A)c(?+)。因此在丙酮、盐酸浓度远远大于碘浓度时,可认为[A]、[H+]基本不变,因而r为定值,c-t曲线为一直线,进而A-t曲线为直线,斜率不变。所以在反应开始之后的一段时间内,只要准确测定了吸光度曲线的斜率,即可准确获得r值。但是,这一段操作时间也不能太长,否则会使溶液在分光计内的“回温”时间过长,最终只能取A-t曲线中的后半段(温度稳定段),这样数据量减少,实验的可靠性下降。
6.2影响本实验结果的主要因素是什么?
答:
1)εL的标定是之后准确测定r值的基础,调零、调100也有一定的影响。
2)分光光度计内的恒温环境,以及565nm的测量条件。
3)实验室提供的标准溶液的浓度、实验滴加的溶液量必须准确。
4)比色皿必须洗干净,并用待测液润洗。
5)实验点1的测量非常重要,在数据处理时要用三次,是分级数计算的基础。因此要等待温度十分稳定之后再测量。
6.3如果用表观活化能Ea代替活化焓?Hm行否?为什么?
答:因为在液相反应中?≠Hm=Ea?RT,而Ea=45756J/mol,在35℃时,RT=2562J/mol,相对于Ea而言是小量,即可以用表观活化能Ea代替活化焓?Hm。 ??
