分析化学实验报告
EDTA的标定和水硬度的测定
应用化学 2009级 刘延
指导老师 吴明君 副教授
摘要:本文介绍了用碳酸钙标定EDTA和用EDTA来测定水的总硬度和钙硬度的方法。进一步学习了EDTA的配置和标定,熟悉钙指示剂的使用方法,了解配位滴定的原理和配位滴定的特点。
关键字:EDTA 标定 水硬度
The EDTA mark settles and the
measurement of water degree of hardness
LIU Yan Apply Chemistry,Grade 2009
Directed by WU Ming-jun
Abstract:This text introduced to use a calcium carbonate mark settle EDTA and use EDTA to measurese aqueous of the method of total degree of hardness and calcium degree of
hardness.Allocation and mark that studied EDTA further settle, acquaint with the operation method of calcium indicator and understand to go together with a principle of titration and go together with the characteristics of a titration.
Keyword:EDTA standardization water hardness
综述
EDTA(全称乙二胺四乙酸)常温下难溶于水,在分析中常用乙二胺四乙酸的二钠盐配置溶液。标定EDTA的基准物有Zn、ZnO、CaCO3、等,通常选择用其中与
被测物组分相同的物质作基准物质,这样滴定条件一致,可以减少滴定误差。水的硬度表示有多种方法,我们用的就是把水中的盐折算成碳酸钙的量作为硬度标
[1]准。
1 实验部分
1.1 实验仪器和药品
乙二胺四乙酸二钠盐(AR),碳酸钙(AR),1+1NH3·H2O,镁溶液,100g/LNaOH溶液, NH3-NH4Cl缓冲溶液(PH?10), 钙指示剂,铬黑T指示剂,1+1HCl 蒸馏水 自来水
- 1 -
分析化学实验报告
50mL酸式滴定管,250mL锥形瓶,250mL容量瓶,250mL烧杯,25.0mL移液管,试剂瓶,分析天平
1.2 实验方法
1.2.1 EDTA的标定 称取3.2423g乙二胺四乙酸二钠盐,用温水配置成约0.017mol/L的溶液500mL,待冷却至室温后转移至试剂瓶。称取碳酸钙0.5098g于烧杯中用少量水润湿,盖上表面皿,从杯嘴逐滴加入HCl至碳酸钙完全溶解,用少量水把溅到表面皿上的溶液洗到烧杯里,加热至近沸,待冷却至室温移入250mL容量瓶,并加蒸馏水稀释至刻度线,摇匀。用移液管移取25.0mL标准钙溶液于锥形瓶中,加入约25mL水、2mL镁试剂、5mL100g/LNaOH溶液及约10mg钙指示剂,摇匀后用EDTA溶液滴定至由红色变至蓝色即为终点。重复以上操作平行滴定5次,纪录数据。
1.2.2 水总硬度的测定 用移液管量取澄清的自来水样100.0mL于锥形瓶中,加入5mLNH3-NH4Cl缓冲溶液,摇匀。再加入约0.01g铬黑T固体指示剂,再
摇匀。用以上我们标定的EDTA来滴定至溶液由酒红色变成纯蓝色即为滴定终点。重复以上操作平行滴定3次,纪录数据。
1.2.3 钙硬度的测定 量用移液管取于1.2.3中一样的澄清水样100.0mL于锥形瓶,加入4mL100g/LNaOH溶液,摇匀,再加入约0.01g钙指示剂,再摇匀。用以上标定好的EDTA溶液来滴定至溶液由淡红色至呈纯蓝色即为滴定终点。重复以上操作平行滴定3次,纪录数据。
表格5号 宋体 三线表
2结果与讨论
2.1 EDTA的标定 标定EDTA的数据如下表2-1
初读数/mL 终读数/mL 实际体积/mL
1.62 32.28 30.66
0.30 30.10 29.80
0.50 31.00 30.50
0.10 30.45 30.35
0.51 31.31 30.80
表2-1
碳酸钙的浓度C=0.02039mol/L,从以上数据可以算出EDTA的实际浓度C=0.01678mol/L。标准偏差S=0.00031,相对标准偏差RSD=1.8%。标定的浓度结果比我们预想的浓度要低,主要是跟我们用的指示剂有关,变色突变点的确定会导致误差,指示剂的使用量也会影响我们对突变点的确定[2]。
2.2 水总硬度的测定 滴定水中钙所消耗的EDTA如表2-2
初读数/mL 终读数/mL 实际体积/mL 0.50 15.31 14.81 0.30 15.21 14.91 0.10 14.92 14.82
- 2 -
分析化学实验报告
表2-2
三次EDTA的平均体积为V=14.85mL,由公式得水的总硬度(?)MCaO水?105=13.31 1000
2.3 钙硬度的测定 测定钙硬度所消耗的EDTA体积如表2-3 =cEDTA?vEDTA?
初读数/mL
0.30
0.00
0.50 终读数/mL 11.20 10.56 11.47 实际体积/mL 10.90 10.56 10.97
三次消耗的平均体积V=10.81,由公式得钙的硬度(?)=cEDTA?vEDTA?MCaO水?105=9.69;则镁硬度为总硬度-钙硬度=3.62。 1000
结论
根据Lewis·G.N.酸碱电子理论,络合反应的实质是酸碱反应[3],EDTA标定的误差因素来源于指示剂和酸效应。在标定EDTA时选取指示剂应该与被测物组分相同,以减少不同滴定环境带来的误差。在测定水硬度时常将水中的盐折算成碳酸钙来作为硬度的标准。不同的水一般硬度不一样。因此在测定水硬度时应该用同一个水样。否则实验就是错误的。
参考文献
[1] 四川大学化工学院. 分析化学实验(第三版)[M]. 北京:高等教育出版社,2003:93-94.
[2]甘雄,蔡成翔,7种不同物质标定EDTA标准滴定溶液的条件控制及误差分析
[J].冶金分析,2007(4).
[3] JJF1059—1999 测量不确定度评定与表示[S].
鸣谢
感谢吴明君老师对我们的精心指导和甘雄等对此实验做贡献的人。
- 3 -
第二篇:EDTA的配制、标定和水的硬度测定
 实验5:EDTA溶液的配制和标定与水的硬度分析
实验5:EDTA溶液的配制和标定与水的硬度分析
杨兰森20096842 应化三班
摘要:练习了配制EDTA,以CaCO3为基准物质标定EDTA,并以该EDTA溶液,通过络合滴定测定实验室自来水的硬度的实验操作,学习水的硬度测定的实验方法。了解该实验的实际意义,学习运用所学原理建立实验方法,并应用于生产实践。
关键词:EDTA配制和标定 水的硬度测定
前言:水的硬度最初是指钙、镁离子沉淀肥皂的能力。水的总硬度指水中钙、镁离子的总浓度,其中包括碳酸盐硬度(即通过加热能以碳酸盐形式沉淀下来的钙、镁离子,故又叫暂时硬度)和非碳酸盐硬度(即加热后不能沉淀下来的那部分钙、镁离子,又称永久硬度)。
硬度的表示方法尚未统一,我国使用较多的表示方法有两种:一种是将所测得的钙、镁折算成 CaO 的质量,即每升水中含有 CaO 的毫克数表示,单位为 mg·L-1 ;另一种以度计:1硬度单位表示10万份水中含1份CaO( 即每升水中含 10mgCaO),1° =10ppmCaO 。这种硬度的表示方法称作德国度。
根据水的用途不同对水的硬度要求也不同,各国也有各国的标准,饮用水:水的硬度的高低与人体的关系极大。高硬度的水中的钙、镁离子能与硫酸根结合,使水产生苦涩味,还会使人的胃肠功能紊乱,出现暂时的腹胀、排气多、腹泻等现象。
生活用水:水的硬度反应了水中钙、镁等离子的多少,这些离子能够影响洗涤剂等的效果
工业用水:水中钙、镁等离子能够腐蚀管道,影响溶液的作用,如石油工业的堵水剂,降凝剂,调剖剂等都受硬度的影响。
所以测定水的硬度是非常重要的,以便于做好对应的处理工作。
综述:络合滴定是实验室常见操作,常用络合剂EDTA的配制和标定是实验室基本准备实验,本实验练习EDTA的配制,以CaCO3为基准物质标定EDTA,并以标定后的EDTA测实验室自来水硬度,实验简单易行,且有重要的实际意义。在实验中总结经验由此熟练并掌握络合滴定的方法,培养实验技能及建立实验方案的能力。
实验部分:
(一)实验目的:学习EDTA标准溶液的配制和标定方法;掌握配位滴定的原理,了解配位滴定的特点;熟悉钙指示剂的使用;了解水的硬度测定意义和常用的硬度表示方法;掌握EDTA法测定水的硬度的原理和方法;掌握铬黑T和钙指示剂的应用,了解金属指示剂的特点。
(二)实验原理:(1)标定EDTA:标定EDTA常用的基准物质有Zn、ZnO、CaCO3、Bi、Cu、MgSO4·SO4、Hg等。EDTA若用于测CaO、MgO含量则宜选用CaCO3为基准物,首先加HCl溶液:CaCO3+2HCl CaCl2+CO2+H20然后把溶液转移到容量瓶中稀释,制成钙标准溶液。吸取该钙标准溶液滴定至溶液由酒红色变纯蓝色,在pH≥12溶液中HInd2-离子与Ca2+离子形成比较稳定的配离子,HInd2-(纯蓝色)+Ca2+
CaCl2+CO2+H20然后把溶液转移到容量瓶中稀释,制成钙标准溶液。吸取该钙标准溶液滴定至溶液由酒红色变纯蓝色,在pH≥12溶液中HInd2-离子与Ca2+离子形成比较稳定的配离子,HInd2-(纯蓝色)+Ca2+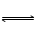 CaInd-(酒红色)+H+,EDTA能与Ca2+离子形成更稳定的配离子:CaInd2-+H2Y2-+OH-
CaInd-(酒红色)+H+,EDTA能与Ca2+离子形成更稳定的配离子:CaInd2-+H2Y2-+OH-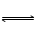 CaY2-+HInd2-+H2O终点由酒红色到纯蓝色。
CaY2-+HInd2-+H2O终点由酒红色到纯蓝色。
(2)水硬度测定:由镁离子形成的硬度称为“镁硬”,由钙离子形成的硬度称为“钙硬”,用EDTA配位滴定法测定,用铬黑T测定为总硬,用钙指示剂测为钙硬,总硬减去钙硬即为镁硬,硬度采用(°)表示,1硬度单位表示十万份水中含1份CaO即1°=10mg·L-1CaO.硬度计算式为:硬度(°)=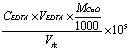
(三)仪器与试剂:酸式(或碱式)滴定管;CaCO3(固体AR);乙二胺四乙酸二钠(固体AR);钙指示剂;镉黑T指示剂;100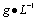 NaOH;镁溶液;1+1HCl。
NaOH;镁溶液;1+1HCl。
(四)实验方法:
(1)EDTA标定:1.配制0.015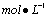 EDTA溶液:称取2.7923g左右乙二胺四乙酸二钠溶解于适量温水中,稀释至500mL转移至500mL细口瓶中。
EDTA溶液:称取2.7923g左右乙二胺四乙酸二钠溶解于适量温水中,稀释至500mL转移至500mL细口瓶中。
2.以CaCO3为基准物质标定EDTA:1标准钙溶液的配制:称取0.25~0.3g CaCO3于小烧杯中,加水润湿,在慢慢滴入1+1HCl至完全溶解,加热近沸,冷却后转移入250mL容量瓶中,稀释至刻度,摇匀。2标定:用移液管移取25mL标准钙溶液,置于锥形瓶中加入约25mL水、2mL镁溶液、5mL100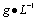 NaOH溶液及约10mg钙指示剂,摇匀后,有EDTA滴定至由红色变为蓝色,即为终点。
NaOH溶液及约10mg钙指示剂,摇匀后,有EDTA滴定至由红色变为蓝色,即为终点。
(2)水的硬度测定:1.总硬测定:量取澄清自来水100mL放入250mL锥形瓶中,加入约0.01g铬黑T指示剂,再摇匀,以配制的EDTA标准溶液滴定至纯蓝色即为终点。
2.钙硬测定:量取澄清的自来水样100mL,放入250mL锥形瓶中加4mL100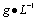 NaOH溶液,摇匀再加入0.01g钙指示剂,摇匀,此时溶液呈淡红色,用配制好的EDTA滴定至呈纯蓝色为终点。
NaOH溶液,摇匀再加入0.01g钙指示剂,摇匀,此时溶液呈淡红色,用配制好的EDTA滴定至呈纯蓝色为终点。
3.镁硬的测定:用总硬减去钙硬即得镁硬。
(五)结果与讨论:
(1)EDTA浓度的标定:
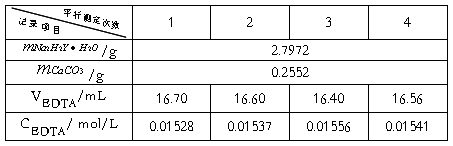
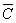 EDTA=0.01541
EDTA=0.01541 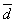 =8.0×10-5
=8.0×10-5  =
=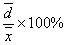 =0.519% S=1.17×10-4
=0.519% S=1.17×10-4
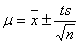 =0.01541±1.86×10-4(置信度为95%)
=0.01541±1.86×10-4(置信度为95%)
(2)水的总硬:
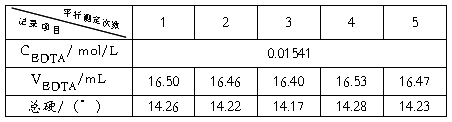
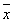 =14.23
=14.23 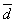 =3.04×10-2
=3.04×10-2  =
=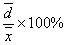 =0.214% S=4.21×10-2
=0.214% S=4.21×10-2
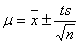 =14.23±0.0524(置信度为95%)
=14.23±0.0524(置信度为95%)
(3)水的钙硬:
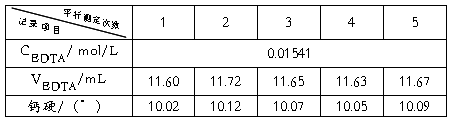
 =10.07
=10.07  =2.80×10-2
=2.80×10-2  =
=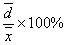 =2.78×10-3 S=3.81×10-2
=2.78×10-3 S=3.81×10-2
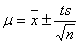 =10.07±0.0473(置信度为95%)
=10.07±0.0473(置信度为95%)
(4)水的镁硬:
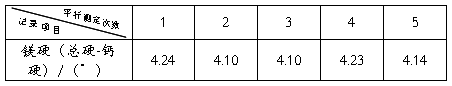
 =4.16
=4.16 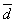 =5.84×10-2
=5.84×10-2  =
=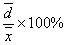 =1.40×10-2 S=6.87×10-2
=1.40×10-2 S=6.87×10-2
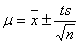 =4.16±0.0855(置信度为95%)
=4.16±0.0855(置信度为95%)
(5)EDTA配制和标定的准确度:
由于实验室蒸馏水的纯度不够,其中含Ca2+超标,致使EDTA配制和标定不能有足够准确度,实验时所配EDTA浓度比原方案稍大(0.015 mol/L),以减少实验误差。
结论
结合实验数据及结果,精密度及误差在允许范围内,满足分析实验要求,说明该实验方法可行度大,有一定重现性,是一次较成功的实验。
致谢
此次实验是在吴明君老师的精心指导下完成的,在此衷心感谢吴老师!
参考文献:
[1]:《分析化学实验》第三版(高等教育出版社)
[2]:《分析化学》.武汉大学.(高等教育出版社)
[3]:宋天佑,程鹏,王杏乔.《无机化学》.(高等教育出版社)
