实验二水总硬度的测定(配位滴定法)
实验日期:
实验目的:
1、学习EDTA标准溶液的配制方法及滴定终点的判断;
2、掌握钙、镁测定的原理、方法和计算。
一、水硬度的表示法:
一般所说的水硬度就是指水中钙、镁离子的含量。最常用的表示水硬度的单位有:
1、以度表示,1o=10 ppm CaO,相当10万份水中含1份CaO。
2、以水中CaCO3的浓度(ppm)计相当于每升水中含有CaCO3多少毫克。
MCaO—氧化钙的摩尔质量(56.08 g/mol),
MCaCO3—碳酸钙的摩尔质量(100.09 g/mol)。
二、测定原理:
测定水的总硬度,一般采用配位滴定法即在pH=10的氨性溶液中,以铬黑T作为指示剂,用EDTA标准溶液直接滴定水中的Ca2+、Mg2+,直至溶液由紫红色经紫蓝色转变为蓝色,即为终点。反应如下:
滴定前:EBT + Me(Ca2+、Mg2+) = Me-EBT
(蓝色) pH=10 (紫红色)
滴定开始至化学计量点前:H2Y2- + Ca2+ = CaY2- + 2H+
H2Y2- + Mg2+ = MgY2- + 2H+
计量点时:H2Y2- + Mg-EBT = MgY2- + EBT +2H+
(紫蓝色) (蓝色)
滴定时,Fe3+、Al3+等干扰离子用三乙醇胺掩蔽,Cu2+、Pb2+、Zn2+等重金属离子可用KCN、Na2S或巯基乙酸掩蔽。
三、主要试剂
1、0.02mol/LEDTA 2、NH3-NH4Cl缓冲溶液 3、铬黑T:0.5%
4、三乙醇胺(1:2) 5、Na2S溶液 2% 6、HCl溶液 1:1
7、CaCO3固体A.R.
四、测定过程
1、EDTA溶液的标定
准确称取在120度烘干的碳酸钙0.5~ 0. 55g 一份, 置于250ml 的烧杯中,用少量蒸馏水润湿,盖上表面皿,缓慢加1:1HCl 10ml,加热溶解定量地转入250ml容量瓶中,定容后摇匀。吸取25ml,注入锥形瓶中,加20ml NH3-NH4Cl缓冲溶液, 铬黑T指示剂2~3滴,用欲标定的EDTA溶液滴定到由紫红色变为纯蓝色即为终点,计算EDTA溶液的准确浓度。
2、水样测定
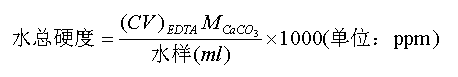
取水样100ml,注入锥形瓶中,加1:1的HCl 1~2滴酸化水样。煮沸数分钟,除去CO 2,冷却后,加入5ml 三乙醇胺溶液,5 ml NH 3-NH 4Cl缓冲溶液,1 mlNa 2S,少量铬黑T,用EDTA标准溶液滴定至溶液由紫红色变为纯蓝色即为终点。
再重复测定二次,以含CaCO3的浓度(ppm)表示硬度。
五、实验报告
1、EDTA溶液的标定

 序号 碳酸钙质量/g V(EDTA)/ml C(EDTA)/(mol·L-1) 平均值 RSD
序号 碳酸钙质量/g V(EDTA)/ml C(EDTA)/(mol·L-1) 平均值 RSD
1
2
 3
3
2、水样测定

 序号 V(水样)/ml V(EDTA)/ml 水的硬度/ppm 平均值 RSD
序号 V(水样)/ml V(EDTA)/ml 水的硬度/ppm 平均值 RSD
1
2
 3
3
注释
铬黑T与Mg2+显色灵敏度高,与Ca2+显色灵敏度低,当水样中Ca2+含量高而Mg2+很低时,得到不敏锐的终点,可采用KB混合指示剂。
水样中含铁量超过10mg·mL-1时用三乙醇胺掩蔽有困难,需用蒸馏水将水样稀释到Fe3+不超过10mg·mL-1即可。
思考题
1.配制CaCO3溶液和EDTA溶液时,各采用何种天平称量?为什么?
2.铬黑T指示剂是怎样指示滴定终点的?
3.以HCl溶液溶解CaCO3基准物质时,操作中应注意些什么?
4.配位滴定中为什么要加入缓冲溶液?
5.用EDTA法测定水的硬度时,哪些离子的存在有干扰?如何消除?
6.配位滴定与酸碱滴定法相比,有哪些不同点?操作中应注意哪些问题?
1.络合滴定中为什么加入缓冲溶液?
答:各种金属离子与滴定剂生成络合物时都应有允许最低pH值,否则就不能被准确滴。而且还可能影响指示剂的变色点和自身的颜色,导致终点误差变大,甚至不能准确滴定。因此酸度对络合滴定的影响是多方面的,需要加入缓冲溶液予以控制。
2. 用CaCO3为基准物。以钙指示剂为指示剂标定EDTA浓度时,应控制溶液的酸度为多大?为什么?如何控制?
答:用CaCO3为基准物质,以钙指示剂为指示剂标定EDTA浓度时,因为钙指示剂与Ca2+在pH=12~13之间能形成酒红色络合物,而自身呈纯蓝色,当滴定到终点时溶液的颜色由红色变纯蓝色,所以用NaOH控制溶液的pH为12~13。
3.以二甲酚橙为指示剂,用Zn2+标定EDTA浓度的实验中,溶液的pH为多少?
解: 六次甲基四胺与盐酸反应为:
(CH2)6N4+HCl==(CH2)6N+H+·Cl-
反应中盐酸的物质的量:
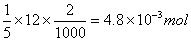
六次甲基四胺的物质的量:
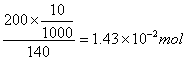
故六次甲基四胺过量。
缓冲体系中剩余六次甲基四胺的浓度为:
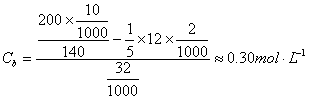
六次甲基四胺盐的浓度为:

根据一般缓冲溶液计算公式:
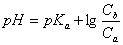 得:
得:
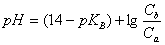

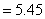
(六次甲基四胺pKb=8.85)
4.络合滴定法与酸碱滴定法相比,有那些不同点?操作中应注意那些问题?
答:络合滴定法与酸碱滴定法相比有下面两个不同点:
① 络合滴定中要求形成的配合物(或配离子)要相当稳定,否则不易得到明显的滴定终点。
② 在一定条件下,配位数必须固定(即只形成一种配位数的配合物)。
5.什么叫水的总硬度?怎样计算水的总硬度?
答:水中Ca2+、Mg2+的总量称为水的总硬度。
计算水的总硬度的公式为:
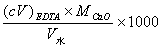 (mg·L-1)
(mg·L-1)
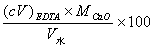 ( o )
( o )
6.为什么滴定Ca2+、Mg2+总量时要控制pH≈10,而滴定Ca2+分量时要控制pH为12~13?若pH>13时测Ca2+对结果有何影响?
答:因为滴定Ca2+、Mg2+总量时要用铬黑T作指示剂,铬黑T在pH为8~11之间为蓝色,与金属离子形成的配合物为紫红色,终点时溶液为蓝色。所以溶液的pH值要控制为10。测定Ca2+时,要将溶液的pH控制至12~13,主要是让Mg2+完全生成Mg(OH)2沉淀。以保证准确测定Ca2+的含量。在pH为12~13间钙指示剂与Ca2+形成酒红色配合物,指示剂本身呈纯蓝色,当滴至终点时溶液为纯蓝色。但pH>13时,指示剂本身为酒红色,而无法确定终点。
7.如果只有铬黑T指示剂,能否测定Ca2+的含量?如何测定?
答:如果只有铬黑T指示剂,首先用NaOH调pH>12,使Mg2+生成沉淀与Ca2+分离,分离Mg2+后的溶液用HCl调pH=10,在加入氨性缓冲溶液。以铬黑T为指示剂,用Mg—EDTA标准溶液滴定Ca2+的含量。
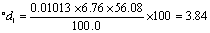
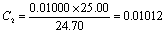
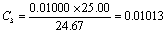
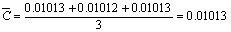

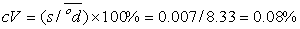
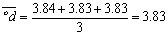
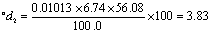

第二篇:水的硬度的测定方法(络合滴定法)
一、 实验时间、地点
二、 实验目的
1. 学会EDTA标准溶液的标定方法。
2. 掌握水中硬度的测定原理和方法。
三、 实验原理
测定自来水的硬度,一般采用络合滴定法,用EDTA标准溶液滴定水中的Ca2+、Mg2+、总量然后换算为相应的硬度单位。
用EDTA滴定Ca2+、Mg2+总量时,一般是在pH=10的氨性缓冲溶液进行,用EBT(铬黑T)作指示剂。化学计量点前,Ca2+、Mg2+和EBT生成紫红色络合物,当用EDTA溶液滴定至化学计量点时,游离出指示剂,溶液呈现纯蓝色。
由于EBT与 Mg2+ 显色灵敏度高,与Ca2+显色灵敏度低,所以当水样中Mg2+含量较低时,用EBT 作指示剂往往得不到敏锐的终点。这时可在EDTA标准溶液中加入适量的Mg2+(标定前加入Mg2+对终点没有影响)或者在缓冲溶液中加入一定量Mg2+—EDTA盐,利用置换滴定法的原理来提高终点变色的敏锐性,也可采用酸性铬蓝K-萘酚绿B混合指示剂,此时终点颜色由紫红色变为蓝绿色。
滴定时,Fe3+、Al3+ 等干扰离子,用三乙醇胺掩蔽;Cu2+、Pb2+、Zn 2+ 等重金属离子则可用KCN、Na2S 或硫基乙酸等掩蔽。
若测定时温度过低,可将水样加热至30~40℃,滴定时注意速度不可过快,并不断摇动,使充分反应。
四、 实验内容
五、 实验环境和器材
1. 250mL锥形瓶2个。
2. 25mL酸式滴定管一支。
3. 50mL移液管一支。
4. 10mL量筒一个。
5. 250mL烧杯一支。
6. 0.01gmol/L EDTA标准溶液的配置:称取1.4g EDTA二钠盐,溶解于50mL温热水中,稀释至250mL,摇匀,转移至250mL具玻璃塞的试剂瓶中。
7. CaCO3标准溶液配置:用减量法准确称取已在110℃干燥过的CaCO3约0.1~0.6g于100ml烧杯中,加水润湿,盖上表面皿,再从杯嘴逐滴加入HCL至完全溶解后,加热煮沸,用水把可能溅到表面皿上的溶液淋洗入杯中,待冷却后移入250ml容量瓶中,稀释至刻度,摇匀,计算其准确浓度。
8. EDTA溶液的标定:用移液管吸取25ml钙标准溶液,置于250ml锥形瓶,加250ml蒸馏水,加入适量固体钙指示剂,在搅拌下滴加20%氢氧化钠溶液至出现酒红色后再过量0.5~1ml,以EDTA溶液滴定至纯蓝色,即为终点。平行标定两次,计算EDTA的准确浓度。
9. 缓冲溶液:称取20g分析纯NH4Cl溶于少量蒸馏水,加入100ml浓氨水,加Mg-EDTA溶液,用蒸馏水稀释至1L。
10. Mg-EDTA溶液制备方法:称取0.25g分析纯MgCl2·6H2O于100ml烧杯中,加少量蒸馏水,溶解后转入100ml容量瓶中,稀释至刻度。用移液管吸取50ml放入锥形瓶中,加缓冲溶液5ml,铬黑T少许,用0.01gmol/L EDTA滴定至溶液刚呈蓝色;取与此同等量的EDTA溶液,加入容量瓶中剩余的MgCl2 溶液中,摇匀;即成Mg-EDTA溶液。将此溶液全部倒入上述缓冲溶液中。
11. 铬黑T指示剂或钙指示剂:取1份指示剂和100份分析纯氯化钠混合研细。
12. 10%盐酸羟氨:此溶液易分解,用时新配。
13. 2%Na2S溶液。
六、 实验步骤
1. 用移液管取水样50ml,放入锥形瓶中。
2. 加盐酸羟氨溶液5滴。
3. 滴加铬黑T溶液一滴,溶液呈紫红色。
4. 加缓冲溶液5ml。
5. 用EDTA标准溶液滴定,将近终点时,因反应较慢,要充分摇荡。滴至溶液由紫红色转变为蓝色时,即为终点。记录EDTA用量。
七、 实验结果与计算
计算
CV1
总硬度(mmol/L) = ---------------
V0
CV1
总硬度(CaCO3mg/L) = --------------- ×100.1
V0
式中:c ---- EDTA标准溶液浓度,mmol/L;
V1 ---- 消耗标准溶液的体积,mL;
V0 ----水样的体积,mL;
100.1----碳酸钙的换算系数。
八、 提出问题
九、 注意事项
碱度数据
盐酸的标定
