BZ振荡反应
一.实验目的及要求
1. 了解Belousov-Zhabotinsli反应的基本原理。
2. 初步理解自然界中普遍存在的非平衡非线性问题。
二.教学提问
1.什么是非平衡非线性原理?什么是耗散结构?
2.BZ体系由那些物种构成?振荡的控制物种是什么?
3.配制溶液过程中,要注意那些问题?
4.温度与诱导时间的关系如何?
二.实验原理
1.自催化反应
在给定条件下的反应体系,反应开始后逐渐形成并积累了某种产物或中间体,这些产物具有催化功能,使反应经过一段诱导期后出现大大加速的现象,这种作用称为自(动)催化作用。其特征之一是存在着初始的诱导期。
大多数自动氧化过程都存在自催化作用。油脂腐败,橡胶变质以及塑料制品的老化均属于包含链反应的自动氧化过程,反应开始进行很慢,但都被其所产生的自由基所加速。
2.化学振荡
有些自催化反应有可能使反应体系中某些物质的浓度随时间(或空间)发生周期性的变化,即发生化学振荡,而化学振荡反应的必要条件之一是该反应必须是自催化反应。化学振荡现象的发生必须满足如下几个条件:(1)反应必须是敞开体系且远离平衡态,即△rGm为较负的值。(2)反应历程中应包含自催化的步骤。(3)体系中必须能有两个准定态存在。
曾经提出过不少模型来研究化学振荡的反应机理,下面介绍洛特卡(Lotka)-沃尔特拉(Voltella)的自催化模型。
(1) A+X 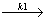 2X r1=-
2X r1=-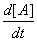 =k1[A][X]
=k1[A][X]
(2) X+Y 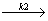 2Y r2=-
2Y r2=-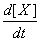 =k2[X][Y]
=k2[X][Y]
(3) Y 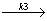 E r3=
E r3= 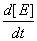 = k3[Y]
= k3[Y]
其净反应是A  E。对这一组微分方程求解得:
E。对这一组微分方程求解得:
k2[X]-k3ln[X]+ k2[Y]+ k1[A]ln[Y]=常数
这一方程的具体解可用两种方法表示,一种是用[X]和[Y]对t作图,如图1,其浓度随时间呈周期性变化;另一种是以[X]对[Y],得反应轨迹曲线,如图2,为一封闭椭圆曲线。反应轨迹曲线为封闭曲线,则X和Y的浓度就能沿曲线稳定地周期变化,反应变呈振荡现象。
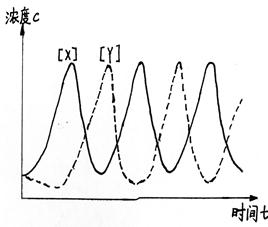
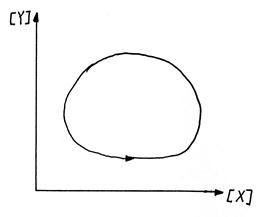
图1 [X]和[Y]随时间的周期性变化 图2 反应轨迹曲线
中间产物X、Y(它们同时也是反应物)的浓度的周期性变化可解释为:反应开始时其速率可能并不快,但由于反应(1)生成了X,而X又能自催化反应(1),所以X骤增,随着X的生成,使反应(2)发生。开始Y的量可能是很少的,故反应(2)较慢,但反应(2)生成的Y又能自催化反应(2),使Y的量骤增。但是增加Y的同时是要消耗X的,则反应(1)的速率下降,生成X的量下降,而X量的下降又导致反应(2)速率变慢。随着Y量变少,消耗X的量也减少,从而使X的量再次增加,如此反复进行,表现为X、Y浓度的周期变化。浓度最高值、最低值所在的点对应着两个准定态。
3.非平衡非线性理论和耗散结构
非平衡非线性问题是自然科学领域中普遍存在的问题。化学的基本规律是非平衡的,这容易理解,因为处于平衡态的化学反应系统不会发生宏观的化学变化。化学的基本规律又是非线性的。非线性是相对于线性而言的,而线性是指因变量与自变量满足线性关系的函数特性。化学中涉及的许多函数关系都是非线性的:例如化学反应速率通常是参加反应的各种组分的浓度的非线性函数,等等。
传统化学热力学理论(平衡理论)和动力学理论(线性理论)不能解释一些现象,如某些反应系统中自发产生时间上或空间上高度有序状态的现象(自组织现象),而这可以用非平衡非线性理论加以解释。自上世纪60年代以来,非平衡非线性理论引起了人们的重视。
非平衡非线性理论研究的主要问题就是耗散结构。
耗散结构论认为:一个远离平衡态的开放体系,通过与外界交换物质和能量,在一定条件下,可能从原来的无序状态转变为一种在时间、空间或功能上有序的状态。形成的新的有序结构是靠不断耗散物质和能量来维持的,称为“耗散结构”。
耗散结构是在开放和远离平衡的条件下,在与外界环境交换物质和能量的过程中通过内部的非线性动力学机制来耗散环境传来的能量与物质从而形成和维持宏观时空有序的结构。
4.BZ振荡反应
BZ体系是指在酸性介质中,有机物在有(或无)金属离子催化的条件下,被溴酸盐氧化构成的体系。这个体系在反应过程中某些中间组分的浓度发生周期性变化,外观表现为反应溶液呈黄色和无色的交替变化,即发生化学振荡现象。BZ化学振荡反应具有耗散结构的特征,是最典型的耗散结构,它是在1958年由苏联科学家别诺索夫(Belousov)和柴伯廷斯基(Zhabotinski)发现而得名。
1972年,R. J. Fiela、E. Koros、R. Noyes等人通过BrO3-~Ce4+~MA~H2SO4体系的实验对BZ振荡反应作出了解释,即提出了FKN机理。其主要思想是:当体系中存在着两个受溴离子浓度控制的过程A和B,当[Br-]高于临界浓度时[Br-]crit时发生A过程,当[Br-]低于[Br-]crit时发生B过程。也就是说[Br-]起着开关的作用,它控制着从A到B的过程,再由B到A的过程的转变。在A过程由于反应的消耗[Br-]降低,当[Br-]<[Br-]crit时,B过程发生。在B过程中[Br-]再生,[Br-]增加,当[Br-]>[Br-]crit时,A过程再次发生,这样体系就在A, B过程之间往复振荡。下面以FKN机理对BrO3-~Ce4+~MA~H2SO4体系加以解释。
当[Br-]>[Br-]cri时,发生下列A过程:
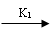 BrO3- + Br- + 2H+ HBrO2 + HOBr
BrO3- + Br- + 2H+ HBrO2 + HOBr
(K1 = 2.1 mol.L9.s-1 , 250C ) (1)

HBrO2 + Br- + H+ 2HOBr
(K2 = 2×10 9 mol-2.L6.s-1 , 250C ) (2)
其中第一步是速率控制步,当达到准定态时,有[HBrO2]= 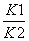 [BrO3-][ H+]。
[BrO3-][ H+]。
当[Br-]<[Br-]cri时,发生下列B过程,Ce3+被氧化:
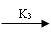
BrO3- + HBrO2 + H+ 2BrO2 + H2O
(K3 = 1×10 4mol-2.L6.s-1 , 250C ) (3)

BrO2 + Ce3+ + H+ HBrO2 + Ce4+ (K4=快速) (4)

2HBrO2 BrO3- + HOBr + H+
(K5 = 4×10 7mol-1.L.s-1 , 250C ) (5)
反应(3)是速度控制步,反应经(3),(4)将自催化产生HBrO2,到达准定态时
[HBrO2]≈
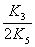 [BrO3-][ H+]
[BrO3-][ H+]
由反应(2)和(3)可以看出:Br- 和BrO3-是竞争HBrO2的。当K2[Br-]>K3[BrO3-]时,自催化过程(3)不能发生。自催化是BZ振荡反应中必不可少的步骤,否则振荡反应不能发生。Br-的临界浓度为:
[Br-]crit=
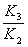 [BrO3-] = 5×10-6 [BrO3-]
[BrO3-] = 5×10-6 [BrO3-]
 Br-的再生可通过下列步骤实现:
Br-的再生可通过下列步骤实现:
4Ce4+ + BrCH(COOH)2 +H2O + HOBr 2 Br- + 4 Ce3+ + 3CO2 + 6 H+ (6)
该体系的总反应是:

2H+ + 2 BrO3- + 3CH2(COOH)2 2 BrCH(COOH)2 + 3CO2 +4 H2O (7)
振荡的控制物种是Br-。
5.实验装置及有关电势曲线的解释
实验装置如图3所示,图4是实验记录电势曲线的示意图。
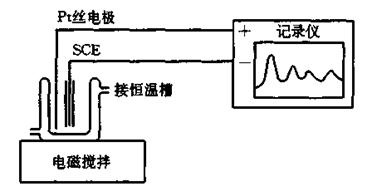
图3 实验装置
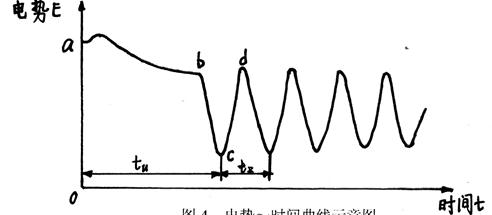
图4 电势~时间曲线示意图
电池由铂电极、甘汞电极和反应溶液组成。记录仪记录的电势是溶液中各种电对电位的综合电势,其中起主导作用的是Ce4+/ Ce3+氧化还原电对。电势~时间曲线反映了体系实测电势与时间的关系,曲线也反映了因Ce4+/ Ce3+电对的活度比变化产生的电势变化特点,曲线也反映了振荡过程中中间组分的浓度~时间的关系,从而可以得到振荡反应的特征并加以研究。
硫酸铈铵溶液加入体系后,体系中主要存在的是Ce4+,而Ce3+量较少,此时φ(Ce4+/ Ce3+)较大(对应于电势曲线中的a点)。反应(6)缓慢地进行,Ce4+逐渐减少,同时生成Br-(对应于ab段)。当[Br-]达到[Br-]crit时(对应于b点),发生A过程,所产生的HOBr加速了反应(6)的进行,Ce4+的量骤减,Ce3+的量骤增,φ(Ce4+/ Ce3+)急剧下降(对应于bc段),实验现象表现为溶液由黄色逐渐变为无色。随着Ce4+的减少,反应(6)的速率减慢,生成Br-量减少,而A过程消耗Br-,使[Br-]下降。当[Br-]下降到[Br-]crit时(对应于c点),发生B过程。这是一个自催化过程,Ce4+的量骤增,Ce3+的量骤减,φ(Ce4+/ Ce3+)急剧上升(对应于cd段),实验现象表现为溶液由无色逐渐变为黄色。Ce4+的增多使反应(6)提速,[Br-]上升,直到[Br-]crit(对应于d点)。
整个体系处于化学振荡过程中,振荡的控制物种是Br-,[Br-]、[Ce4+]、[Ce3+]都周期性变化。c点[Ce4+]有极小值,[Ce3+]有极大值;d点[Ce4+]有极大值,[Ce3+]有极小值。这两个点对应着体系的两个准定态。
在不同的温度下测定电势~时间曲线,分别从曲线中得到诱导时间tu和tz,根据Arrhenius方程,ln1/tu(或ln1/tz)=-E/RT+lnA,分别作ln1/tu~1/T和ln1/tz~1/T图,从图中曲线斜率分别得到表观活化能Eu和Ez,同时也可得到经验常数Au和Az。
三.仪器与药品
反应器 100mL1只,超级恒温槽1台,磁力搅拌器1台,数字电压表1台。
丙二酸 (A.R) 溴酸钾(G.R)硝酸铈铵(A.R) 浓硫酸(A.R)。
四.实验步骤
1. 按图3联好仪器,打开超级恒温槽,将温度调节至25.0。
2. 配置0.45mol/L丙二酸100mL,0.25mol/L溴酸钾100mL(需水浴加热溶解),硫酸3.00mol/L100mL,4×10-3mol/L硝酸铈铵100mL(在0.20mol/L硫酸介质中配制)。
3. 在反应器中加入已配好的丙二酸溶液,溴酸钾溶液,硫酸溶液各15mL,恒温5min后加入硝酸铈铵溶液15mL,观察溶液颜色的变化,由显示的电势曲线到达第一个峰值时记下相应的诱导时间t诱。
4. 用上述方法改变温度为30℃,35℃,40℃,45℃,50℃重复试验(后三个温度需做两次取均值)。
五.注意事项
1.实验中溴酸钾纯度要求高。
2.217型甘汞电极用1mol/L硫酸作液接。
3.配制0.004mol/L硫酸铈铵溶液时,一定要在0.20mol/L硫酸介质中配制,防止发生水解呈混浊。溴酸钾溶解度小,需用热水浴加热溶解。
4.反应容器一定要冲洗干净;电极要插入液面下;转子位置和速度要加以控制,不能碰到电极。
5.反应溶液(包括硫酸铈铵溶液)需预热。
六.数据处理
根据t诱与温度数据作ln(1/t诱)~1/T图,求出表观活化能。
斜率k=-6446.9K
Ea=-Rk=-8.314J·K-1·mol-1×(-6446.9K)=5.36×104 J·mol-1=53.6k J·mol-1
七.思考题
1. 影响诱导期的主要因素有哪些?
答:影响诱导期的主要因素有:
a) 温度。温度越高,诱导期越短。
b) 溶液的浓度。本实验中溶液的浓度对结果的影响相对较小。
c) 溶液中是否含有氧化还原的离子,对实验结果的影响很大,因为本实验测的是反应的诱导时间,溶液中含有氧化还原的离子,对诱导时间的影响最大。
2.本实验的电势主要代表什么意思,与Nernst方程求得的电位有什么不同?
答:本实验记录的电势代表振荡过程的系统的综合电势,主要反映了反应过程中离子的浓度随着反应进程的变化,是非平衡态的电势。而Nernst方程求得的电位是平衡时的电势,而且Nernst方程标准氢电极为参比电极,而本实验用甘汞电极为参比电极。对于非线性非平衡体系电极电势没有数学表达式,只有测定电势。所以Ce4+/ Ce3+电对的电位不可以用能斯特方程表示:
φ(Ce4+/ Ce3+)=φθ(Ce4+/ Ce3+)-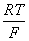 ln
ln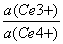
八.讨论
1.耗散结构的定义说明了这种结构的特点;这种结构的状态用非线性方程描述;非平衡非线性理论用于研究耗散结构
2.耗散结构的出现与热力学第二定律并不矛盾
热力学第二定律告诉我们:自发过程总是使体系朝混乱度最大的方向进行的,相反方向 ——从无序向有序的转化是不可能的。但这个结论只是从孤立体系中以及在偏离平衡不远的条件下总结出来的,而耗散结构是在开放体系中在远离平衡态的条件下出现的。在一个开放体系中【1】,除了考虑体系内部的熵之外,还必须考虑体系与外界熵的交换。开放体系的总熵变:
dS=diS+deS ( 1 )
式中diS 是不可逆过程引起的体系内部的熵产生,diS≥ 0 ,此值不可能为负。deS 是体系与外界环境进行物质和能量交换时引人的熵流,它可正、可负、也可为零。对于孤立体系:
dSe=0 (2) dS= diS ≥ 0 ( 3 )
这就是热力学第二定律的数学表达式。它告诉我们:孤立体系的熵永不减少,在这里体系只能由有序趋向无序。对于一个开放体系,在人 deS < o 的情况下,只要这个负熵流足够强,它除了抵消体系内部的熵产生diS 外,还能使体系的总嫡减少,就可使体系朝着有序的方向发展,进人相对有序的状态。若熵流恰好抵消体系内部的嫡产生,体系就处于宏观性质不随时间而改变的定态。由此可见熵增加原理只是后来发展起来推广到开放体系的熵产生原理的一个特例。体系有序状态的出现不是不可能的。
3.除平衡态之外,非平衡态也能否稳定下来
平衡态是体系内所有宏观性质均匀且不随时间而改变的稳定状态。平衡态公理告诉我们:一个孤立体系,不管它原处于什么状态,只要时间足够长,它必趋于唯一的平衡态,而且永远不能自动地离开它。但下面的实验告诉我们,一个非平衡态——定态也是可以稳定下来的。若把一根金属棒与两个恒温大热源 C , D 接触,并且 Tc >TD。经过一段时间后,金属棒内部就会形成一端高一端低的不均匀温度分布,但各点的温度是不随时间而变化的,即达到定态。此时体系内部存在着一种宏观物理量的流动,热流,因此它不是平衡态。但只要 Tc 、TD温度保持不变,无论时间多长,金属棒永远不会发展到平衡态。可见在特定的外界非平衡条件下,体系的非平衡状态是可以稳定下来的。但这种定态的存在是以热量不断地从高温热源向低温热源流动为代价的。
4.误差分析
a)温度:
实验中测得的温度可能与实际温度有差距,因为反应体系是通过恒温水加热的。若加热时间不够长,则体系温度未达到恒温水温度;另一方面,测温计也存在误差。
要减小误差,应保证足够的恒温时间,并保证转子的搅拌速度,使体系温度尽量与恒温水一致。反应溶液应先预热。
b)系统误差
计算机系统在测量t诱时,由于数据图线分辨率较低,程序不能很好判断出起始点,将造成相当大的误差。40℃,45℃,50℃时分别测了两次,从数据看来,相差较大。
5.实验总结
本实验步骤较简单,电脑化由程度高,误差主要来自电脑程序的测量误差。温度的影响也较大,所以需要通过充分预热,调节合适的转子转速的措施来控制好温度。
实验能明显的看到振荡过程,定性方面很成功。
在定量方面,最终实验数据线性一般,多次实验的相对相差也不小,有必要对测量程序作改进。
另外,配制溶液的量原来的250ml减为100ml,而实验需要使用90ml溶液,且有荡洗等过程要耗用溶液。这样,一旦实验过程中出现操作失误或其他一些偶然因素(如停电引起数据采集中断),学生就只能少得到几组数据,这就直接影响到实验的结果。建议增加学生配制的溶液量,给学生失误的空间。
耗散结构论简介中的几个要点
高月英(北京大学化学与分子工程学院 1 田 871 )
摘要简单扼要地叙述了耗散结构论简介中的几个讲授要点。这些要点是:耗散结构论的出现与热力学第二定律并不矛盾;除平衡态之外非平衡态能否稳定下来?自组织现象的特点;耗散结构的动力学方程中非线性项的意义;正反馈机制使体系中出现巨涨落;耗散结构与体系的演化。
耗散结构论是比利时科学家 I.Prigogine 等人经过几十年的努力创立的新兴理论。耗散结构论认为:一个远离平衡态的开放体系,通过与外界交换物质和能量,在一定条件下,可能从原来的无序状态转变为一种在时间、空间或功能上有序的状态。形成的新的有序结构是靠不断耗散物质和能量来维持的,称为“耗散结构”。耗散结构论是一门新兴学科。它所提供的新概念、新方法适用于自然科学和社会科学的各个领域,已得到了广泛的应用。但由于它涉及的面较广,需要的数学知识又比较复杂,不少人对它还很陌生。生物体本身就是依靠与外界交换物质和能量维持着的耗散结构。我在给生物系学生讲授物理化学课时介绍了耗散结构论,学生们对此很感兴趣。在进入 21 世纪的教学内容和教学方法改革之际,把讲授要点整理如下,抛砖引玉,为新世纪的教学改革尽一点微薄之力。
一、耗散结构的出现与热力学第二定律并不矛盾
热力学第二定律告诉我们:自发过程总是使体系朝混乱度最大的方向进行的,相反方向 ——从无序向有序的转化是不可能的。但这个结论只是从孤立体系中以及在偏离平衡不远的条件下总结出来的,而耗散结构是在开放体系中在远离平衡态的条件下出现的。在一个开放体系中【1】,除了考虑体系内部的熵之外,还必须考虑体系与外界熵的交换。开放体系的总熵变:
dS=diS+deS ( 1 )
式中diS 是不可逆过程引起的体系内部的熵产生,diS≥ 0 ,此值不可能为负。deS 是体系与外界环境进行物质和能量交换时引人的熵流,它可正、可负、也可为零。对于孤立体系:
dSe=0 (2) dS= diS ≥ 0 ( 3 )
这就是热力学第二定律的数学表达式。它告诉我们:孤立体系的熵永不减少,在这里体系只能由有序趋向无序。对于一个开放体系,在人 deS < o 的情况下,只要这个负熵流足够强,它除了抵消体系内部的熵产生diS 外,还能使体系的总嫡减少,就可使体系朝着有序的方向发展,进人相对有序的状态。若熵流恰好抵消体系内部的嫡产生,体系就处于宏观性质不随时间而改变的定态。由此可见熵增加原理只是后来发展起来推广到开放体系的熵产生原理的一个特例。体系有序状态的出现不是不可能的。
二、除平衡态之外,非平衡态能否稳定下来?
平衡态是体系内所有宏观性质均匀且不随时间而改变的稳定状态。平衡态公理告诉我们:一个孤立体系,不管它原处于什么状态,只要时间足够长,它必趋于唯一的平衡态,而且永远不能自动地离开它。但下面的实验告诉我们,一个非平衡态——定态也是可以稳定下来的。若把一根金属棒与两个恒温大热源 C , D 接触,并且 Tc >TD。经过一段时间后,金属棒内部就会形成一端高一端低的不均匀温度分布,但各点的温度是不随时间而变化的,即达到定态。此时体系内部存在着一种宏观物理量的流动,热流,因此它不是平衡态。但只要 Tc 、TD温度保持不变,无论时间多长,金属棒永远不会发展到平衡态。可见在特定的外界非平衡条件下,体系的非平衡状态是可以稳定下来的。但这种定态的存在是以热量不断地从高温热源向低温热源流动为代价的。
三、自组织现象
在介绍耗散结构论时,必定要涉及到 Benard对流、激光、化学振荡等实验现象。其中最重要的一点是“自组织现象”。在这些现象中,当某些控制量:例如, Ben 耐对流中两板的温差、激光器中输人能量的功率、 B- Z 反应中,各反应物浓度的比例等,比较小时,体系中不出现任何异常;但当控制量超过一定的临界值时,体系中出现了宏观上有序的结构。要强调的是:宏观有序的产生根源不在于外部环境而在于体系内部。在对流现象中,改变的只是上下板的温差,此温差又是均匀地分布在板平面上的。外部条件不可能使不同部位的流体具有不同的流速,形成“蛋卷”式的对流。是体系内部那些分子自己组织了起来,造成了宏观大的分子数在宏观长的时间内有条不紊地运动,这就打破了流体分子随机无规则运动的热传导状态,呈现出宏观有序的对流花纹。在化学振荡中,外界控制的只是反应物质的浓度和体系的温度。这不可能使体系中各处反应几率产生差别,更不可能使某些物种的浓度随时间发生持续振荡。反应体系颜色周期性变化,容器中出现宏观有序的漂亮花纹也都是微观粒子自组织的结果。自组织使它们的浓度在某特定时间或空间一致地增减。激光的形成也是如此。外部的特定环境只是提供了触发体系宏观有序的条件,整齐的组织是体系内部自发形成的。自组织过程可用一简单的例子说明[2]。
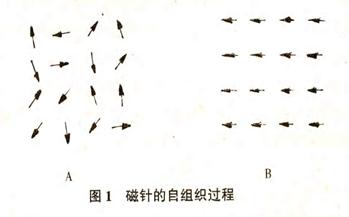
如图 lA,在无任何外磁场的情况下,小磁针的取向是随机的,杂乱无章的。每一个磁针产生的小磁场互相抵消,体系的磁场强度为零。每个小磁针可自由地摆动,但由于体系温度不高、磁针动能不大、摆动幅度较小等原因,整个体系仍处于无组织状态。若升高温度增加磁针的动能,在某一瞬间,两个磁针的方向恰好一致,那么,它们在空间产生的磁场会对附近的磁针产生影响,第三个磁针会在前两个磁针形成的小磁场中定向。三个磁针形成的磁场强度更大,第四、第五个磁针也就随着定向,很快所有的磁针方向一致,它们自组织起来,形成了宏观有序的结构(图 IB )。这种结构一旦形成,再要改变它,例如,要改变图中某个小磁针的定向,就比较困难了。在整个过程中,外界只是升高了温度,增加了小磁针的动能,并没有强迫小磁针定向,但体系中的自组织现象确实出现了。
四、耗散结构的动力学方程中非线性项的意义
耗散结构只是一种概念,是一种在体系失稳后可能出现的事物,要在理论上证实它们的存在,揭示它们的行为,必须具体地分析体系及体系中发生的过程。体系处于非平衡态,其内部必有“流”和“势”存在着的宏观动力学过程。体系发展到哪个状态必须依靠动力学方程以及适当的数学分析来研究。从数学上来看,一个动力学过程可用一组微分方程(常微分或偏微分)来描述。体系的某个状态就是相应的动力学方程的某个特解。状态失稳相当于微分方程的特解失稳。因此,涉及到数学上的稳定性理论。稳定性理论告诉我们,若初始值靠近某个特解,当 t > t 。时,初始值的所有解总靠近这个特解,这个解就是稳定的;当 t > t 。时,初始值的所有解都离它而去,这个解就是不稳定的。但是,一个不稳定的特解不能描述在宏观时间间隔内出现的时空有序结构,这种结构的存在相当于微分方程有稳定解。所以描写能形成耗散结构体系的动力学过程的微分方程必须既有不稳定的特解,又有稳定的特解。按微分方程理论,具有这样的特解的微分方程必须是非线性的。方程中必须包括适当的非线性反馈项。只有这种非线性方程组才能有多个定态解,才能出现分支现象。
例如,对于最简单的单变量体系【1】 ,描写体系状态变化的状态变量 X 随时间变化的动力学方程为:

 (4 )
(4 )
式中 X 又可用来说明体系的有序程度,又叫序参量。序参量值为零,表示体系处于无序的热力学平衡态;其值不为零,则表示体系处于耗散结构状态。 A 代表外界对体系的控制,叫控制参量。若序参量方程是线性的,例 f ( X , A ) = ( A 一 AC) X ,那么:
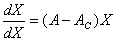 (5 )
(5 )
式中 Ac 为一固定值,就是前面提到的临界值。此方程只有一个定态解 X = 0 ,它是热力学分支解。用稳定性理论对它分析得出:当 A < Ac 时,此解对应的热力学分支是稳定的;当 A > Ac 时,此解失稳。显然,线性序参量方程只有序参量为零的唯一定态解,而且当时间 t 趋于无穷大时,序参量最终只有零(稳定)和无穷大(失稳)两种归宿,不可能引伸出耗散结构分支来。若序参量方程是非线性的,即 f ( X , A )是 X 的非线性函数,例如, f ( X , A ) = ( A 一 AC ) X-X3 ,在原( A 一 AC)X 上引人一个非线性项-X3,情况就大不相同了。此时方程为:
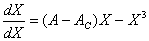 (6 )
(6 )
方程有三个定态解:X=0和 X =±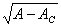 。当 A < AC时,
。当 A < AC时,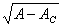 为虚数,没有物理意义,只有热力学分支解 X =0 ,而且它是稳定的。当 A > Ac 时,尽管 X= 0 解存在,但它不再稳定。不过,它不会无穷发展下去,非线性项一X3的存在把序参量限制在一个有限而非零值上。因为当 A > AC 时,X=±
为虚数,没有物理意义,只有热力学分支解 X =0 ,而且它是稳定的。当 A > Ac 时,尽管 X= 0 解存在,但它不再稳定。不过,它不会无穷发展下去,非线性项一X3的存在把序参量限制在一个有限而非零值上。因为当 A > AC 时,X=±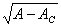 为实数,有物理意义。而且当t趋于无穷大时,它们是稳定的。它们相当于耗散结构分支。这里,非线性项发挥了它的奇特作用,它使热力学分支失稳后序参量并不无穷发散,而是收敛到序参量不为零的耗散结构分支上去。若以控制变量 A 为横坐标,以状态参量 X为纵坐标作图可得图 2o 图中实线表示稳定解,虚线表示不稳定解, Ac 是临界值,又叫分支点。
为实数,有物理意义。而且当t趋于无穷大时,它们是稳定的。它们相当于耗散结构分支。这里,非线性项发挥了它的奇特作用,它使热力学分支失稳后序参量并不无穷发散,而是收敛到序参量不为零的耗散结构分支上去。若以控制变量 A 为横坐标,以状态参量 X为纵坐标作图可得图 2o 图中实线表示稳定解,虚线表示不稳定解, Ac 是临界值,又叫分支点。

非线性项的实义是体系内存在着非线性相互作用。非线性相互作用是体系内自发地对构成体系的各个部分进行组织和协调的能力。是各部分间的一种“通信”机制,是促使体系从量变到质变,出现新的时空有序结构的动力。有了这种作用,才能使体系各部分间产生协同作用和相干效应,才能使体系不是各个部分的简单叠加,而构成一个有机的整体。
五、正反馈机制使体系中出现巨涨落
开放体系、远离平衡态是形成耗散结构所需的外部条件,但能形成耗散结构的体系内部还必须具有非线性的正反馈机制,这是内部条件。反馈是系统的输出回送到输入,影响系统再输出的过程。正反馈是一种自我复制、自我放大的机制。激光中的受激辐射、化学反应中的自催化、生物体系中的繁殖都是正反馈。
涨落是体系在某一时刻的实际物理量与其统计平均值的偏差。一般来说,任何体系内部都始终存在着随机的涨落。但不同体系对涨落的应答是不同的。随机涨落对体系变化的影响与体系所处的状态和条件相关。当体系处于平衡态时,这种涨落强度不大且随时间而衰减,体系最终回到原来状态。但当体系远离平衡态,体系内具有正反馈机制时,偏离平均值的微小涨落被正反馈机制不断放大,变成“巨涨落”,体系的原状态就失稳。在非线性相互作用下,使构成体系的各部分间相互制约、相互耦合、相互作用形成时空有序的耗散结构。
六、耗散结构与体系的演化
耗散结构是一种有序结构,但它与晶体中的点阵结构是完全不同的【2】。前者是宏观数量级上的有序,可用毫米、厘米甚至米去度量。后者是微观结构的有序,重复单元是离子、原子或分子。前者是一种动态的、变化着的、“活”的有序结构,这种结构随时间或在空间中呈现出有规律的周期性的变化。后者却是一种静止的、“死”的有序结构,一旦形成,它不会随时间、空间不同而变化。前者是必须不断地与外界交换物质和能量才能维持的,必须与环境共存的结构。后者是不依赖于环境,可以在孤立情况下维持的平衡结构

图 3 高级分支现象
一个远离平衡态的开放体系,在一定的条件下,可以由原来无序的混乱状态转变成一种时间、空间或功能上有序的新状态。若进一步改变控制参量,例如提高 Benard 实验中的△ T 值,已经形成的耗散结构也会失稳,进而形成更高级的耗散结构[3]。如此一步步发展下去,在状态变量——控制参量为坐标的图上会出现生物“进化树”似的图象,如 A图 3 。各个状态彼此相隔,不能随便逾越,很像微观世界中的“量子化”。随着高级分支的不断继续,状态间的间隔越来越小,图上将出现混沌区。此时体系的行为完全是随机的,状态是无序的。但混沌不是简单的无序,它是一种宏观上无序而微观上有序的状态。若有足够的精密手段,可以发现它具有无穷多个内部结构,它是无序中的有序。由此看来,前面讨论的耗散结构只是一种处于热力学平衡的无序和混沌态之间的状态。物质世界本来是复杂的,自然界中的变化也是多种多样的,可从无序变到有序,也可从有序变到无序或混沌。讲清这些要点之后,可使同学们对耗散结构论的框架有一个基本的了解。
沈小峰.胡岗,姜璐耗散结构论 上海人民出版社, 1987
颜泽贤 耗散结构与系统演化 福建人民出版社, 1987,
李如生 非平衡态热力学和耗散结构 清华大学出版杜, 1986
