2013学年第一学期期中考试高二化学试题
说明:(1)本场考试时间为90分钟,总分100分;
(2)请认真答卷,并用规范文字书写。
相对原子质量: H~1 O~16 Na~23 Mg~24 Al~27 Fe~56 Zn~65 Ag~108 Cl~35.5
Ba~137 N~14 S~32
一、选择题(共44分,每题只有一个正确答案,答案填写在答卷中) ....
1、国际互联网上报道:“目前世界上有近20亿人患有缺铁性贫血。这里的“铁”是指
A、铁单质 B、铁元素 C、四氧化三铁 D、三氧化二铁
2、下列物质中,属于纯净物的是
A、明矾 B、铝热剂 C、赤铁矿 D、碱石灰
3、铝能用于冶炼难熔的金属,这是因为铝具有
A、两性 B、优良的导电性 C、低的熔点 D、还原性,且在冶炼反应中放出大量热
4、下列不是黑色化合物的是
A、Fe2O3 B、FeS C、Fe3O4 D、FeO
5、金属能导电的原因
A、金属晶体中金属阳离子与自由电子间的相互作用较弱
B、金属晶体中的自由电子在外加电场作用下可发生定向移动
C、金属晶体中的金属阳离子在外加电场作用下可发生定向移动
D、金属晶体在外加电场作用下可失去电子
6、下列物质中,不能用金属单质跟非金属单质直接化合制得的是
A、FeS B、FeCl2 C、CuCl2 D、CuO
7、Fe、Mg、Al三种金属分别与1mol/L的盐酸反应,产生的氢气体积相同(相同状况),则参加反应的
金属
A、质量相等 B、物质的量相等 C、失电子数相等 D、反应速度相等
8、有A、B两份铝粉,A中加入足量NaOH溶液,B中加入足量盐酸,A、B两份铝粉反应收集到的氢气
物质的量之比为1∶2,则两份铝质量比为
A、1∶2 B、2∶1 C、1∶4 D、1∶1
9、下列物质反应时,不会产生H2 的是
A、红热的铁和水蒸气 B、 Al和稀硫酸
C、Fe和稀HNO3 D、 Al 和NaOH溶液
10、由下列反应:Cu+2FeCl3→2FeCl2+CuCl2,CuCl2+Fe→FeCl2+Cu,确定Fe2+、Fe3+、Cu2+的氧化性强弱
顺序为
A、Fe2+>Cu2+>Fe3+ B、Fe3+>CU2+>Fe2+
C、Fe3+>Fe2+>Cu2+ D、Fe2+>Fe3+>Cu2+
11、在Fe(NO3)2溶液中滴加浓盐酸,下列叙述正确的是
A、溶液颜色逐渐变浅 B、浅绿色逐渐变深
C、溶液颜色由浅绿色变成黄色 D、溶液颜色不会发生变化
12、在100mL 0.5mol/L的AlCl3溶液中加入100 mLNaOH溶液,得到0.01mol Al(OH)3沉淀,则NaOH溶
液的物质的量浓度可能为
A、0.6 mol/L B、1.6 mol/L C、1.9 mol/L D、2.2 mol/L
13、只用一种试剂,就能把Na2S、Ba(NO3)2、NaHCO3、AlCl3、NaAlO2五种无色透明溶液区别开来,这
种试剂是
A、硫酸 B、盐酸 C、氨水 D、氢氧化钠溶液
14、在下列透明溶液中,因氧化还原反应而不能大量共存的离子组是
+A、Na+、K+、MnO4-、SO42― B、Cl-、Al3 、AlO2- 、Na+
++C、Na+、CH3COO-、H 、K+ D、K+、I-、Na+、Fe3
15、 下列现象与盐类水解无关的是
A、将Al粉投入到NaHSO4溶液中,有气泡生成
B、配制FeCl3溶液时适当加入少量盐酸
C、明矾可作净水剂
D、泡沫灭火器用Al2(SO4)3与NaHCO3为原料
16、将5克某金属加入100mL 4mol/L的硫酸溶液中,当硫酸浓度降到原浓度的一半时(设溶液的体积不
变),金属还没有全部溶解,该金属可能是
A、铝 B、锌 C、铁 D、钠
17、将氢氧化钡溶液滴入含1mol/L的KAl(SO4)2的明矾溶液中,当生成的沉淀的物质的量最多时,铝元素
的主要存在形式为
+ A、Al3和Al(OH)3 B、Al(OH)3
-- C、AlO2 D、AlO2和Al(OH)3
18、Fe3O4与HNO3反应生成Fe(NO3)3、NO、H2O若溶解1mol Fe3O4,则被还原的硝酸是
A、1/3 mol B、1/2 mol C、3 mol D、9 mol
19、在三氯化铁溶液中通入二氧化硫,然后再滴入氯化钡溶液,有白色沉淀生成,则该白色沉淀可能是
A、硫酸钡 B、亚硫酸铁 C、亚硫酸钡 D、硫磺
20、下列检验试剂选用正确的是
A、用氯水、KSCN溶液检验FeCl3中是否有FeCl2溶液
B、用酸性KMnO4溶液检验FeCl3中是否有FeCl2
C、用NaOH溶液检验MgCl2中是否有FeCl2
D、用硝酸检验某黄色固体是纯铜还是黄铜
+-+21、现有200mL MgCl2和AlCl3的混合溶液,其中c(Mg2)=0.2mol/L,c(Cl)=1.3mol/L,要使Mg2
++转化成Mg(OH)2,并使Mg2、Al3分离开来,4mol/L NaOH溶液的最少用量为
A、140mL B、120mL C、100mL D、80mL
22、自然界中存在一种尖晶石,化学式为MgAl2O4,它透明色美,可作为宝石。已知该尖晶石中混有Fe2O3。
取一定量样品5.4g,恰好与一定浓度100mL盐酸反应,盐酸浓度可能是
A 1.9 mol/L B 2.8 mol/L C 4.3 mol/L D 4.9 mol/L
二、填空题(共18分)
23、(本题9分)某同学对化学非常感兴趣,他对金属钠、铝、铁及其它们的化合物做了深入的研究,收
集了大量的资料。以下便是他的学习成果。
(1)钠、铝、铁都是金属元素,其中_______(填元素符号)是地壳中含量最高的金属元素。
(2)钠、铝、铁的金属性由强到弱的顺序为______ ___________。
以下从理论上可以验证铝和铁的活泼性强弱的实验是____ ____。
(a)将在空气中放置已久的这两种块状单质分别放入热水中
(b)将两种金属连接后放入稀硫酸中
(c)将一种金属投入到另一种金属的硝酸盐溶液中
(d)向含铝离子和亚铁离子的溶液中加入金属钠,看谁先析出
(3)以下不是纯净的钠、铝和铁的共同的性质___ ____
A.导电性 B.导热性 C.延展性 D.高密度 E.银白色(金属光泽)
(4)已知碱性强弱为:NaOH > Fe(OH)2 > Al(OH)3 > Fe(OH)3 ,则同温度、同浓度的NaCl、FeCl2、FeCl3、
AlCl3溶液的pH值由大到小顺序为_____________________________。
(5)实验室为了制备氢氧化铝,常向氯化铝溶液中滴加_ _____试剂,这样可以使铝离子完全沉淀,
写出离子方程式: 。
24、(本题9分)有W、X、Y、Z四种原子序数小于18的元素,它们的原子序数依次增大。W是周期表
中非金属最强的元素,X是同周期主族元素中原子半径最大的原子。Y的最高价氧化物对应水化物能
分别与X、Z的最高价氧化物对应水化物发生反应。Z2-的最外层电子数与次外层电子数均为8个。试
回答:
(1)写出元素符号:W___________ X___________
(2)画出X元素的离子结构示意图_______ ___;
(3)写出Z元素气态氢化物的电子式_________________;
(4)Y元素的最高价氧化物对应水化物电离方程式为___________ 。
(5)由X与Z组成的化合物的水溶液呈 性,原因是
(用离子方程式表示)。
三、实验题(共22分)
25、(本题6分)某溶液中只大量含有下列部分离子:K+、Fe3+、Ba2+、Al3+、Cl-、HCO3-、SO42-。现做以下
实验:
⑴将溶液滴在蓝色石蕊试纸上,试纸呈红色;
⑵取少量溶液,加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀;
⑶将⑵中的沉淀过滤。由滤液中加入硝酸银溶液,产生白色沉淀;
⑷另取溶液,逐滴加入氢氧化钠溶液至过量,观察到有红褐色沉淀生成,且沉淀量不减少。由此可以推断:
(1)溶液中肯定存在的离子有: 。
(2)溶液中肯定不存在的离子有: 。
(3)溶液中还不能确定是否存在的离子有: 。
26、(本题8分)某淡绿色晶体A可以发生下图所示的系列反应:
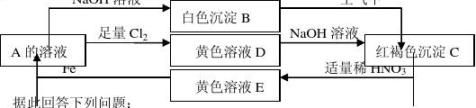
(1)写出各物质的化学式:A C
(2)写出E→A 的离子方程式
(3)写出B→C 的化学方程式
(4)黄色溶液D中大量存在的阴离子有
写出A→D 的化学方程式
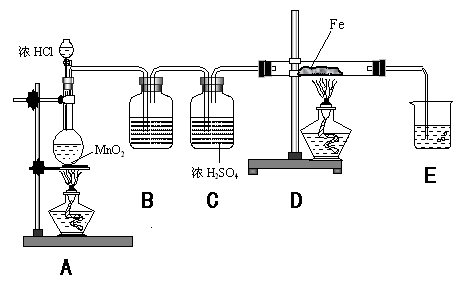
27、(本题8分)在实验室里按照下图
装置制取少量FeCl3,所通过的气
体过量且反应充分。试回答以下问
题:
(1)B装置中盛放的溶液
是 ;C装置的作用
是 ;
(2)写出D装置中反应的化学方程..
式:
;
(3)写出E装置中反应的离子方程..
式: ;
(4)用此方法可制得无水氯化铁。你认为能否改用Fe和盐酸反应,再通入过量氯气、蒸干溶液的方
法来制取无水氯化铁? (填“是”或“否”);说明理由:
四、计算题(共16分)
28、(本题6分)在200mL FeCl2溶液中通入一定量的Cl2后,把溶液分在两等份。一份加入足量的硝酸
银溶液,反应得到28.7g沉淀;另一份放入铁片,直到溶液中不再使KSCN溶液变红色为止,铁片质量减轻了0.56g,求:
(1)通入Cl2反应后的溶液中Cl-的物质的量;
(2)通入Cl2在标准状况下的体积;
(3)原FeCl2溶液的物质的量浓度。
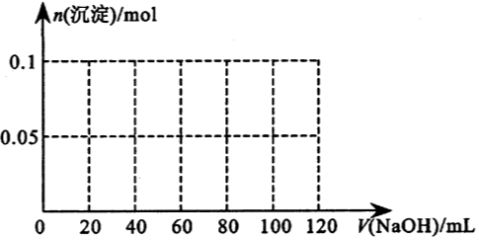
29、(本题10分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,
分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6g。 请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是 和 ,阴离子是 。
(2)试通过计算确定该结晶水合物的化学式。
(3)假设过程中向该溶液中加入的NaOH溶液的物质的量浓度为5mo1/L,请在图中画出生成沉淀的物
质的量与加入NaOH溶液体积的关系示意图。
答案
1.B 2.A 3.D 4.A 5.B 6.B 7.C 8.A 9.C 10.B 11.C 12.C
13.A 14.D 15.A 16.A 17.B 18.A 19.A 20.C 21.D 22.B
23、(1)Al (2)Na>Al>Fe b、c (3)D
(4)NaCl>FeCl2>AlCl3>FeCl3
(5)NH3.H2O 3 NH3.H2O + Al3+==Al(OH)3 + 3 NH4+
24、(1)F Na (2)+11 2、8
(3)H2S电子式
(4)H2O+H++AlO2-==Al(OH)3==Al3++3OH-

第二篇:高二化学期中普通班
项城二高2013—2014学年第一学期期中考试
高二化学试卷(普通班)
命题人:张攀峰 2013.11.01 (考试时间:90分钟 试卷满分:100分)
第Ⅰ卷 选择题
一、选择题(每题只有一个正确答案。共18道小题,每小题3分,共54分。) 1.下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H =2×(-57.3)kJ/mol
B.CO(g)的燃烧热△H=—283.0kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的△H= +2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D. S(g)+O2(g)===SO2(g) ΔH=a;S(s)+O2(g)===SO2(g) ΔH=b;则a>b 2.下列事实不能用勒夏特列原理解释的是
A. 溴水中有下列平衡Br2+H2

O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B. 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C. 反应CO(g)+NO2

(g) CO2(g)+NO(g) △H<0,达平衡后,升高温度体系颜色变深
D. 对于

2HI(g)
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
3.如图表示反应2SO2(g)+O2(g)
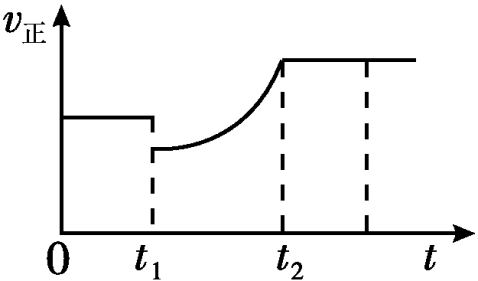
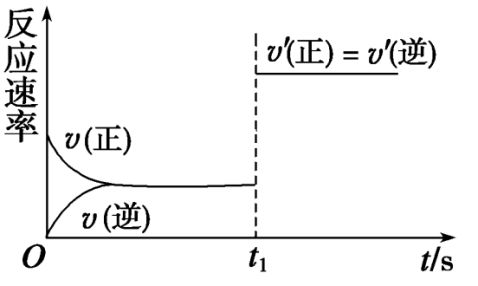
2SO3(g) ΔH<0的正反应速率随时间的变化情况,试根据
此曲线判断下列说法可能正确的是( ) A.t1时减小了SO2的浓度,增加了SO3的浓度
B.t1时降低了温度,平衡向正反应方向移动 C.t1时减小了压强,平衡向逆反应方向移动 D.t1时增加了SO2和O2的浓度,平衡向正反应方向移动 4.反应mA(s)+nB(g)
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化
的关系如图所示,下列叙述中一定正确的是
①m+n>p ②x点表示的正反应速率大于逆反应速率 ③n>p ④x点比y点时的反应速率慢 ⑤若升高温度,该反应的平衡常数增大
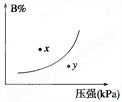
A.①②⑤ B.只有②④ C.只有①③ D.①③⑤ 5.以下一定能说明化学平衡发生移动的是( )
A.正、逆反应速率改变 B.加入催化剂 C.增大压强
D.化学平衡常数的改变
6.下列描述中,不符合生产实际的是( )
A.合成氨工业中,N2和H2的最佳配比应为物质的量之比1:3 B.手机上用的锂离子电池属于二次电池
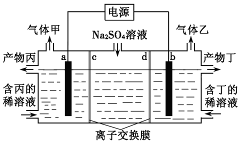
C.工业上电解饱和食盐水制烧碱,用离子交换膜阻止0H-移向阳极 D.甲醇燃料电池可把化学能转化为电能 7.下列有关电化学知识的描述中正确的是( )
A.原电池的正极和电解池的阳极均发生氧化反应 B.氢燃料电池的正极是通入氢气的那一极
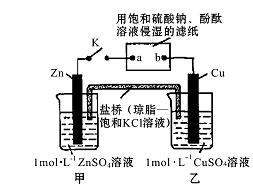
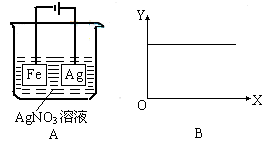
C.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)耐腐蚀 D.铅蓄电池充电时电源的正极接蓄电池标“-”的一极 8.将右图所示实验装置的K闭合,下列判断正确是( ) A.Cu电极上发生氧化反应
B. 电子沿Zn?a?b?Cu路径流动 C.片刻后甲池中c(SO42—)增大 D.片刻后可观察到滤纸a点变红色
9.下列各组中,每种电解质溶液电解时只生成氢气和氧气的是( )
A.HCl、 CuCl2、 Ba(OH)2 B. NaOH、CuSO4、 H2SO4 C.NaOH、H2SO4、 Ba(OH)2
D.NaBr、 H2SO4、 Ba(OH)2
10.下图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为Pt电极。接通电源后,发现d点显红色。下列有关说法正确的是 ( ) A.电源A上的a极是正极
B.d极上的电极反应方程式为2Cl--2e-
=Cl2↑ C.e、f极上产生的气体体积比为
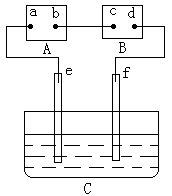
2:1
D.C中溶液的pH增大
11.按A图装置进行实验,若图B的X轴表示流入电极的电子的量,则Y轴不可能表示的情况是( )
A.c(Ag) B.c(NO3) C.溶液的c(H)
12.下图是298 K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是

+
+
-
D. Z单质的金属活动性较Y强
15.反应FeO(s)+C(s)=Fe(s)+CO(g); △H>0,ΔS>0,下列说法正确的是
A.低温下自发进行,高温下非自发进行 B.任何温度下均为非自发进行 C.高温下能自发进行,低温下非自发进行 D.任何温度下均为自发进行 16.已知反应:2SO2(g)+O2

(g)
SO3(g) ΔH<0。某温度下,将2 mol SO2
和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是 (
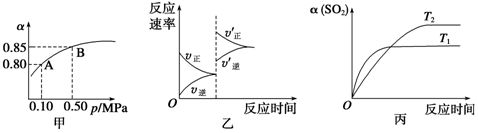
)
D.银棒质量
-
A.该反应的热化学方程式为:N2 + 3H22NH3 △H =-92 kJ·mol1 B.向一密闭容器中加入1 molN2和3 molH2充分反应后,放出92 kJ热量 C.b曲线可能是加入催化剂时的能量变化曲线
D.加入正催化剂可增大正反应速率,降低逆反应速率
13.在一定温度下,向密闭容器中充入1.0molN2和3.0molH2,反应达到平衡时测得NH3的物质的量
为0.6mol。若在该容器中开始时充入2. 0 molN2和6.0molH2,则平衡时NH3的物质的量为 ( )
A、若为定容容器,n(NH3)=1.2mol B、若为定压容器,n(NH3) >1.2mol C、若为定容容器,n(NH3)>1.2mol D、若为定压容器,n(NH3)<1.2mol
14. 下图为一电化学综合实验装置。其中装置D为用加有酚酞的淀粉碘化钾溶液润湿的长条滤纸,c、d为铂片。整套装置工作一 段时间后,发现铂片d的周围变为蓝色。下列有关说法错误的是( )
A.铂片c上发生的反应为2H++2e-══H2↑,c周围变为红色 B.装置C中,b电极周围的颜色变深
C. 装置A、B之间倒置的U形管,是沟通两装置的离子通道
A.由图甲知,A点SO2的平衡浓度为0.4 mol/L
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
17.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变
化规律(图中P表示压强,T表示温度,n表示物质的量):
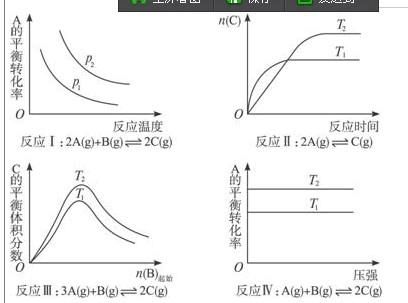
根据以上规律判断,下列结论正确的是( ) A.反应Ⅰ:△H>0,P2>P1

B.反应Ⅱ:△H>0,T1>T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1 D.反应Ⅳ:△H<0,T2>T1
18.电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如右图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是 A.a极与电源的负极相连 B.产物丙为硫酸溶液
C.离子交换膜d为阴离子交换膜 D.a电极反应式:2H++2e= H2↑
-
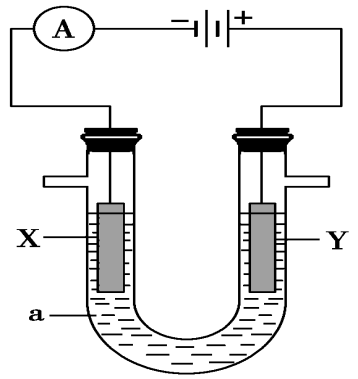
20.(13分)电解原理在化学工业中有广泛的应用。下图表示一个电解池,装有电解液a;X、
Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
第Ⅱ卷(非选择题共46分)
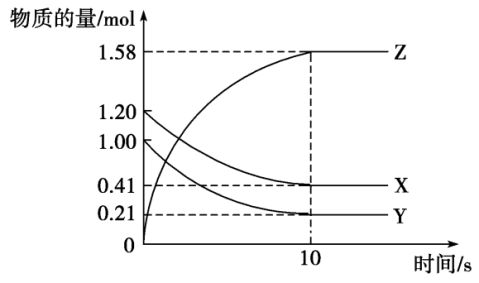
19.(15分)一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
酞试液,则:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚 ①电解池中X极上的电极反应式为____________________,在X极附近观察到的现象是__________________。
②Y电极上的电极反应式为_________________,检验该电极反应产物的方法是_______________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是________,电极反应式为____________。
(1)从反应开始到10 s,用Z表示的反应速率为_______________,X的物质的量浓度减少
了________,Y的转化率为____________________________。
(2)该反应的化学方程式为_________________________________________________。 (3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图象如图所示:
②Y电极的材料是________,电极反应式为_____________。 (说明:杂质发生的电极反应不必写出)
③溶液中的c(Cu2)与电解前相比________(填“变大”、“变小”或“不变”)。
+
(3)如利用该装置实现铁上镀锌,电极X上发生的反应为________________________,电
解池盛放的电镀液的浓度与电解前相比________(填“变大”、“变小”或“不变”)。 21.(8分)在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:
N2(g)+3H2(g)
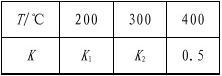
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
则下列说法符合该图象的是________。 A.t1时刻,增大了X的浓度 C.t1时刻,缩小了容器体积
B.t1时刻,升高了体系温度 D.t1时刻,使用了催化剂
请完成下列问题:
(1)试比较K1、K2的大小,K1
________K2(填“>”“=”或“<”)
(2)下列各项能作为判断该反应达到化学平衡状态的依据的是________(填字母编号)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v正(N2)=3v逆(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)400 ℃时,反应2NH3(g)
N2(g)+3H2(g)的化学平衡常数K的值为______,当测
得NH3和N2、H2的物质的量分别为3 mol和2 mol、1 mol时,该反应的v正(N2)______ v逆(N2)(填“>”“<”或“=”)
22.(10分)t ℃时,将3 mol A和1 mol B气体通入体积为2 L的密闭容器中(容积不变),发生反应:
3A(g)+B(g)
xC(g)。2 min时反应达到平衡状态(温度不变),剩余了0.8 mol B,
并测得C的浓度为0.4 mol·L-
1,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为________。 (2)x=________;平衡常数K=________。
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化
学平衡________(填写字母序号)。 A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(4)若向原平衡混合物的容器中再充入a mol C,在t ℃时达到新的平衡,此时B的
物质的量为n(B)=________mol。
项城二高2013—2014学年第一学期期中考试
高二化学普通班答案
一、选择题(每题只有一个正确答案。共18道小题,每小题3分,共54分)
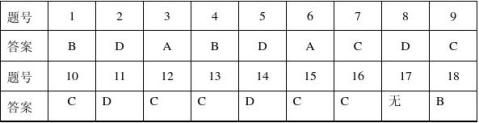
19题:(15分)(每空3分)
(1)0.079 mol/(L·s) 0.395 mol/L 79.0% (2)X(g)+Y(g)
2Z(g)
(3)CD 20题:(13分)
(1)①(2分)2H++2e-
===H2↑, 有气体放出,溶液变红。
②(3分)2Cl-
-2e-
===Cl2↑,把湿润的淀粉碘化钾试纸放在Y电极附近,试纸变蓝色,说明生成了Cl2 。
(2)①(2分)纯铜, Cu2+
+2e-
===Cu 。
②(2分)粗铜, Cu-2e-===Cu2+
。
③(1分)变小。
(3)(3分)Zn2++2e-
===Zn , 不变。
21题:(8分)(每空2分)
(1) > (2) c (3) 2 >
22题:(10分)(每空2分)
(1)0.2 mol·L-1·min-
1 (2)4 0.037 (3) C (4) (0.8+0.2a)
项城二高2013—2014学年第一学期期中考试
高二化学(普通班)答题卡
一、选择题(每题只有一个正确答案。共18道小题,每小题3分,共54分)
第Ⅱ卷(非选择题共46分)
19.(15分)
(1)____________ ___, _______ _, ____________________________。
(2)_________________________________________________。
(3)_____ ___。
20.(13分)
(1)①________________ ____,
。
②_______________ __,
____________。
(2)①______ __, _____ _______。
②_____ __, _____ ________。
③______ __
(3)____________________ ___, ________
21.(8分)
(1)_______ _ (2)_____ ___
(3)____ __, ____ __
22.(10分) (1)。
(2)x=____ ___;平衡常数K=_____ ___。
(3)________(填写字母序号)。
(4)___ __mol
