俗名:无机部分:
纯碱、苏打、天然碱 、口碱:Na2CO3
烧碱、火碱、苛性钠:NaOH
食盐:NaCl
小苏打:NaHCO3 (大苏打:Na2S2O3)
石灰石、大理石:CaCO3 (石膏(生石膏):CaSO4.2H2O 熟石膏:2CaSO4·.H2O) 生石灰:CaO 熟石灰、消石灰:Ca(OH)2
漂白粉:Ca (ClO)2 、CaCl2(混和物)
重晶石:BaSO4(无毒)
碳铵:NH4HCO3
芒硝:Na2SO4·7H2O (缓泻剂)
绿矾:FeSO4·7H2O 明矾:KAl (SO4)2·12H2O(用作净水,) 皓矾:ZnSO4·7H2O 胆矾、蓝矾:CuSO4·5H2O
干冰:CO2
泻盐:MgSO4·7H2O
双氧水:H2O2
硅石、石英:SiO2
刚玉:Al2O3
水玻璃、泡花碱、矿物胶:Na2SiO3
铁红、铁矿:Fe2O3
磁铁矿:Fe3O4 黄铁矿、硫铁矿:FeS2 菱铁矿:FeCO3
铜绿、孔雀石:Cu2 (OH)2CO3
赤铜矿:Cu2O
波尔多液(杀菌剂):Ca (OH)2和CuSO4
石硫合剂:Ca (OH)2和S
过磷酸钙(主要成分):Ca (H2PO4)2和CaSO4 重过磷酸钙(主要成分):Ca (H2PO4)2 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2
天然气、沼气、坑气(主要成分):CH4
水煤气:CO和H2
硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2 溶于水后呈淡绿色
光化学烟雾:NO2在光照下产生的一种有毒气体
王水:浓HNO3与浓HCl按体积比1:3混合而成。
铝热剂:Al + Fe2O3或其它氧化物。
尿素:CO(NH2) 2
有机部分:
氯仿:CHCl3
电石:CaC2
电石气:C2H2 (乙炔)
TNT:三硝(百度)基(百度)甲(百度)苯
酒精、乙醇:C2H5OH
氟氯烃:是良好的制冷剂,有毒,但破坏O3层。
醋酸:冰醋酸、食醋 CH3COOH
裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。
甘油、丙三醇 :C3H8O3
焦炉气成分(煤干馏):H2、CH4、乙烯、CO等。
石炭酸:苯酚
蚁醛:甲醛 HCHO
福尔马林:35%—40%的甲醛水溶液
蚁酸:甲酸 HCOOH
葡萄糖:C6H12O6 果糖:C6H12O6 蔗糖:C12H22O11 麦芽糖:C12H22O11 淀粉:(C6H10O5)n
硬脂酸:C17H35COOH 油酸:C17H33COOH 软脂酸:C15H31COOH
草酸:乙二酸 HOOC—COOH 使蓝墨水褪色,强酸性,受热分解成CO2和水,使KMnO4酸性溶液褪色。
二、 颜色
铁:铁粉是黑色的;一整块的固体铁是银白色的。 Fe2+——浅绿色 Fe3O4——黑色晶体 Fe(OH)2——白色沉淀 Fe3+——黄色 Fe (OH)3——红褐色沉淀 Fe (SCN)3——血红色溶液
FeO——黑色的粉末 Fe (NH4)2(SO4)2——淡蓝绿色 Fe2O3——红棕色粉末 FeS——黑色固体
铜:单质是紫红色 Cu2+——蓝色 CuO——黑色 Cu2O——红色 CuSO4(无水)—白色 CuSO4·5H2O——蓝色 Cu2 (OH)2CO3 —绿色 Cu(OH)2——蓝色 [Cu(NH3)4]SO4——深蓝色溶液
白色沉淀 :BaSO4 、BaCO3 、Ag2CO3 、CaCO3 、AgCl 、 Mg (OH)2 、三溴苯酚 Al(OH)3 白色絮状沉淀 H4SiO4(原硅酸)白色胶状沉淀
气体:Cl2、氯水——黄绿色 F2——淡黄绿色气体 Br2——深红棕色液体 I2——紫黑色固体 HF、HCl、HBr、HI均为无色气体,在空气中均形成白雾
O3—淡蓝色气体 SO2—无色,有剌激性气味、有毒的气体 N2O4、NO——无色气体 NO2——红棕色气体 NH3——无色、有剌激性气味气体
液体:CCl4——无色的液体,密度大于水,与水不互溶
品红溶液——红色 氢氟酸(HF水溶液,为混合物):HF——腐蚀玻璃
固体:KMnO4--——紫色 MnO4-——紫色 Na2O2—淡黄色固体 S—黄色固体 AgBr—浅黄色沉淀 AgI—黄色沉淀 SO3—无色固体(沸点44.8 0C)
专题:
一、无机
1)钠:物理性质:软(可以用小刀切开),银白色,热和电的良导体,密度比水小。 化学性质:非常活泼,极易氧化(储存与煤油)。
氧化钠和过氧化钠
碳酸钠和碳酸氢钠
碱金属元素
化学式: 1. 钠在空气中缓慢氧化:4Na+O2==2Na2O
2. 钠在空气中燃烧:2Na+O2点燃====Na2O2
3. 钠与水反应:2Na+2H2O=2NaOH+H2↑ (现象:浮融游响红。放有酚酞检验。)
4. 过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑
5. 过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O2
6. 碳酸氢钠受热分解:2NaHCO3△==Na2CO3+H2O+CO2↑
7. 氢氧化钠与碳酸氢钠反应:NaOH+NaHCO3=Na2CO3+H2O
8. 在碳酸钠溶液中通入二氧化碳:Na2CO3+CO2+H2O=2NaH
9. 钠可以跟卤素、硫、磷,氢等非金属直接发生反应:
2Na+Cl2=2NaCl
2Na+S=Na2S
2)镁 物理性质:银白色金属
化学性质: 1.燃烧:
能与卤族元素反应,例如: Mg+Cl2==点燃==MgCl2
在空气中点燃镁: 2Mg+O2==点燃==2MgO
在氮气中点燃镁条:3Mg+N2点燃===Mg3N2
在二氧化碳中点燃镁条:2Mg+CO2点燃===2MgO+C
(*注:该反应在氧气充足时一般不发生或发生后又有 C+O2=CO2(点燃),所以在反应后不见有黑色固体生成。)
2.与水:能与沸水反映:Mg+2H2O==Mg(OH)2+H2(气体)
3.与酸:能与稀酸反映:H2SO4+Mg==MgSO4+H2(气体)
4.海水中提取镁涉及反应:
① 贝壳煅烧制取熟石灰:CaCO3高温===CaO+CO2↑
CaO+H2O=Ca(OH)2
② 产生氢氧化镁沉淀:Mg2+2OH-=Mg(OH)2↓
③ 氢氧化镁转化为氯化镁:Mg(OH)2+2HCl=MgCl2+2H2O
④ 电解熔融氯化镁:MgCl2通电===Mg+Cl2↑
3)铝
物理性质:银白色金属,易溶于稀硫酸、硝酸、盐酸、氢氧化钠和氢氧化
钾溶液,不溶于水(溶于热水,反应很微弱),在潮湿空气中能形成
一层防止金属腐蚀的氧化膜。
1.与酸: 铝与盐酸的反应:2Al+6HCl=2AlCl3+3H2↑(放热反应)
氧化铝与酸反应:Al2O3+6HCl=2AlCl3+3H2O
氢氧化铝与强酸反应:Al(OH)3+3HCl=AlCl3+3H2O
2.与碱: 铝与强碱的反应:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
氧化铝与强碱反应:Al2O3+2NaOH+3H2O=2Na[Al(OH)4]
氢氧化铝与强碱反应:Al(OH)3+NaOH=Na[Al(OH)4]
(NaOH+Al(OH)3=NaAlO2+2H2O
* Na[Al(OH)4]是四羟基合铝(Ⅲ)酸钠,其实就是偏铝酸钠(NaAlO2)和两个H2O。 NaAlO2:呈强碱性的固体。
偏铝酸钠不在溶液中存在(实际是以Na[Al(OH)4]存在的。)
3. 铝在空气中氧化:4Al+3O2==2Al2O3 (形成致密的氧化膜)
*在高温下能与氧反应,放出大量热,用此种高反应热,铝可以从其它氧化物中置换金属(铝
热法)。8Al+3Fe?O?=4Al?O?+9Fe +795千卡。(需要使用镁做引燃物)
4. 实验室制取氢氧化铝沉淀:Al3++3NH3?H2O=Al(OH)3↓+3NH4+
5. 偏铝酸纳有关化学方程式:
2NaAlO?+ CO?(少量)+ 3 H?O ==== 2 Al(OH)?↓+ Na?CO?( 强酸制弱酸) NaAlO?+ CO?(过量)+ 2H?O ==== Al(OH)?↓+ NaHCO?
NaAlO? + HCl(少量)+ H?O ====Al(OH)?↓+ NaCl NaAlO?+ 4 HCl(过量)====AlCl?+ NaCl + 2 H?O NaAlO?+NaHCO3+ H?O====Al(OH)3↓+Na2CO3 3NaAlO?+AlCl3+6H2O====4Al(OH)3↓+3NaCl
4)铁
物理性质:银白色金属,有很强的铁磁性。在自然界,游离态的铁只能从陨石中
找到,分布在地壳中的铁都以化合物的状态存在。赤铁矿Fe2O3、 磁铁
矿Fe3O4。
1.Fe2+及Fe3+离子的检验:
① Fe2+的检验:(二价铁呈浅绿色,在碱性溶液中易被氧化成三价铁离子。) a) 加氢氧化钠溶液,产生白色沉淀,继而变灰绿色,最后变红褐色。
b) 加KSCN(硫氰化钾)溶液,不显红色,再滴加氯水,溶液显红色。 ② Fe3+的检验:(黄色溶液)
a) 加氢氧化钠溶液,产生红褐色沉淀。
b) 加KSCN溶液,溶液显红色。
2.与酸:1)铁溶于非氧化性的酸如盐酸和稀硫酸中,形成二价铁离子并放出氢气:
①Fe+H2SO4===FeSO4+H2↑ ②Fe+2HCl=FeCl2+H2↑
2在冷的稀硝酸中则形成二价铁离子和硝酸铵:
4Fe+10HNO3===4Fe(NO3)2+NH4NO3+3H2O
3.铁的还原与氧化性:
1)铁与硫酸铜反应(湿法炼铜):Fe+CuSO4=FeSO4+Cu *铁在干燥空气中很难与氧发生作用,但在潮湿空气中很易腐蚀,若含有酸性气或卤素蒸气时,腐蚀更快。铁可从溶液中还原金、铂、银、汞、铋、锡、镍或铜等离子。
2)氢氧化亚铁在空气中变质:4Fe(OH)2+O2+2H2O=4Fe(OH)3
在氯化铁溶液中加入铁粉:2FeCl3+Fe=3FeCl2
用氯化铁腐蚀铜电路板:2FeCl3+Cu=2FeCl2+CuCl2
少量锌与氯化铁反应:Zn+2FeCl3=2FeCl2+ZnCl2
足量锌与氯化铁反应:3Zn+2FeCl3=2Fe+3ZnCl2
4.冶炼:Fe2O3+3CO===(高温)2Fe+3CO2
5)铜
1.与氧气反应: 2Cu+O2=加热=2CuO(黑色)
在有水和二氧化碳条件下:2Cu+O2+H2O+CO2= Cu2(OH)2CO3
* Cu2(OH)2CO3:孔雀石(主要成分是Cu2(OH)2CO3,非纯净物),又称铜锈(铜绿)。在空气中加热会分解为氧化铜、水和二氧化碳。
2.与酸:2Cu+4HCl+O2=2CuCl2+2H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3.Cu+Cl2=点燃=CuCl2
Cu(OH)2=加热=CuO+H2O
4. CuSO4:俗名胆矾或蓝矾,其水呈蓝色
(b)硫酸铜的制备
Cu+2H2SO4(浓)= 加热=CuSO4+SO2↑+2H2O
2Cu+2H2SO4(稀)+O2=加热=2CuSO4+2H2O
6)氯
物理性质:卤族化学元素,氯常温常压下为黄绿色气体。
1.氯气的制法:
工业制法: 2NaCl + 2H2O =通电= 2NaOH + H2+ Cl2
实验室(利用氧化剂):
MnO2 + 4HCl = MnCl2 +Cl2 + 2H2O
* KClO3为无色片状结晶或白色颗粒粉末,强氧化剂。
2KMnO4 + 16HCl =加热= 2KCl +2MnCl2 + 5Cl2 + 8H2O
* KMnO4强氧化剂,黑色。
2. HClO:弱酸,但为很强的氧化剂,且具有漂白性,制造漂白粉Ca(ClO)2。 制备:①通氯气于冰水中:Cl2 + H2O = HClO + HCl
②通氯于碱液中可得次氯酸盐:Cl2+ 2NaOH → NaClO + NaCl + H2O
3.一些现象:Cu丝在Cl2中燃烧产生棕色的烟; H2在Cl2中燃烧是苍白色的火焰; Na在Cl2中燃烧产生大量的白烟; P在Cl2中燃烧产生大量的白色烟雾;
7)氮
1.氮气及其氧化物:氮气无色无味无嗅的气体。 在放电条件下,氮气才可以和氧气化合生成一氧化氮:N2+O2=放电=2NO 氧化氮与氧气迅速化合,生成二氧化氮2NO+O2=2NO2
二氧化氮溶于水,生成硝酸,一氧化氮:3NO2+H2O=2HNO3+NO
(雷雨发庄稼)
2. 氨.:无色有刺激性恶臭的气味,易溶于水。
N2与氢气反应制氨气(工业制法):N2+3H2=可逆=2NH3
实验室:2NH4Cl(固态) + Ca(OH)2(固态)===2NH3↑+ CaCl2 + 2H2O
(用碱石灰干燥,碱石灰是混合物,常用作干燥剂。) 与水反应:NH3+H2O=NH3·H2O (一水合氨)
*一水合氨能小部分电离成铵离子和氢氧根离子,氨水显弱碱性,能使酚酞溶液变红色。一水合氨不稳定受热分解生成氨和水 。
铵盐是强电解质。与碱反应放出氨气,大量的铵盐用作氮肥。 3硝酸:强氧化性、强腐蚀性。不稳定,易见光分解,应在棕色瓶中于阴暗处避光保存。
8)硫
物理性质:淡黄色。
1.氧化性和还原性: 1)与金属单质(氧化成较低价态):铁与硫蒸气反应:Fe+S△==FeS
铜与硫蒸气反应:2Cu+S△==Cu2S
2)还原性:S + O?==点燃== SO?
2.与酸:硫与浓硫酸反应:S+2H2SO4(浓)△==3SO2↑+2H2O
二氧化硫与硫化氢反应:SO2+2H2S=3S↓+2H2O
铜与浓硫酸反应:Cu+2H2SO4△==CuSO4+SO2↑+2H2O
6. 二氧化硫的催化氧化:2SO2+O2== 2SO3
7. 二氧化硫与氯水的反应:SO2+Cl2+2H2O=H2SO4+2HCl
8. 二氧化硫与氢氧化钠反应:SO2+2NaOH=Na2SO3+H2O
9. 硫化氢在充足的氧气中燃烧:2H2S+3O2点燃===2SO2+2H2O
硫化氢在不充足的氧气中燃烧:2H2S+O2点燃===2S+2H2O
9)硅:物理性质:极少以单质的形式在自然界出现,以复杂的硅酸盐或二氧化硅的形式存在。黑色,不溶于水、硝酸和盐酸,溶于氢氟酸和碱液。
1. 硅与氢氧化钠反应:Si+2NaOH+H2O=Na2SiO3+2H2↑
2. 硅与氢氟酸反应:Si+4HF=SiF4+H2↑
3. 二氧化硅与氢氧化钠反应:SiO2+2NaOH=Na2SiO3+H2O
4. 二氧化硅与氢氟酸反应:SiO2+4HF=SiF4↑+2H2O
5. 制造玻璃主要反应:SiO2+CaCO3高温===CaSiO3+CO2↑
SiO2+Na2CO3高温===Na2SiO3+CO2↑
6.硅的提取:SiO2 + 2C =高温= Si(粗硅) + 2CO ↑
Si(粗硅) + 2Cl2 =△= SiCl4
SiCl4 +2H2=△= Si + 4HCl
化学反应类型:
无机:四种基本类型:
化合反应,分解反应,置换反应和复分解反应。 另一种分类:氧化还原反应和非氧化还原反应。 中和反应:酸和碱生成盐和水。(属于复分解反应) 酸和金属反应生成盐和氢气。(金属活动顺序表) 酸和金属氧化物反应生成盐和氢气。
酸和盐反应生成新酸和新盐。
碱和非金属氧化物反应生成盐和水。
碱和盐反应生成新碱和新盐。
碱和非金属反应(主要是Si,P,S,Cl2) Si+2NaOH+H2O=Na2Sio3+2H2
Cl2+2NaOH==NaCl+NaClO+H2O
盐和盐反应生成新酸和新盐。
盐和金属反应生成新盐和新金属。
第二篇:高中化学有机知识点总结 修20xx
有机化学知识小结 2015/1/22
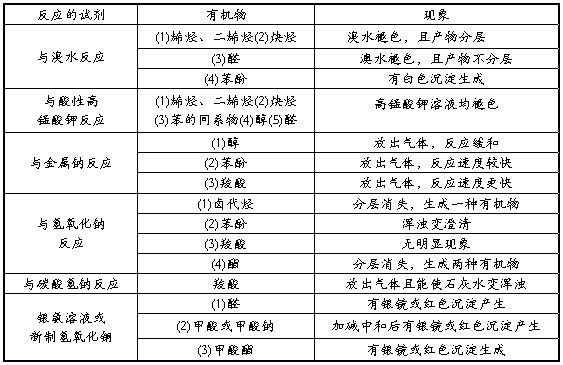
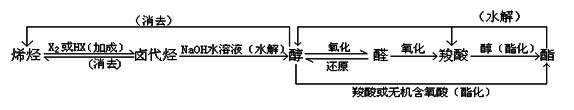
1、物理性质:
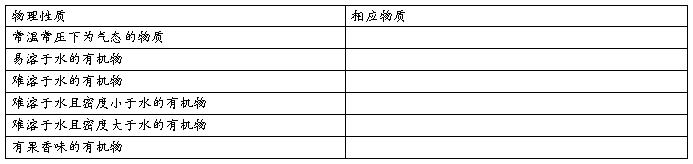
2、由反应条件确定官能团 :
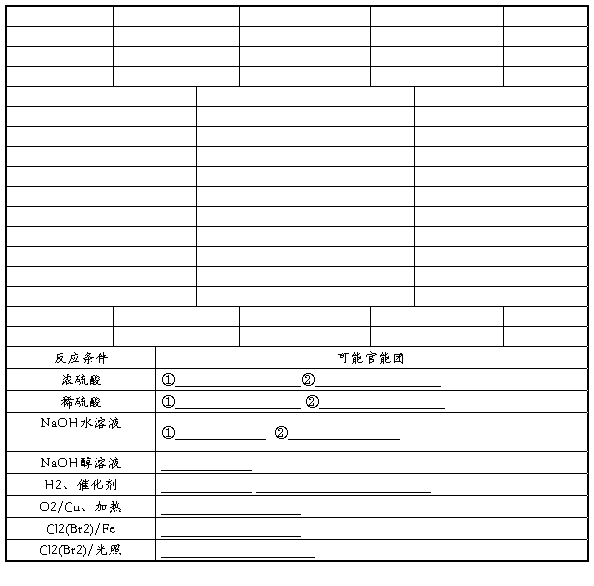
3、根据反应物性质确定官能团 :

4、根据反应类型来推断官能团:

5.反应类(从特征现象上突破)

有机化学知识小结 2015/1/22
1、物理性质:

2、由反应条件确定官能团 :
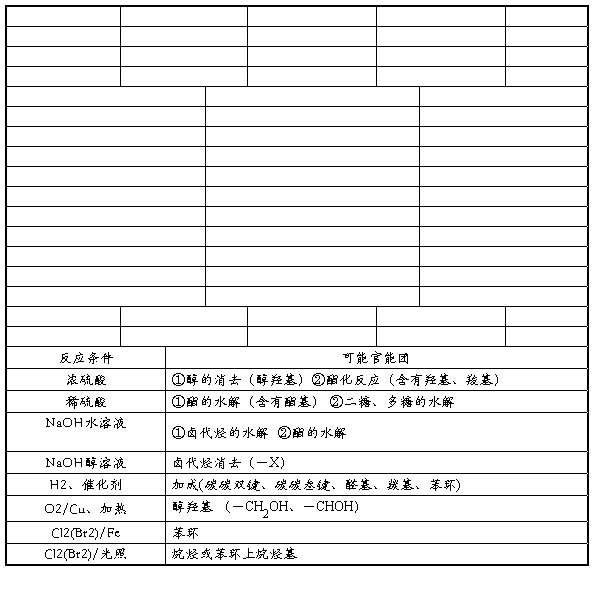
3、根据反应物性质确定官能团 :

4、根据反应类型来推断官能团:
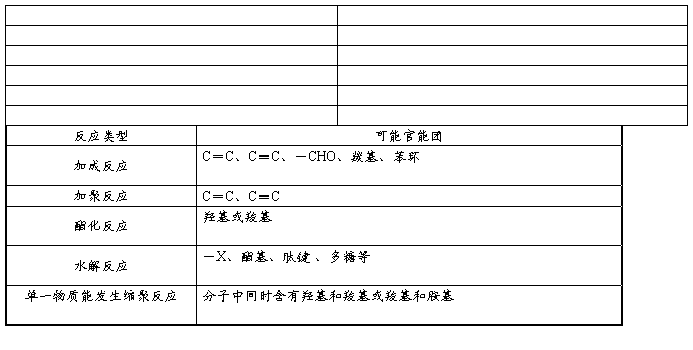
5.反应类(从特征现象上突破)
练习10
1、有机物 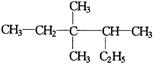 的正确命名为 ( )
的正确命名为 ( )
A、2-乙基-3,3-二甲基-4-乙基戊烷 B、3,3-二甲基-4-乙基戊烷
C、3,3,4-三甲基己烷 D、2,3,3-三甲基己烷
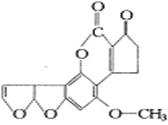 10、最近,媒体报道不法商贩销售“致癌大米”,已验证这种大米中含有黄曲霉毒素(AFTB),其分子结构式为如下图所示,人体的特殊基因在黄曲霉素的作用下会发生突变,有转变为肝癌的可能。一般条件下跟1mol AFTB起反应的
10、最近,媒体报道不法商贩销售“致癌大米”,已验证这种大米中含有黄曲霉毒素(AFTB),其分子结构式为如下图所示,人体的特殊基因在黄曲霉素的作用下会发生突变,有转变为肝癌的可能。一般条件下跟1mol AFTB起反应的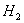 或NaOH的最大量分别是( )
或NaOH的最大量分别是( )
A、6mol;1mol B、5mol;1mol
C、6mol;2mol D、5mol;2mol
17.下列反应中,属于加成反应的是
A.CH4+Cl2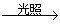 CH3Cl+HCl
CH3Cl+HCl
B.CH2=CH2+HCl CH3CH2Cl
CH3CH2Cl
 C.2CH
3CH
2OH+O
2
C.2CH
3CH
2OH+O
2
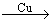 2CH
3CHO +2H
2O
2CH
3CHO +2H
2O
D.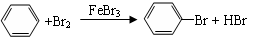
20.下列关于乙烯的说法中,正确的是
A.在空气中燃烧,能产生黑烟 B.分子中只含有极性共价键
C.分子中C、H元素的质量为1:1 D.通入氢气即可发生加成反应
13.一定量的CH4不完全燃烧生成由CO、CO2和H2O(气)组成的混合气体49.6克,将混合气体缓慢通过无水CaCl2(干燥剂)并作用完全,氯化钙质量增加25.2克,由此可推知,混合气体中含CO2的物质的量( )
A.0.4mol B.0.3mol C.0.2mol D.0.1mol
 3.分析 的结构,它在一定条件下不可能发生的反应有( )
3.分析 的结构,它在一定条件下不可能发生的反应有( )
①加成; ②水解; ③消去; ④酯化; ⑤银镜; ⑥中和; ⑦取代。

A、①⑤ B、②④ C、②⑤ D、③⑤
4、
5.下列关于乙酸的说法中不正确的是( )
A、乙酸是具有强烈刺激性气味的液体 B、乙酸分子里含有4个氢原子,所以乙酸不是一元酸
C、无水乙酸又称冰醋酸,它是纯净物 D、乙酸易溶于水和乙醇

 11.科学家研制的一种使沙漠变绿洲的新技术, CH2-CH n即在沙漠中喷洒一定
11.科学家研制的一种使沙漠变绿洲的新技术, CH2-CH n即在沙漠中喷洒一定
COOR
量的聚丙烯酸酯与水的混合物,使其与沙粒结合,形成既能阻止地下的盐分上升,又能拦截、蓄积雨水作用。下列对聚丙烯酸酯的叙述中正确的是(双选)
A.聚丙烯酸酯的单体的结构简为CH2=CHCOOR B.聚丙烯酸酯没有固定的熔沸点
C.聚丙烯酸酯能发生加成反应 D.合成聚丙烯酸酯的反应属于缩聚反应
13.乙烯和丙烯按1:1(物质的量)聚合时,生成聚合物乙丙树脂。该聚合物的结构简式可能是





 A. CH2-CH2-CH-CH2 n B. CH2-CH=CH-CH n
A. CH2-CH2-CH-CH2 n B. CH2-CH=CH-CH n
CH3 CH3



 C. CH2-CH2-CH=CH-CH2 n D. CH2-CH2-CH2-CH2-CH2 n
C. CH2-CH2-CH=CH-CH2 n D. CH2-CH2-CH2-CH2-CH2 n
2、下列各物质中,互为同系物的是
A.丁烷和2,2-二甲基丙烷 B.甲苯和1-苯基-1-丙烯
C.丙三醇和乙二醇 D.1,3-丁二烯和1-戊炔
3、下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是
A.CH3CH2CH2CH3 B.CH3CH(CH3)2
C.CH3C(CH3)3 D.(CH3)2CHCH2CH3
7、下列各化合物的命名中正确的是
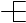
A.CH2=CH-CH=CH2 1,3—二丁烯 B.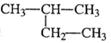 2—甲基丁烷
2—甲基丁烷
C. 甲基苯酚 D.
甲基苯酚 D. 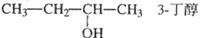

16.(10分)有机物A的结构简式为 它可通过不同化学反应
分别制得B、C、D和E四种物质。
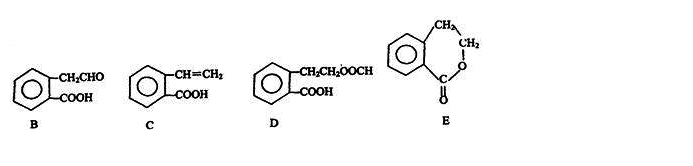
请回答下列问题:
(1)指出反应的类型:A→C: 。
(2)在A~E五种物质中,互为同分异构体的是 (填代号)。
(3)写出由A生成B的化学方程式
(4)C能形成高聚物,该高聚物的结构简式为 。
(5)写出D与足量NaOH溶液共热反应的化学方程式
。
