元素周期律
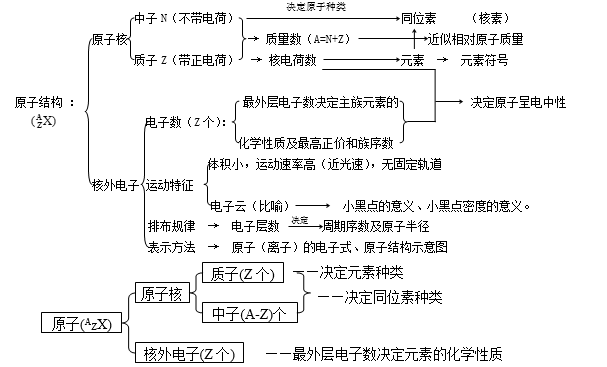
1.微粒间数目关系
质子数(Z)= 核电荷数 = 原子数序
质量数(A)= 质子数(Z)+ 中子数(N)
中性原子:质子数 = 核外电子数
阳 离 子:质子数 = 核外电子数 + 所带电荷数
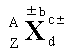 阴 离 子:质子数 = 核外电子数 - 所带电荷数
阴 离 子:质子数 = 核外电子数 - 所带电荷数
2.原子表达式及其含义
A 表示X原子的质量数;Z 表示元素X的质子数; d 表示微粒中X原子的个数;c± 表示微粒所带的电荷数;±b 表示微粒中X元素的化合价。
3.原子结构的特殊性(1~18号元素)
1.原子核中没有中子的原子:1 1H。
2.最外层电子数与次外层电子数的倍数关系。①最外层电子数与次外层电子数相等:4Be、18Ar; ②最外层电子数是次外层电子数2倍:6C;③最外层电子数是次外层电子数3倍:8O;④最外层电子数是次外层电子数4倍:10Ne;⑤最外层电子数是次外层电子数1/2倍:3Li、14Si。
3.电子层数与最外层电子数相等:1H、4Be、13Al。
4.1~20号元素组成的微粒的结构特点
(1).常见的等电子体
①2个电子的微粒。分子:He、H2;离子:Li+、H-、Be2+。
②10个电子的微粒。分子:Ne、HF、H2O、NH3、CH4;离子:Na+、 Mg2+、Al3+、
NH+ 4、H3O+、N3-、O2-、F-、OH-、NH- 2等。
③18个电子的微粒。分子:Ar、SiH4、PH3、H2S、HCl、F2、H2O2、N2H4(联氨)、C2H6(CH3CH3)、CH3NH2、CH3OH、CH3F、NH2OH(羟氨);离子:K+、Ca2+、Cl-、S2-、HS-、P3-、O2- 2等。
(2).等质子数的微粒
分子。14个质子:N2、CO、C2H2;16个质子:S、O2。
离子。9个质子:F-、OH-、NH- 2;11个质子:Na+、H3O+、NH+ 4;17个质子:HS-、Cl-。
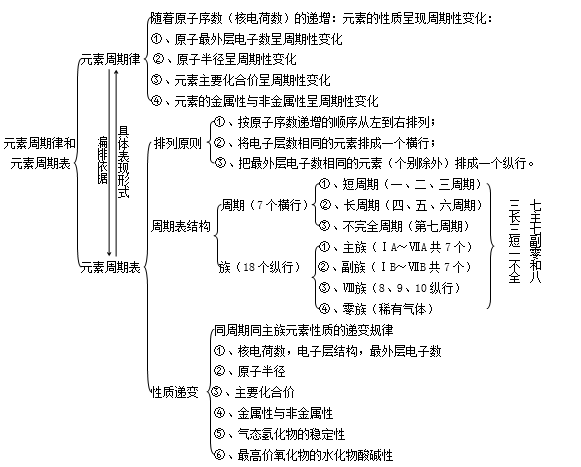
元素周期律及其实质
1.定义:元素的性质随着元素原子序数的递增而呈周期性变化的规律叫做元素周期律。
2.实质:是元素原子的核外电子排布的周期性变化的必然结果。
核外电子排布的周期性变化,决定了元素原子半径、最外层电子数出现周期性变化,进而影响元素的性质出现周期性变化
3.具体实例:以第3周期或第VIIA族为例,随着原子序数的递增

原子结构、元素的性质、元素在周期表中的位置间的相互关系
1.⑴分区线附近元素,既表现出一定的金属性,又表现出一定的非金属性。
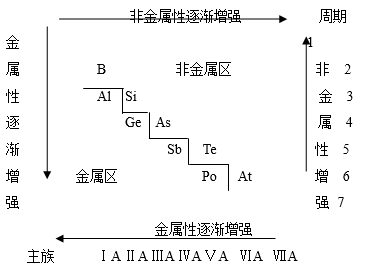
⑵对角线规则:在元素周期表中,某些主族元素与右下方的主族元素的性质有些相似,其相似性甚至超过了同主族元素,被称为“对角线规则”。
实例:① 锂与镁的相似性超过了它和钠的相似性,如:LiOH为中强碱而不是强碱,Li2CO3难溶于水等等。 ② Be、Al的单质、氧化物、氢氧化物均表现出明显的“两性”;Be 和Al单质在常温下均能被浓H2S04钝化;A1C13和BeCl2均为共价化合物等。 ③ 晶体硼与晶体硅一样,属于坚硬难熔的原子晶体。
2.原子结构与元素性质的关系
⑴与原子半径的关系:原子半径越大,元素原子失电子的能力越强,还原性越强,氧化性越弱;反之,原子半径越小,元素原子得电子的能力越强,氧化性越强,还原性越弱。
⑵与最外层电子数的关系:最外层电子数越多,元素原子得电子能力越强,氧化性越强;反之,最外层电子数越少,元素原子失电子能力越强,还原性越强。
⑶分析某种元素的性质,要把以上两种因素要综合起来考虑。即:元素原子半径越小,最外层电子数越多,则元素原子得电子能力越强,氧化性越强,因此,氧化性最强的元素是 氟F ;元素原子半径越大,最外层电子数越少,则元素原子失电子能力越强,还原性越强,因此,还原性最强的元素是铯Cs(排除放射性元素)。
⑷最外层电子数≥4,一般为非金属元素,易得电子,难失电子;
最外层电子数≤3,一般为金属元素,易失电子,难得电子;
最外层电子数=8(只有二个电子层时=2),一般不易得失电子,性质不活泼。如He、Ne、Ar等稀有气体。
3.原子结构与元素在周期表中位置的关系
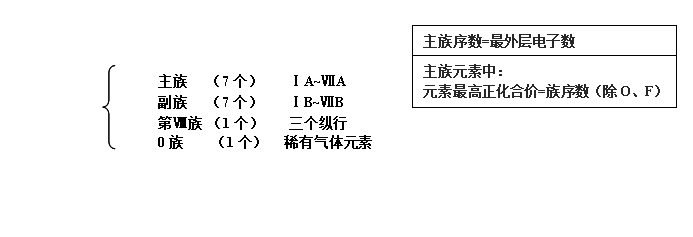
(1)电子层数等周期序数; (2)主族元素的族序数=最外层电子数;
(3)根据元素原子序数判断其在周期表中位置的方法
记住每个周期的元素种类数目(2、8、8、18、18、32、32);用元素的原子序数依次减去各周期的元素数目,得到元素所在的周期序数,最后的差值(注意:如果越过了镧系或锕系,还要再减去14)就是该元素在周期表中的纵行序数(从左向右数)。记住每个纵行的族序数知道该元素所在的族及族序数。
4.元素周期表的用途
①比较同主族元素的金属性、非金属性、最高价氧化物水化物的酸碱性、氢化物的稳定性等。②比较同周期元素及其化合物的性质。③比较不同周期、不同主族元素性质时,要找出参照物。④推断一些未学过的元素的某些性质。如根据ⅡA族的Ca(OH)2微溶,Mg(OH)2难溶,可推知Be(OH)2更难溶。⑵启发人们在一定范围内寻找某些物质
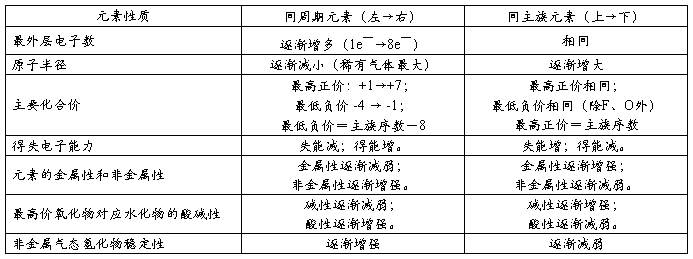
第二篇:元素周期律知识点 小总结
元素周期律&元素周期表(俄 门捷列夫)
★ 元素周期律:元素的性质随着原子序数的递增而呈周期性的变化。
★ 元素周期律的本质:随着原子序数的递增,元素原子最外层电子排布呈周期性的变化。
一、


 元素周期表的结构
元素周期表的结构


周期
 族
族
二、
 元素性质的递变规律
元素性质的递变规律




