药学类专业实验教材
药物化学实验与指导
(试用版)
主编 敖桂珍副教授
苏州大学药学院药化教研室
目 录
第一部分 实验室基本知识………………………….………………..3
一、 目的和要求
二、 实验室的安全
三、 常用仪器
四、 仪器的洗涤和干燥
五、 废品的销毁
六、 实验产率的计算
七、 实验预习、实验记录和报告
第二部分 基本实验操作技能……………………….………………..6
一、 熔点测定
二、 抽滤
三、 重结晶
四、 液体化合物的提纯方法
五、 固体化合物的提纯方法
六、 其它分离纯化的方法
第三部分 药物合成实验
实验一 阿司匹林的合成……………………………………………..8
实验二 磺胺醋酰钠的合成…………………………………………. 11
实验三 苯巴比妥的合成…………………………………………….15
实验四 维生素K3的合成………………………………………….. 17
实验五 苯佐卡因的合成…………………………………………….18
第一部分 实验室基本知识
一、 目的要求
药物化学是一门实践性很强的学科,其实验的目的是通过制备某些药物的过程来熟悉一些有机化学反应的原理和药物的理化性质,并掌握一些基本操作技术和化学反应后处理以及产品纯化的方法。通过实验,培养正确的观察能力和科学的思维方法,以及实事求是的记录习惯。因此学生在做实验前必须预习好实验内容,在实验过程中应仔细观察现象、如实记录结果,在实验结束后应及时写好实验报告。
二、 实验室的安全
在进行化学实验由于操作的疏忽,可能会引起着火、爆炸、中毒、腐蚀等不幸事故,这是是可以预防的。因此要求实验者随时提高警惕、仔细操作、维护实验室的安全,以求实验正常地进行。
实验注意事项如下:
1. 实验前必须作好预习,了解实验的目的和要求,弄懂每一操作步骤,方能开始进行实验操作。
2. 实验开始时应该检查仪器是否完整无损,装置是否正确。
3. 实验进行时不得擅自离开,并应经常注意仪器有无漏气及破碎,反应是否正常进行等情况。
4. 认为可能会发生危险的实验,在操作时应该用眼罩、面罩和防护板等安全措施,有刺激及毒性气体的实验操作必须在通风柜中进行。
5. 在实验时要做到安静、整齐、清洁;保持水槽、仪器、桌面、地上的整洁。
6. 离开实验室时应将水、电、煤气和真空阀关妥。
三、 常用仪器
1. 玻璃仪器
三颈烧瓶、二颈烧瓶、圆底烧瓶、茄形烧瓶、干燥管、分水器、温度计套管、直型冷凝管、球形冷凝管、恒压滴液漏斗、分液漏斗、普通漏斗、布氏漏斗、抽滤瓶、蒸馏头、真空接受管、弯接管、二通接头、转换接头、空心塞、B型管、试管、滴管、量筒、移液管等。
2. 其它常用仪器
气流烘干器、循环水真空泵、旋转蒸发仪、天平、熔点仪、烘箱。
四、 仪器的洗涤和干燥
玻璃仪器的清洁是做好实验的重要保证之一。用完的仪器应该马上清洗,否则拖延时间越长,洗涤越困难,影响下一次实验或下一批同学实验。
一般性玻璃仪器清洗,先用自来水冲洗,然后用毛刷浸湿,蘸取去污粉或洗衣粉进行洗刷,除去壁上污物。对于一些难以去除污物,可根据其性质采用不同的方法去除。若是酸性或碱性残渣,可用碱液或酸液来处理;若是残渣可溶于某种有机溶剂(如丙酮等),则用这种有机溶剂将残渣溶解;对于玻壁上不易清洗的污物,则将仪器在洗液缸或碱缸浸泡。最后,将洗净的仪器用自来水冲洗淋干。洗净仪器的器壁应清洁透明,不留污物,不现油渍,不挂水珠。玻璃仪器干燥可自然晾干,或用电吹风、气流烘干器、烘箱等烘干。临时急需干燥的仪器,可用少量丙酮或乙醇荡洗,然后吹干。荡洗后的溶剂必须回收。
五、 废品的销毁
碎玻璃等废物不要丢入废纸篓中;不要把任何用剩的试剂倒回试剂瓶中,以免对试剂造成污染,影响其他人的实验结果,或者由于操作疏忽导致引入异物,有时会发生剧烈化学反应甚至引起爆炸;不要把易燃及挥发性溶剂、不溶于水试剂和有毒的化学品倾入废物箱或水槽内,应将它们分类集中后处理;对倒掉后能与水混溶,或能被水解或腐蚀性液体,必须用大量的水冲洗;不可把金属钠渣投入水槽内,须用乙醇销毁。
六、 实验产率的计算
在药物的合成实验中,产物的实际产率是以百分率来计算的。
实际产量(克)
产率(%)=———————— ╳ 100%
理论产量(克)
理论产量是指根据反应方程式将原料全部转化为产物时计算的量,通常以最少的原料的投料摩尔数作为产物的摩尔数,将其乘以产物的分子量即得产物的理论产量。
实际产量是指实验中实际得到的产物的量。由于在实验过程中反应不完全、副产物的生成和分离纯化时的损失,实际产量通常低于理论产量。因此,常用产率来衡量反应进行的情况和实验的操作水平。
例如在实验一,原料投料量如下,最后得到4.0g阿司匹林的精品。
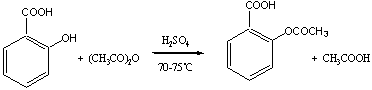
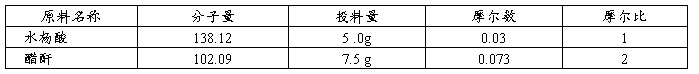
从投料量中可看出,醋酐过量。因此,理论产量应按水杨酸的投料量来计算。
理论产量=0.03×180.6=5.418g
实际产量=4.0g
产率=4.0÷5.418×100%=73.8%
七、 实验预习、实验记录和实验报告
(一)实验预习
在实验前,对所做的实验应该作好预习工作。预习工作包括反应的原理,可能发生的副反应、反应机制、实验操作的原理和方法,产物提纯的原理和方法,注意事项及实验中可能出现的危险及处置方法,应给出详细的报告。同时还要了解反应中化学试剂的化学计量学用量,对化学试剂和溶剂的理化常数等要记录在案,以便查询。
(二)实验记录
进行实验时要做到操作认真、观察仔细、积极思考,并把所有观察到的现象、实验时间、原始数据、操作和后处理方法、步骤均应及时、准确、详细地记录在实验记录本上,实验记录应记录在专门的实验记录本上,实验记录本应有连续页码,以保证实验记录的完整性、连续性和原始性。将实验情况记录在便条纸、餐巾纸、纸巾等容易失落或损失的地方的任何做法都是错误的。另外,记录要做到简要明确,字迹整洁。
(三)实验报告
常见实验记录格式:
实验人: 实验日期: 天气: 温度:
1. 实验目的和要求
2. 反应原理
写出药物合成的化学反应式和可能发生的副反应。
3. 化学试剂规格及用量
写出主要试剂和溶剂的用量(g或mL,摩尔)和物理常数。
4. 实验操作
写出简单明了的实验步骤(不要照抄实验内容!),步骤中的文字可用符号简化,例如:试剂写分子式、加热=Δ、加入=+、沉淀=↓、气体=↑……。每步操作之间用→表示。注意在实验报告附上实验装置图。
5. 实验结果
在实验结果中标明最终产品的质量、晶型、颜色,熔点和熔距,并计算每一步反应的产率和产品的总产率。有鉴别实验的还须标明结果呈阳性还是阴性。
6. 讨论
根据实验情况,对观察到的现象及结果进行讨论,或对本实验提出改进意见,以期获得产率、纯度更高、晶型更好的产品。也可由教师指定回答部分思考题。
第二部分 基本实验操作技能
一、 熔点测定
通常熔点的测定,系取晶体开始液化(初熔)至完全液化时(全熔)温度。熔点范围(熔距)即固体初熔至全熔的间隔温度。纯粹的晶体都有一极短的熔距,通常0.5~1.0℃。如有少量杂质存在,能使晶体的熔距显著增长,并使熔点降低。熔点测定,常受主观因素的影响,造成误差。由于实验者操作不够熟练及实验过程中疏忽而引起的。例如温度计读数不正确,样品结晶没有研细,样品装入毛细管不够紧密与均匀,加热使局部受热不均匀。熔点测定一般在b型管中。温度计水银球应置于支管中央部分,毛细管中的样品部分应置于温度计水银球侧面中部。加热时先以比较快的速度将温度上升到距离熔点10~15℃时,在调整火焰使每分钟上升约1~2℃,直至所要测定的熔点。测定熔点时,如加热太快(尤其在将近熔点时),熔点常比缓慢加热高,熔点范围也较大。
二、 抽滤
将布氏漏斗安装在抽滤瓶上,在漏斗下端口向着抽滤瓶的抽气口。在布氏漏斗上垫上稍小于漏斗内径的滤纸。先将滤纸湿润,打开减压泵,抽紧滤纸,然后将待滤的溶液慢慢倾于漏斗中,抽滤,滤饼分3次用溶剂洗涤。注意!洗涤时先停止减压,用刮刀轻轻将滤饼拨松,而后用少量溶剂浸湿结晶,抽滤,再用玻塞挤压滤饼,抽干,得粗品。
三、 重结晶
在药物合成中分离出的最终产物或中间体往往都是不纯的,常常混杂了少量的杂质。这些杂质通常是未作用完的原料、反应副产物或催化剂等。为了获得纯粹的产品,通常采用重结晶方法提纯。
重结晶一般过程如下:
1. 将粗品溶解在估计量的3/4的溶剂,加入几粒沸石,加热至沸腾回流,制成饱和溶液。若有有色杂质,可加入被精制物1%~2%的活性碳脱色。活性碳不要在溶液很热时加入,以免溶液发生暴沸。
2. 混合物加热回流5~10分钟后,将热溶液趁热过滤,除去机械杂质和不溶性组份以及活性碳。
3. 将滤液静置,自然冷却,被纯化物质慢慢地从母液中析出。如溶液不易形成结晶,可用玻棒磨擦瓶壁,或放入几粒纯结晶作为晶种,以加速结晶。
4. 用布氏漏斗抽滤,将结晶从母液中分离出来。
5. 用少量纯净冷溶液洗涤并干燥。
如发现晶体纯度不符合要求(如熔点)时,可重复重结晶操作,直到达到纯度要求为止。
如果单用一种溶剂重结晶效果不好,可采用混合溶剂,这种重结晶方法称为混合重结晶法。混合溶剂应该是互溶的,待纯化的结晶应易溶于其中一种溶剂而不溶或难溶于另一种溶剂。一般操作方法是将物质先溶于易溶的那种溶剂中制成热的溶液,然后滴加难溶该物质的溶剂,直至微呈混浊或开始析出结晶,在加入几滴第一种溶剂使溶液变澄清,然后放置冷却,按常法处理。
四、 液体化合物的提纯方法
有机合成产生的液体化合物的分离纯化一般采用蒸馏方法。简单蒸馏主要是用来分开液体和非挥发性物,以及用来粗分液体的混合物。在常压下,简单蒸馏主要用于沸点在40~150℃之间的液体,这是因为许多物质在150℃以上已经显著分解。由于某些化合物在正常沸点以下的温度蒸馏时有可能分解,氧化或分子重排;有时在较高的温度下所含的杂质也可能促进这些反应。在这种情况下可考虑减压蒸馏。当待分离的组份间的沸点差小于80℃时,就要用精馏的方法进行分离。如物质的沸点相差不多,分离这种混合物时,最好使用高效分馏柱来分离这种混合液。对沸点相近,加热易分解的高沸点混合物,或常压下被分离混合物的蒸汽压相差不大,而减压时相差较大的物质,则常采用减压分馏。水蒸气蒸馏法常常应用于与水不相溶的挥发性有机化合物的分离纯化。这一方法是将水与有机混合物一起蒸馏,由于互不溶物质的混合物的沸点要比沸点最低组份的沸腾温度还要低,所以在相对温和条件下(<100℃),与水不混溶的挥发性液体或固体被蒸出分离,蒸馏瓶中只剩下的不挥发性物。利用共沸蒸馏的方法,在加热反应中加入能与水形成共沸物的溶剂,如苯等,装上分水器,苯能将反应中的水带出。
五、 固体化合物的提纯方法
固体化合物的的分离纯化主要有重结晶、过滤和酸碱处理法等。酸碱处理法是利用产物、副产物、原料等酸碱性的不同,通过调节不同的pH值使它们分别溶于水与其它有机溶剂中,从而使产物与杂质分离。这是在药物合成中常用的分离手段,方便、易行。但产物的纯度不是太高,但与重结晶结合使用,能获得满意的结果。
六、 其它的分离纯化方法
薄层层析和柱层析也是常用的分离纯化方法。其它的常用分离纯化方法有萃取操作,主要进行下列分离:
1. 用有机溶剂从水溶液中萃取有机反应产物。
2. 通过水萃取从反应混合物中除去酸碱催化剂或无机盐。
3. 用稀碱或稀无机酸溶液萃取有机溶剂中的酸或碱,使之与别的有机化合物分离。
第三部分 药物合成实验
实验一 阿司匹林(乙酰水杨酸)的合成(方法一)
一、目的要求
1.熟悉阿司匹林的性状、特点和化学性质。
2.掌握酯化反应的原理和实验操作
3.巩固重结晶、精制、抽滤等基本操作技术。
4.了解阿司匹林中杂质的来源和鉴定。
二、反应原理
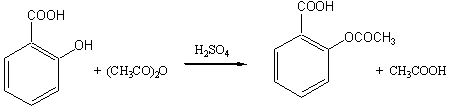
三、实验方法
1.原料规格及配比
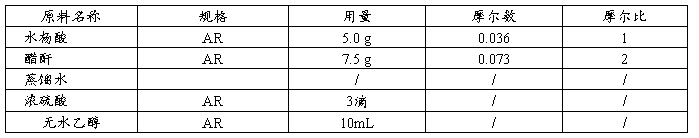
2.操作步骤
(1)乙酰水杨酸的制备
称取水杨酸5.0g,置于100mL圆底瓶中,加入醋酐7.5g,滴加浓硫酸3滴,装上回流冷凝管,在50~60℃水浴锅上搅拌10min。若已析出结晶,仍于50~60℃水浴内反应,保证反应10min。然后室温冷却,待结晶析出后,再加蒸馏水25mL,用玻璃棒轻轻搅拌,继续冷却直至乙酰水杨酸完全析出。抽滤,滤饼用蒸馏水15mL分3次快速洗涤。洗涤时先停止减压,用刮刀轻轻将滤饼拨松,而后用5mL水浸湿结晶,抽滤,玻塞挤压滤饼,抽干,得粗品。
(2)精制
将乙酰水杨酸粗品移至50mL锥形瓶中,加入大约无水乙醇5mL,于水浴中加热溶解,另取20mL蒸馏水于100mL锥形瓶中预热至60℃。将热蒸馏水滴加至乙醇溶液中,直至溶液出现混浊,再加一滴乙醇加热至澄清。静置,室温冷却,慢慢析出针状结晶,抽滤,用少量的1:1醇水溶液洗涤,抽干,50℃干燥1h,得精品5.5g,mp.135~138℃。
3.附注
(1)乙酰化反应所用的仪器、量具必须干燥,同时注意不要让水蒸气进入锥形瓶。
(2)乙酰化反应温度不宜过高,否则将增加副产物(乙酰水杨酸酯、乙酰水杨酸水杨酸酯)的生成。
(3)倘若在冷却过程中阿司匹林没有从反应液中析出,可用玻璃棒轻轻摩擦锥形瓶的内壁,也可同时将锥形瓶放入冰浴中冷却,促使结晶生成。
(4)加水时要注意,一定要等结晶充分形成后才能加入。加水时要慢慢加入,并有放热现象,甚至会使溶液沸腾,产生醋酸蒸气,必须小心。
(5)阿司匹林受热易分解,可生成复杂物质使熔点下降。因此,需将传温液预热至130℃后立即放入样品,迅速测定熔点。
四、思考题
1. 在阿司匹林的合成过程中,需要加入少量的浓硫酸,其作用是什么?除硫酸外,是否可以用其它酸代替?
2. 本实验产生的主要杂质是聚合物,生成的原理是什么?
3. 药典中规定,成品阿司匹林中要检测水杨酸的量,为什么?本实验中采用什么方法除去?
4. 重结晶为什么选用乙醇-水为溶剂?在精制过程中为什么滤液要自然冷却?快速冷却会出现什么现象?
实验一 阿司匹林(乙酰水杨酸)的合成(方法二)
一、 目的要求
1.通过本实验,掌握阿司匹林的性状、特点和化学性质。
2.熟悉和掌握酯化反应的原理和实验操作。
3.进一步巩固和熟悉重结晶的原理和实验方法。
4.了解阿司匹林中杂质的来源和鉴别。
二、 反应原理
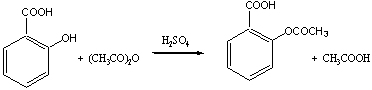
在反应过程中,阿司匹林会自身缩合,形成一种聚合物。利用阿司匹林和碱反应生成水溶性钠盐的性质,从而与聚合物分离。
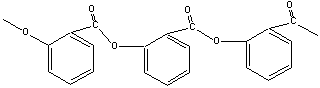
在阿司匹林产品中的另一个主要的副产物是水杨酸,其来源可能是酰化反应不完全的原料,也可能是阿司匹林的水解产物。水杨酸可以在最后的重结晶中加以分离。
三、 实验方法
1.原料规格及配比

2.操作
在100mL的圆底瓶中,加入水杨酸10.0g、醋酐25.0mL,然后用滴管加入浓硫酸,装上回流冷凝管,搅拌,加热至85~95℃,维持温度10min。然后将烧瓶取出,使其慢慢冷却至室温。在冷却过程中,阿司匹林渐渐从溶液中析出(附注2)。在冷到室温,结晶形成后,加入水50mL(附注3);并将该溶液放入冰浴中冷却。待充分冷却后,大量固体析出,抽滤得到固体。用少量冰水洗涤,并尽量压紧抽干,得到阿司匹林粗品。
将阿司匹林粗品放在150mL烧杯中,加入饱和的碳酸氢钠水溶液100mL(附注4)。搅拌到没有二氧化碳放出为止(无气泡放出,嘶嘶声停止)。当有不溶的固体存在时,真空抽滤,除去不溶物并用少量水洗涤。将得到的滤液倒入150mL烧杯中,放入冰浴中,一边搅拌一边滴加浓盐酸,阿司匹林逐渐从溶液中析出(附注5)。待阿司匹林不再析出,抽滤,滤渣用冷水洗涤,抽紧压干固体,得阿司匹林粗品。
将所得的阿司匹林放入25mL锥形瓶中,加入少量的热的乙酸乙酯(大约5mL),在水浴上(70℃)缓缓地不断地加热直至固体溶解,冷却至室温(附注6),阿司匹林渐渐析出,抽滤,得到阿司匹林精品(附注7),mp:135~138℃。
3.附注
(1)加热的热源可以是蒸汽浴、电加热套、电热板,也可以是烧杯加水的水浴。若加热的介质为水时,要注意不要让水蒸气进入烧瓶中,以防止酸酐和生成的阿司匹林水解。
(2)倘若在冷却过程中阿司匹林没有从反应液中析出,可用玻璃棒或不锈钢刮勺,轻轻摩擦锥形瓶的内壁,也可同时将烧瓶放入冰浴中冷却促使结晶生成。
(3)加水时要注意,一定要等结晶充分形成后才能加入。加水时要慢慢加入,并有放热现象,甚至会使溶液沸腾。产生醋酸蒸汽,须小心,最好在通风橱中进行。
(4)当碳酸氢钠水溶液加到阿司匹林中时,会产生大量气泡,注意分批少量地加入,一边加一边搅拌,以防止气泡产生过多引起溶液外溢。
(5)如果将滤液加入盐酸后,仍没有固体析出,测一下溶液的pH是否呈酸性。如果不是,再补加盐酸至溶液pH2左右,会有固体析出。
(6)此时应有阿司匹林从乙酸乙酯中析出。若没有固体析出,可加热将乙酸乙酯挥发一些,再冷却,重复操作。
(7)阿司匹林纯度可用下列方法检查 取两只干净试管,分别放入少量的水杨酸和阿司匹林精品。加入乙醇各1mL,使固体溶解。然后分别在每只试管中加入几滴10%FeCl3溶液,盛水杨酸的试管中有红色或紫色出现,盛阿司匹林精品的试管中应是淡黄色的。
四、 思考题
1. 在阿司匹林的合成过程中,要加入少量的浓硫酸,其作用是什么?除硫酸外,是否可以用其他酸代替?
2. 产生聚合物是合成中的主要副产物,生成的原理是什么?除聚合物外是否还会有其他可能的副产物?
3. 药典中规定,成品阿司匹林中要检测水杨酸的量,为什么?本实验中采用什么方法来测定水杨酸?试简述其基本原理。
实验二 磺胺醋酰钠的合成
一、目的要求
1.了解pH、温度等条件在药物合成中的重要性。
2.掌握磺胺类药物的一般理化性质,并掌握如何利用其理化性质的特点来达到分离纯化产品的方法。
3.掌握胺类化合物乙酰化反应的原理。
4.巩固抽滤、重结晶的操作。
二、实验原理
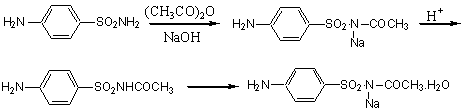
三、实验方法
(一)磺胺醋酰(SA)的制备
1.原料规格及配比
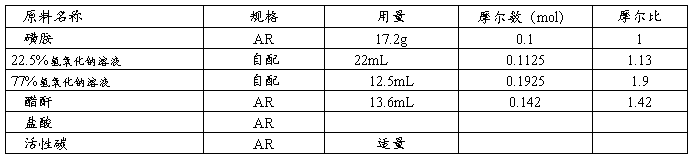
2.操作步骤
在装有搅拌、温度计和回流冷凝管的60mL的三颈瓶中投入磺胺17.2g及22.5%氢氧化钠溶液22mL,开动搅拌,于水浴上加热至50℃左右,待物料溶解后,滴加醋酐3.6mL,5min后滴加77%的氢氧化钠液2.5mL(附注1),并保持反应液pH在12~13之间,随后每隔5min交替滴加醋酐及氢氧化钠溶液,每次2mL(附注2),加料期间反应温度维持在50~55℃及pH在12~13(附注3)。加料毕,继续保温搅拌反应30min。然后将反应液转入100mL烧杯中,加水20mL稀释。用浓盐酸调pH至7,于冰浴中放置1~2h,冷却,析出固体。抽滤,滤渣用适量冰水洗涤(附注4)。洗液与滤液合并后用浓盐酸调pH至4~5,抽滤,滤渣压干(附注5),称重。所得固体用3倍量(体积)的10%盐酸溶解,放置30min,抽滤,除去不溶物。滤液加少量活性碳室温脱色,过滤除去活性炭。滤液用40%氢氧化钠液调pH至5,析出磺胺醋酰。抽滤,于红外灯下干燥,得到10g,mp.179~184℃(附注6)。如熔点不合格,可用热水(1:15)精制。
3.附注
(1)本实验中使用氢氧化钠溶液用多种不同的浓度,在实验中切勿弄错,否则导致实验失败。
(2)滴加醋酐和氢氧化钠溶液是交替进行,先滴加醋酐后氢氧化钠溶液。每滴加一种溶液后,让其反应5min后,再用玻璃吸管一滴一滴地滴入另一种溶液。
(3)反应中保持反应液pH在12~13之间很重要,否则收率将会降低。
(4)在pH7时析出的固体不是产物,应弃去。产物在滤液中,切勿搞错。
(5)在pH4~5析出的固体是产物。
(6)在本实验中,溶液pH的调节是反应能否成功的关键,应小心注意,否则实验会失败或收率降低。
(二) 磺胺醋酰钠的制备
1.原料规格及配比
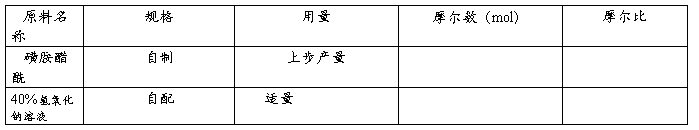
2.操作步骤
将以上所得的磺胺醋酰投入50mL烧杯中,滴加少量水润湿(<0.5mL)(附注1),在水浴上加热至90℃,滴加40%氢氧化钠至恰好溶解,溶液pH为7~8。趁热抽滤,滤液转至小烧杯中放冷析出结晶(附注2)。抽滤,干燥,得磺胺醋酰钠9g。
3.附注
(1)加入水的量以使磺胺醋酰略湿即可。0.5mL较难掌握,可适当多加一些(1mL左右),在析晶时再蒸发一些水分。
(2)此步须趁热过滤。过滤时漏斗应先预热。若滤液放置后较难析出结晶,可置电炉上略加热,使其挥发一些水分,再放冷析晶。
四、预习要求
1. 预习药物化学中磺胺类药物的结构特点及其理化性质。
2. 预习有机化学中,由胺类化合物和醋酐反应制备酰胺的基本原理。
3. 预习有机化学抽滤、重结晶的实验操作。
五、思考题
1. 乙酰化加碱的原理是什么?为何醋酐和氢氧化钠需交替进行?
2. 反应液处理时,pH7析出的固体是什么?pH5析出的固体是什么?在10%盐酸中不溶物是什么?为什么?
3. 在反应过程中,调节pH在12~13是非常重要的。若碱性过强,其结果是磺胺较多,磺胺醋酰次之,磺胺双醋酰较少;碱性过弱,其结果是磺胺双醋酰较多,磺胺醋酰次之,磺胺较少,为什么?
4. 磺胺类药物有哪些理化性质?在本实验中如何利用磺胺类药物的理化性质进行产品的分离纯化?
Experiment 5 Synthesis of Sodium Sulfacetamide
1. Purpose and requirement
1) The general physical-chemical properties of Sulfonamides and how to use them to separate and purify the products should be mastered through this experiment.
2) The principle of acetylation reaction should be mastered through this experiment operation.
2. Experimental principle
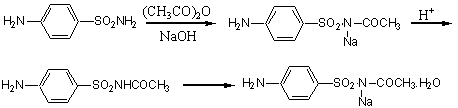
3. Experimental methods
(1)Preparation of Sulfacetamide
1)Materials and reagents
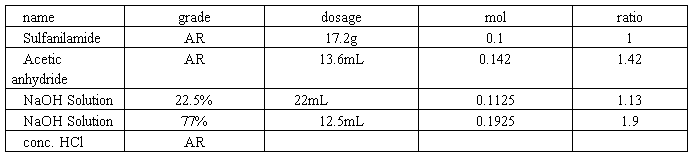
2)Procedures
In a 60mL three-necked, round-bottomed flask, equipped with a mechanical stirrer, a thermometer, and a reflex condenser, are placed 17.2g of sulfanilamide, 22mL of 22.5% NaOH solution. With stirring, the mixture is heated to about 50℃ on water bath. After sulfanilamide is dissolved, 3.6mL of acetic anhydride is dropped, followed by 2.5mL of 77% NaOH solution 5 minutes later (note 1) while pH of the solution must be kept at 12~13. Subsequently 2 mL of acetic anhydride, then 2 mL of 77% NaOH solution are added dropwise every 5 minutes in turn (note 2). During adding period, the reaction temperature of the solution is kept at 50~55℃ and pH at 12~13(note 3). After addition, the stirring is continued for additional 30 mins. The contents of the flask are poured into 100mL beaker, then 20 mL of water is added. The solution is acidified to pH 7 with conc. HCl, and allowed to chill in an ice-water bath for 1~2h. The solid is separated by vacuum filtration with büchner funnel, and washed with proper cold water (note 4). Washing liquor and filtrate are combined to acidify to pH 4~5 with conc. HCl. The precipitate is collected on a suction filter (note 5), and then dissolved with 3 fold of 10% HCl. After standing for 30 mins, the solution is filtered to remove insoluble impurities. To the filtrate carbon activated is added to decolor in room temperature, and then filtered to remove it. When pH of the solution is adjusted to 5 with 40% NaOH solution (note 6), sulfacetamide crystallizes and is filtered with suction filtration. The product, after drying under infra-red light, weighs 10g, mp. 179~184℃. If the melt point isn’t correct, the product may be recrystallized from hot water (1:15).
(2) Preparation of Sodium Sulfacetamide
1)Materials and reagents

2)Procedures
Sulfacetamide obtained is added in a 50 mL beaker, and a little water (0.5 mL) is dropped to wet it (note 7). When the mixtures are heated to 90℃ on a water bath, 40% NaOH solution is added dropwise to dissolved them until pH of the solution is 7~8.After the reaction solution is filtered while still hot, the filtrate is transfered to a small beaker to crystallize with cooling (note 8). The precipitate are filtered by suction filtration and dried to give 9g of sodium sulfacetamide.
4. Notes
1) The concentrations of NaOH solution in the experiment are different. Please don’t mistake in the practice, otherwise it will lead to the failure of experiment.
2) The acetic anhydride and NaOH solution are added dropwise alternately, when one has been added, the solution should react for 5 minutes, then another one is added dropwise with glass sucker.
3) It is important that pH of the solution must be kept at 12~13 in the reaction, otherwise the yield will be decreased.
4) The precipitate at pH 7 is not the product, which is in filtrate, should be discarded. Please don’t mistake
5) The precipitate at pH 4~5 is the product.
6) Be careful! The adjustment of pH in the solution is the key of this experiment, otherwise it will fail or the yield will reduce.
7) The water is so little that it make sulfacetamide just wet. Because 0.5 mL of water is difficult to control, more than 0.5 mL (about 1 mL) of water is added. Some water may be vaporized when the solution crystallizes.
8) The filtration must be done while the solution is still hot and the funnel should be warmed-up. If the filtrate is difficult to crystallize after standing, it may be heated slightly on an electric cooker to vaporize some water, then placed cool to separate out crystals.
5. The requirement for preparation
1) Study the structural and physical-chemical properties of Sulfonamides in Medicinal Chemistry.
2) Study the basic principle of preparation for amide from amines and acetic anhydride in Organic Chemistry.
3) Preparation for filtration and recrystallizing operation in Organic chemistry.
6. Questions
1) What physical-chemical properties do Sulfonamides have? How to use them to separate and purify the product?
2) What was the solid that was separated out at pH 7 when the reaction solution was dealt? What was the precipitate that was separated out at pH 5? What was the insoluble substances when the reaction solution was treated with 10% HCl? Why ?
3) It is very important to adjust pH at 12~13 during the reaction. When the solution of reaction is too alkaline, sulfanilamide is more than sulfacetamide, and N,N-di-acetyl sulfanilamide is least. When the solution is less alkaline, N,N-di-acetyl sulfanilamide is more than sulfanilamide, and sulfacetamide is least. Why?
实验三 苯巴比妥的合成
一、目的要求
1.了解苯巴比妥的制备原理。
2.掌握减压蒸馏技术。
二、实验原理
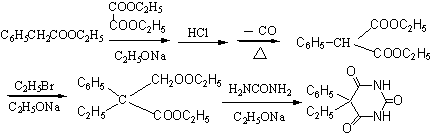
三、实验方法
1.原料规格及配比
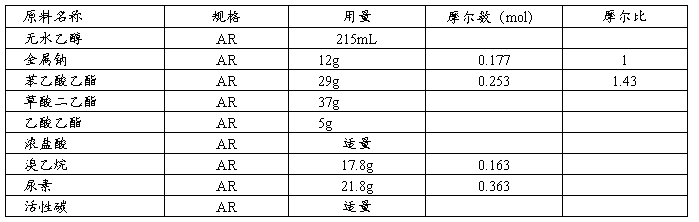
2.操作步骤
(1)苯基丙二酸二乙酯的制备
在装有电热套、搅拌机、温度计和回流冷凝管的三颈瓶中(附注1),加入无水乙醇60mL,金属钠4.2g(附注2),慢慢搅拌反应,待金属钠作用完毕,加入草酸二乙酯5g(附注3),反应10min,升温至70℃,于搅拌下,1min内加入草酸二乙酯32g及苯乙酸乙酯29g的混合液,搅拌10min,改成蒸馏装置用水泵回收乙醇,待冷至30℃以下,将10%盐酸100mL慢慢加入到钠盐中,振摇使溶解,转移至分液漏斗中,静至0.5h,分出酯层(下层),将粗酯在2.63kPa减压下,逐渐将油浴加热至100℃,蒸去水及乙醇,更换接受瓶,在1.33kPa减压下收集159℃以上蒸馏物(或165~166℃/11.4kPa)。
(2)苯基乙基丙二酸二乙酯的制备
在装有电热套、搅拌机、温度计和回流冷凝管的三颈瓶中,加入无水乙醇75mL,金属钠3.2g,搅拌,待金属钠作用完毕,加入乙酸乙酯2g,于80~85℃搅拌30min,降温至58~60℃,加苯基丙二酸二乙酯27g,搅拌30min,加溴乙烷17.8g,65~75℃搅拌反应3h。改为蒸馏装置,电热套加热,蒸出120℃以前馏物,冷却至35℃以下,加水30mL,振摇使NaBr完全溶解,用分液漏斗分出水层,得粗酯。
将粗酯在2.63kPa减压下,于80℃左右蒸去乙醇和水,升温至180~190℃,收集165~166℃/1.58kPa蒸馏物。
(3)苯巴比妥的制备
在装有电热套、搅拌机、温度计和回流冷凝管的三颈瓶中,加入无水乙醇80mL,金属钠4.5g,搅拌,待金属钠作用完毕,加入乙酸乙酯3g,于70℃~75℃搅拌30min,加尿素21.8g及苯基乙基丙二酸二乙酯26.2g,70~75℃搅拌反应1.5h,改为蒸馏装置,120℃回收含氨乙醇。冷却后,加冰水65mL,使溶解。保持温度在5℃以下,加活性碳1g,搅拌10min,过滤,滤液以1:1盐酸中和至Ph4~5,搅拌析出结晶,放置30min后过滤,滤饼以少量1:100盐酸水溶液洗涤3次。抽干。
(4)精制
将滤饼移至2000mL烧杯中,加水1000mL,浓盐酸0.15mL,直火加热溶解后,继续加热10min。稍冷却,加活性碳1g,再加热煮沸5~10min,稍冷,趁热过滤(附注4),滤液放冷,析出白色针状结晶,抽滤,干燥,得到苯巴比妥纯品10g以上,mp:173~178℃。
3.附注
(1)所有仪器必须绝对干燥。
(2)金属钠不宜切得过细,并要分次投入,以免作用过猛。因有氢气产生,严防火源。
(3)将抽滤瓶、布氏漏斗于热水浴中预热。
(4)如有苯基乙基丙二酸二乙酯原料,可直接用其制备苯巴比妥,实验大约需要6学时。
四、思考题
1.醇钠制备完成后为何要加乙酸乙酯反应?写出每一步反应的反应式。
2.复述苯巴比妥制备的反应原理。
实验四 维生素K3的制备
一、目的要求
1.了解亚硫酸氢钠加成物在药物结构修饰中的作用和维生素K3的制备方法。
2.掌握该反应的氧化和加成特点。
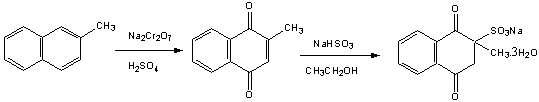
二、反应原理
三、实验方法
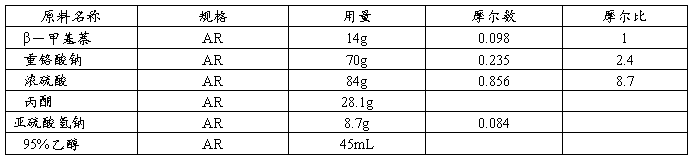
1.原料规格及配比
2.操作步骤
(1)甲萘醌的制备
在装有搅拌、滴液漏斗、回流冷凝管和恒温水浴锅的250mL的三颈瓶中,加入β-甲基萘14g,丙酮28.1g,搅拌至溶解。将重铬酸钠70g溶于105mL水中,与浓硫酸84g(附注1)混合后,于38~40℃慢慢滴加至反应瓶中,加毕,于40℃反应30min,然后将水浴温度升至60℃反应1h。趁热将反应物倒入大量水中,使甲萘醌完全析出,过滤,结晶用水洗三次,压紧,抽干,得甲萘醌湿品。
(2)维生素K3的制备
安装毕恒温水浴、搅拌装置、100mL三颈瓶、冷凝管后,向反应瓶中加入甲萘醌湿品、亚硫酸氢钠8.7g(溶于13mL水中),于水浴38~40℃搅拌均匀,再加入95%乙醇22mL(附注2),搅拌30min,冷至10℃以使结晶析出,过滤,结晶用少许冷乙醇洗涤,抽干,得维生素K3粗品。
(3)精制
将粗品放入锥形瓶中,加4倍量95%乙醇及0.5g亚硫酸氢钠,在70℃以下溶解,加入粗品量1.5%的活性碳。水浴68~70℃保温脱色15min,趁热过滤,滤液冷至10℃以下,析出结晶,过滤,结晶用少量乙醇洗涤,抽干,干燥,得维生素K3纯品, mp: 105~107℃。
3.附注
(1)氧化剂混合时,需将浓硫酸缓慢加入到重铬酸钠水溶液中。
(2)乙醇的加入,可增加甲萘醌的溶解度,以利于反应进行。
四、思考题
1.氧化反应中为何要控制反应温度?反应温度高了对产品有何影响?
2.本反应中硫酸与重铬酸钠属于哪种类型的氧化剂?药物合成中常用的氧化剂有哪些?
实验五 苯佐卡因的合成(参考)
一、目的要求
1.通过苯佐卡因的合成,学习酯化、还原等反应。
2.掌握利用酸碱、有机溶剂重结晶精制固体物质的方法。
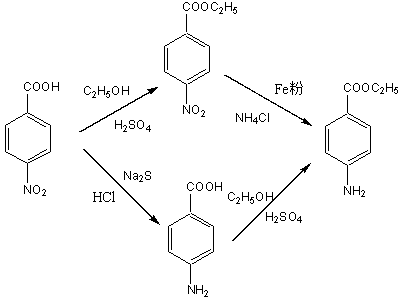
二、反应原理
三、实验方法
1.原料规格及配比
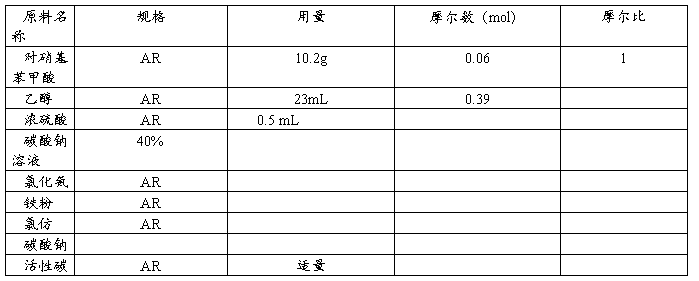
2.操作步骤
(1)对硝基苯甲酸乙酯的制备
在装有搅拌、温度计和回流冷凝管的60mL的三颈瓶中加入乙醇,搅拌冷却下,慢慢加入硫酸(附注1),然后加对硝基苯甲酸。回流5h后(附注2),改为蒸馏装置,反应液蒸出1/2量乙醇。冷却至室温,在反应液中加入冰,析出晶体,再冷却至3~5℃,抽滤。滤饼加5倍量水搅匀,用40%碳酸钠中和至pH7.5~8.0,搅拌,保持pH7.5~8.0,抽滤,得到对硝基苯甲酸乙酯,mp: 56~58℃。
(2)苯佐卡因的制备
将9%的氯化氨溶液升温至95℃,加入铁粉(附注3),保持95~98℃,活化20min,慢慢加入对硝基苯甲酸乙酯,反应1.5h。反应毕,升温至50℃,用40%碳酸钠溶液调节至pH7~8,加入3/4量氯仿搅匀。,抽滤,滤饼用1/4量氯仿洗涤,洗涤液合并,静置,氯仿层用5%盐酸萃取4次(附注4)。静置,分层,取水层,加入固体碳酸钠中和至pH7~7.5(附注5),析出结晶。抽滤,水洗,得苯佐卡因粗品。
粗品用乙醇加热溶解,加活性碳脱色,抽滤,滤液冷却,加3倍量蒸馏水冷至室温,析出结晶。抽滤,水洗,干燥,得苯佐卡因精品,mp: 88~91℃。
3.附注
(1)加硫酸一定要缓慢,以防乙醇被碳化。
(2)在回流过程中,反应液逐渐澄明,澄明后要继续回流一段时间,使反应趋于完全。
(3)铁粉一定要活化,否则还原效果不佳。
(4)在用氯仿萃取时,氯仿比重大,在下层。
(5)用固体碳酸钠中和时,应慢慢加入碳酸钠,以防大量泡沫溢出。
四、思考题
1.酯化反应为可逆反应,为打破平衡使反应向生成物方向移动,可采用哪些措施?
2.铁粉为什么一定要活化后还原效果才好?
3.苯佐卡因制备中可能带来哪些杂质,如何除去?
