药品不良反应监测报告制度和流程
加强药品的安全监管,严格药品不良反应监测工作的管理,确保人体用药安全有效,依据《中华人民共和国药品管理法》及《药品不良反应监测与报告管理办法》,结合本院实际,特制定本制度。
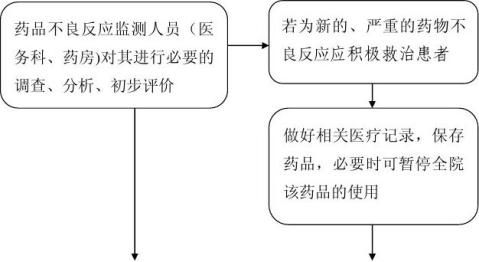
一、各临床科室主任为药品不良反应监测工作的管理人员,负责本科室使用的药品的不良反应情况监测、收集、报告和管理工作。医务科、药房负责全院药品不良反应的监测、收集、报告管理工作。
二、报告范围:药品不良反应报告的范围为药品引起的所有可疑不良反应。
三、 报告及处理程序
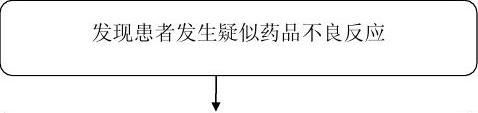
1本院对所使用的药品的不良反应情况进行监测,各岗位○
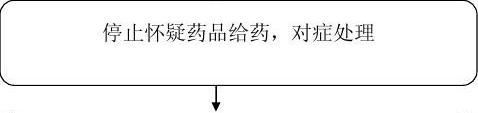
(医生、护士、药师)要积极配合做好药品不良反应监测工作,一经发现可疑药品不良反应,应当立即向科主任汇报,填写《药品不良反应/事件报告表》(见附表),并报告至医院药品不良反应监测员(医务科、药房),然后逐级上报。此外,对于新的、严重的不良反应应积极救治患者,做好医疗记录,保存好相关药品、物品的留样,分析查找问题,将损害降至最低。
2 本院发现可疑药品不良反应群体病例,应当积极救治患○
者,迅速开展临床调查,分析事件发生的原因,必要时可采取暂停药品的使用等紧急措施,立即向当地药品监督管理部门报告,同时填写《药品群体不良事件基本信息表》(见附表3)。
3 发现药品说明书中未载明的可疑严重不良反应病例应○
1
当在15日内报告,其中死亡病例须立即报告。其他药品不良反应应当在30日内报告。有随访信息的,应当及时报告。
4 发现非本院所使用的药品引起的可疑药品不良反应,发○
现者可直接向当地药品监督管理部门报告。
5 经核实确认某批号药品发现不良反应或药品监督管理○
部门已确认有药品不良反应的药品,单位药品质量负责人应立即通知仓库管理员,停止该批号药品发出,就地封存,并及时追回已发出的药品等紧急控制措施。
四、未经当地药品监督管理部门允许的药品不良反应监测资料,任何单位和个人不得向国内外机构、组织、学术团体或个人提供。
五、 对新发现的、严重的药品不良反应应进行重点监测,进一步了解药品的临床使用和不良反应发生情况,研究不良反应的发生特征、严重程度、发生率等,开展的药品安全性监测活动。
六、医院鼓励各科室积极及时上报药品不良反应,其上报情况纳入科室评先评优的指标之一。
七、定义:
1 药品不良反应,是指合格药品在正常用法用量下出现的○
与用药目的无关的有害反应。
○2 药品不良反应报告和监测,是指药品不良反应的发现、报告、评价和控制的过程。
○3 严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1.导致死亡;
2
2.危及生命;
3.致癌、致畸、致出生缺陷;
4.导致显著的或者永久的人体伤残或者器官功能的损伤;
5.导致住院或者住院时间延长;
6.导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
○4、 新的药品不良反应,是指药品说明书中未载明的不良反应。说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
○5、药品群体不良事件,是指同一药品在使用过程中,在相对集中的时间、区域内,对一定数量人群的身体健康或者生命安全造成损害或者威胁,需要予以紧急处臵的事件。
同一药品:指同一生产企业生产的同一药品名称、同一剂型、同一规格的药品。
6、药品重点监测,是指为进一步了解药品的临床使用和○
不良反应发生情况,研究不良反应的发生特征、严重程度、发生率等,开展的药品安全性监测活动。
3
药物不良反应报告及处理程序


4
第二篇:药品不良反应监测报告制度和处理程序的规定
药品不良反应监测报告制度和处理程序的规定
字体大小:大 | 中 | 小 2012-05-05 13:05 阅读(56) 评论(0) 分类:
药品不良反应监测报告制度和处理程序的规定。
一、本条第一款规定了国家实行药品不良反应监测报告制度。所谓“药品不良反应”,是指合格药品在正常用法用量下出现的与用药目的无关的或意外的有害反应。药品不良反应分为A型(量变型异常)、B型(质量型),前者是由药理作用增强所致,可以预测,在人群中发生率高但死亡率低,后者特点是与正常药理作用无关,难以预测,发生率低但死亡率高。药品不良反应主要有:(1)对人体有害的副作用。这是治疗剂量的药品所产生的某些与防治无关的作用,如阿托品通常用于解除肠胃痉挛而引起口干等。(2)毒性作用。临床常见的毒性反应包括中枢神经系统反应,如头痛、眩晕等;造血系统反应,如再生障碍性贫血等;肝肾损害,如肝肿大等;心血管系统反应,如血压下降、心动过速等。(3)过敏反应,包括全身性反应,如过敏性休克;皮肤反应,如固定性药诊。(4)药物依赖性,主要是由于长期使用麻醉性药品所致。(5)致突变、致畸、致癌,主要是使用具有致突变、致畸、致癌因子的药物所致。(6)其他不良反应,如二重感染、异性蛋白等。
二、随着医药科学的飞速发展,药品品种日益增多。由于多方面的原因,一些经过审批上市的药品也还会不同地程度地存在着质量不高、疗效不实、不良反应严重的问题。通过临床用药评价新药,对已生产的药品进行再评价,淘汰危害严重、疗效不确或者不合理的组方,势在必行。药品不良反应监测和报告制度的建立,可为评价、清理、改进或者淘汰药品提供重要的科学依据,也是维护人民用药安全的一项切实可行的重要措施。从国际上看,药品不良反应报告制度是国际上通行的科学、规范的制度。本条规定则是以法律形式,将药品的不良反应监测报告制度作为一项法定制度固定下来。各有关方面应当认真执行。
三、按照本条第一款的规定,经常性地考察本单位生产、经营、使用的药品的质量、疗效和不良反应,并向省级政府药品监督管理部门和卫生行政部门报告所发现的药品严重不良反应,是药品生产企业、经营企业和医疗机构的法定义务。这些单位应当依照本条的规定,本着对人民群众健康和生命安全高度负责的精神,认真履行对相关药品不良反应的监测和报告制度。
四、按照本条规定,当药品生产企业、药品经营企业、医疗机构发现可能与用药有关的严重不良反应时,必须及时向当地省、自治区、直辖市药品监督管理部门和卫生行政部门报告。这里的“严重不良反应”主要包括:( 1)因服用药品引起死亡的;(2)因服用药品引发癌症或致畸的;(3)因服用药品损害了重要生命器官,威胁生命或丧失正常生活能力的;
(4)因服用药品引起了身体损害而导致住院治疗的;(5)因药品不良反应延长了住院治疗时间的等。
五、对于药品不良反应报告制度的具体办法,本法授权由国务院药品监督管理部门会同国务院卫生行政部门制定。
六、本条第二款规定了对已确认发生严重不良反应的药品的处理程序:
1.国务院或者省、自治区、直辖市人民政府的药品监督管理部门可以采取停止生产、销售、使用的紧急控制措施。国务院或者省、自治区、直辖市人民政府的药品监督管理部门根据依法报告的严重药品不良反应病例,以及其他国家和地区药品主管当局的严重药品不良反应统计信息资料所作出的相应事实结论,对已确认发生严重不良反应的药品采取停止生产、销售、使用的紧急控制措施,这一方面可以有效防止该药品使用范围继续扩大而导致发生严重不良反应的人群增多,同时也可以在此期间组织有关专家对药品进行鉴定,便于作出行政处理决定。
2.国务院或者省、自治区、直辖市人民政府的药品监督管理部门对已确认发生严重不良反应的药品除采取停止生产、销售、使用的紧急控制措施外,还应当在五日内组织鉴定,为作出行政处理提供技术依据。
3.有关药品监督管理部门应当自鉴定结论作出之日起十五日内依法作出行政处理决定。行政处理决定一般包括两种情况:一是经过鉴定后认为继续使用该药品不能保证用药者安全的,或者有其他药品可以取代的,可依照本法第四十二条的规定,由国务院药品监督管理部门撤销该药品的批准文号或者进口药品注册证书;已经生产或进口的,由当地药品监督管理部门监督销毁或处理。二是经过综合考虑,以最大可能保证用药安全为前提,在可控制的条件下继续使用该药品,如采取修改说明书,调整用法用量、增加注意事项和给以特别警示等措施后,撤销对该药品的紧急控制措施。
