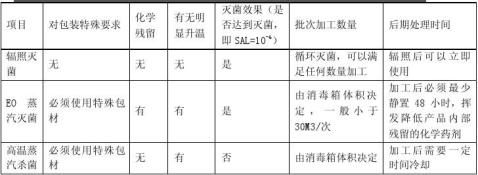
辐照灭菌
确 认 报 告
编制: 日期:
审核: 日期:
批准: 日期:
目录
1概述
2目的
3验证人员
4验证进度
5验证方案内容
5.1设备检查确认
5.1.1安装确认与运行确认
5.1.2辐照单位相关资质证件(附件一)
5.2性能确认
5.2.1目的
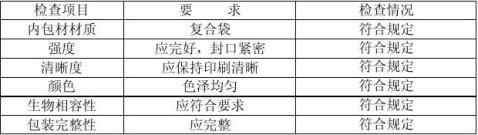
5.2.2内包装材料材质确认
5.2.3辐照灭菌剂量的确认
5.2.4辐射灭菌加工确认
5.3灭菌效果确认
5.3.1灭菌后产品无菌确认
5.3.2 灭菌后包材效果确认
6.确认结论
7.确认的保持
7.1生物负载监测
7.2剂量审核
7.3辐照条件的保持
8再确认
9文件保存
1概述
辐照灭菌与其他主要灭菌方式对比所存在的优点
1)辐照消毒灭菌原理:
在辐照过程中,伽玛射线穿透辐照货箱内的货物,作用于微生物,直接或间接破坏微生物的核糖核酸、蛋白质和酶,从而杀死微生物,起到消毒灭菌的作用。 3)医疗用品辐照灭菌的优点:
⑴ 辐照消毒灭菌彻底,无污染、无残留。 ⑵ 辐照消毒灭菌不需加热,是一种"冷消毒"法。
⑶ γ射线穿透力强,加工时不需要打开产品包装,操作简单快捷,可连续作业,易于过程控制。
⑷ 消毒灭菌后的产品在密封状态下可长期保存。 2目的
确认钴-60灭菌系统能够在正常运行状态下使产品达到工艺要求,设备各项性能指标符合设计要求,保证灭菌出稳定的产品,满足产品无菌需求。根据《医疗器械生产质量管理规范》的要求,必须对钴-60灭菌效果进行验证。
3验证人员

4验证进度
验证时限 年 月 日至 年

月 日。 5验证方案内容 5.1设备确认
5.1.1安装确认与运行确认
受委托辐照加工单位根据“辐射灭菌委托加工要求”提供与本产品灭菌要求相一致的、灭菌效果稳定的设备,设备各安装与运行均达到灭菌要求。
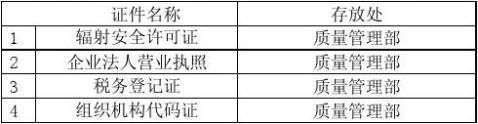
确认标准:应达到灭菌要求和符合《医疗器械生产质量管理规范》要求。 5.1.2辐照单位相关资质证件:
5.2性能确认
5.2.1目的:通过性能确认,证明灭菌系统能使本产品符合标准要求的无菌产品。
标准:辐照灭菌后,灭菌保证水平达到SAL=10-6
操作方法:在确定灭菌剂量及初始污染菌情况下,公司提供辐照灭菌要求,由辐照灭菌加工单位实施灭菌活动,并确认灭菌活动后产品物理性能、生物性能
符合一次性医用产品注册标准规定要求。 5.2.2内包装材料材质确认
5.2.3 辐照灭菌剂量的确认
验证的原理是基于ISO11137方法,即先对辐照前产品的初始污染菌进行测定,然后选择验证剂量。再用验证剂量对产品进行辐照,并测定存活微生物的样品件数,以此来确定最低灭菌剂量(SAL=10)。 5.2.3.1方法
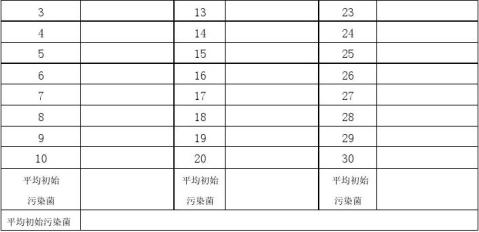
收集常规生产的标准包装产品,于灭菌前对三个批号进行随机抽样,每个批号取10个。
5.2.3.2初始污染菌的测定
根据每个样品的测试结果,计算出每个产品的平均带菌数。初始污染菌的菌数取自三个独立批的单位产品的总平均带菌数。 试验方法:(平板计数法)
1.洗脱液:0.9%的无菌氯化钠溶液。
2.样品处理:将随机抽取的30个样品编号后,分别用100ml 洗脱液洗脱,吸取1ml置于9ml稀释液中,得到10-1、10-2样,振摇均匀后分别取1ml样品液于两个平皿中。依次取第二片样品,至第30个样品。倾注营养琼脂,于35℃培养箱中培养48±2h,记录结果,见表1。
表1
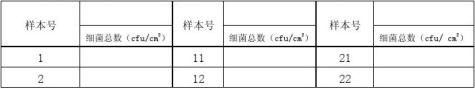
:初始污染菌检测结果
-6
5.2.3.4验证剂量的选定及最大耐受剂量的确定
ISO 11137:2006 医疗器械灭菌的有效性确认和常规控制的要求中规定,若批次平均生物负载的每一个生物负载数值< 总的平均生物负载*2,则用总的平均生物负载,若一批或更多批次的平均生物负载≥总的平均生物负载*2,则用最高批次。本次试验采用总平均初始污染菌20(cfu/ cm)确定验证剂量。查ISO11137:
2
2006 表格得出对应的验证剂量为6.0kGy,该试验剂量下的无菌保证水平SAL为10。
-2
再按要求对100个单位产品采用6.0kGy±10%的验证剂量进行辐射处理,再经无菌检查。根据以上说明,验证剂量为6.0kGy±10%,对100个样品进行辐照,剂量为5.40~6.60kGy。
从 批抽取100个样品,在 辐照科技有限责任公司辐照。所照剂量用该公司放置的剂量计测定,保证所测剂量落在规定剂量的±10%之内。
同时,再抽取10个样品,做最大耐受剂量的确定,最大辐照剂量采用35.0 kGy,对辐照完样品进行理化及生物性能检测。 5.2.3.5 产品无菌检测 5.2.3.5.1供试品处理
取1cm×3cm接种于培养基。 5.2.3.5.2无菌检验培养温度
硫乙醇酸盐流体培养基,置30~35℃培养。
改良马丁培养基,置23~28℃培养。
5.2.3.5.3培养、观察
分别置规定温度的恒温培养箱中,培养14天。培养期间应逐日观察并记录是否有菌生长。结果见表2。
表2 无菌试验检验结果
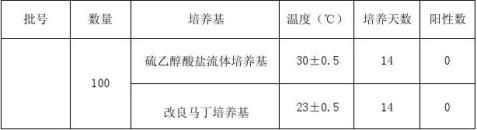
结论:经测试,试验产品为无菌产品,即100个样品经验证剂量辐照后的无菌检查均为阴性。
5.2.3.6 最大耐受剂量样品检测
经检测,经35 kGy辐照过的10个样品其理化及生物性能均符合要求,因此该产品的最大耐受剂量确定为35.0 kGy。
5.2.3.7结论
剂量验证实验结果符合ISO11137中规定的合格标准。这表明,在本研究条件下,18.7kGy可确定为常规灭菌最低剂量,此剂量提供的灭菌保证水平为SAL=
10-6。最大耐受辐照剂量为35.0kGy
依据ISO 11137 :2006 标准,为了确保作为10-6SAL的灭菌剂量持续有效,必须按照规定的周期进行验证剂量审核,通常每3个月进行一次。
5.2.4辐射灭菌加工确认
灭菌剂量18.7~35.0kGy的条件下,通过对该产品辐射灭菌过程的有效性进行确认,确定辐射灭菌过程运行参数,保证产品的灭菌质量。
5.2.4.1产品装载模式的确认
包装箱尺寸: cm× cm× cm
每个包装箱内产品的数量:
内包装:复合袋
中包装材料:纸盒。
外包装材料:双瓦楞纸板。
5.2.4.2产品装载模式图及剂量计放置图
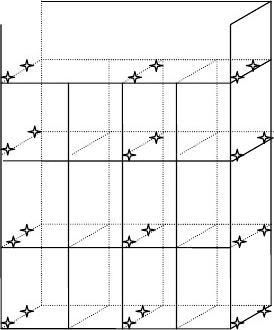
产品装载模式图
图二、剂量计放置图
参照安装鉴定吊箱中的剂量分布,将该产品在1号装置运行参数确定每工位停留时间为20分00秒。 5.2.4.3实验数据
一、产品在吊箱中吸收剂量的分布(1) 测量结果:

注:1.No.表示剂量计编号,D表示剂量计吸收剂量。 2.常规监测点剂量计剂量吸收量Ds=24.3kGy
结论:辐照吊箱中最大吸收剂量Dmax=25.1kGy,最小吸收剂量Dmin=18.9 kGy,不均匀U=Dmax/Dmin=1.328。最小吸收剂量与常规监测点处的吸收剂量之间的关系r=Dmin/Ds=0.778,最大吸收剂量与常规监测点处的吸收剂量之间的关系R=Dmax/ Ds=1.033。
二、产品在吊箱中吸收剂量的分布(2)
测量结果:
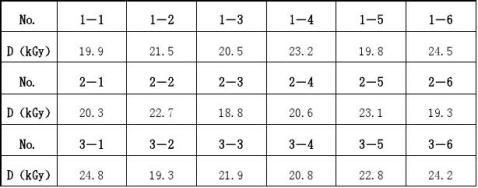
注:1.No.表示剂量计编号,D表示剂量计吸收剂量。
2.常规监测点剂量计剂量吸收量Ds=24.5kGy
结论:辐照吊箱中最大吸收剂量Dmax=25.1kGy,最小吸收剂量Dmin=18.9 kGy,不均匀U=Dmax/Dmin=1.328。最小吸收剂量与常规监测点处的吸收剂量之间的关系r=Dmin/Ds=0.771,最大吸收剂量与常规监测点处的吸收剂量之间的关系R=Dmax/ Ds=1.024。 5.3灭菌效果确认
5.3.1灭菌后产品无菌确认
当产品委托辐照灭菌完成后,测试灭菌后的产品,确认达到标准要求。 测试步骤:对最终灭菌出来的产品取样进行无菌测试,检测周期14天。 测试结果如下:

5.3.2 灭菌后包材效果确认
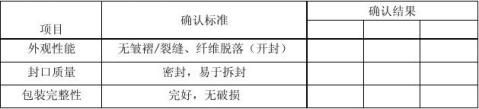
6.确认结论
辐照机构、辐照剂量、辐照加工确定程序符合ISO11137:2006的要求,通过确认,该辐照加工方式可用于产品大规模日常辐照。 7.确认的保持
通过生物负载监测、剂量审核来确定灭菌剂量的持续有效,通过辐照条件的保持来确认辐照加工的持续有效。 7.1生物负载监测
建立灭菌剂量后每3个月抽取代表产品进行生物负载监测,实验依照中华人民共和国药典2010版附录XI J微生物限度检查法和ISO11737-1:2006进行,批平均生物负载应小于当初建立灭菌剂量时的生物负载值。 7.2剂量审核
建立灭菌剂量后每3个月抽取代表产品进行剂量审核,剂量审核按照
ISO11137-2:2006要求需完成生物负载实验、剂量实验及无菌实验。剂量审核
成功灭菌剂量持续有效。
7.3辐照条件的保持
检查辐照条件,当辐照条件发生变化时,根据影响的结果进行剂量分布实
验或再确认或更换辐照机构。
8再确认
(1)当辐照机构发生变化时,需进行辐照机构确认、辐照加工确认。
(2)当代表产品发生变化、剂量审核失败导致重新建立灭菌剂量时,需进
行辐照剂量确认。
(3)当辐照条件发生变化时,需进行辐照加工确认。 9文件保存
本报告所有资料保存于质量部。
第二篇:医疗器械辐照灭菌







