2012-2013学年度
初中化学质量分析报告
课堂是学生获取知识的主要场所,但随着社会的发展和科学技术的进步,其自身的存在的一些不足越来越凸现出来,转变教育理念,改革课堂教学模式,已成为时代的需要和社会发展的要求。就初中化学课来说,教师要在课堂四十五分钟内向学生传授化学基础知识和基本技能,并使他们能轻松接受,这必须要下一番工夫。本人从事初中化学教学十多年来,在上级教研部门的指导下,对化学教学的改革进行了初步的摸索,提高了化学教学质量,下面我结合自己的教学,谈一下自己的肤浅的认识。
一、抓住课堂教学主阵地,提高教学质量
课堂是学校教学工作的主阵地,提高课堂教学效率,向课堂45分钟要质量,应当是每一位教师的毕生追求。 教师是课堂教学的组织者、指导者,学生是课堂学习的主人。要使学生在有限的时间内获得最大的收益,教师就必须不断地优化组织学习的形式,使之最大程度地适应学生学习的需要。而教师要做到这一点,就必须充分了解学生——了解学生的现状,了解学生对化学的了解程度,了解学生对化学的期望值,了解学生对我的评价。我经常采取以下方法来了解学生。
1、测试。每隔一个阶段对学生进行一次测试,对学生的成绩的变化情况进行跟踪了解,形成学生的成绩档案。
2、观察。作为教师,必须养成观察学生的习惯。我们不仅要在课堂上观察学生的表现,还要观察学生课余时间的行为举止。
3、谈心。教师要想真正了解自己的学生,就必须做学生的朋友,赢得学生的信任,他们才愿意把自己心中的秘密告诉你。课余时间要与学生一起谈生活习惯,谈兴趣爱好,进行心与心的沟通。
二、准确把握中考试题特点,提高教学的针对性
(一)中考试题的特点
1、重视夯实双基,体现化学学科的基础性和发展性 由于化学学业考试要求初中毕业生能掌握自身未来发展所需要的最基础的化学知识和技能,具有运用化学知识和科学方法来分析和解决实际问题的能力。重视对化学核心观点和科学素养的考查,能将三维目标全面整合并渗透在试题的背景和内涵之中,考查学生持续学习和发展应具有的基本化学科学素养。
2、突出科学探究,重视培养学生的科学素养
今年试题仍然侧重对科学探究的考查,注重考查学生的科学素养,通过创设生动、多样的科学探究和实践活动情境,考查学生在真实情景中应用所学知识解决问题的能力,培养创新精神和实践能力。
3、联系社会实际,体现化学学科的教育性和人文性 今年化学试题背景新颖,很多试题起点高,落点低,有些原创试题的取材紧密关注化学与环境、化学与生命、化学与材料、化学与社会发展,体现化学学科的教育性、人文性。
4、促进学生发展,培养实践创新能力
今年的试题也体现了开放性,对于培养学生的创新精神具有积极的意义。许多试题都蕴涵科学精神与人文精神的教育,对学生的兴趣、环保意识、基本观点、科学的方法,态度、情感、科学知识、学习方法和科学研究方法等诸多方面都起到潜移默化的熏陶作用。
(二)教学针对的策略
1、加强基础知识和基本技能的灵活应用
双基是素质教育的重要组成部分,教师在平时的化学教学中,既要转变教学观念,体现新课改理念,探索新的教学方法,又要注重夯实双基。在熟练掌握双基知识基础上,要学会灵活应用,知识迁移、举一反三、触类旁通。
2、加强科学探究的训练,培养创新精神
注重过程与方法的考查和评价是今后教学的导向,广大教师应积极创设情境,将科学知识、科学过程和科学文化统一于科学探究,以课程标准提出的科学探究能力的八大要素——“提出问题、猜想与假设、制定计划、进行实验、收集证据、解释与结论、反思与评价、表达与交流”为着眼点,让学生在经历探究的过程中,提高观察、实验能力、思维能力、运用科学方法的能力、判断决策的能力、想象能力和表达、交流、合作的能力等,逐步养成善于发现、勤于思考、勇于表达、大胆创新的良好科学素养,设计一些开放题与实践题,通过过程开放或结论开放习题以形成学生积极探究的问题情景,鼓励学生多角度、多侧面、多层次思考问题,有助于充分调动学生的潜在能力,培养创新精神和实践能力。
3、从化学的视角认识科学、技术、社会和生活,增强学生对自然和社会的责任感
教学中要密切联系社会、生产生活实际,关注国内外重要时事热点,在以学生的全面发展为本的理念上,初步形成主动参与社会决策的意识和责任感,形成热爱祖国和家乡、珍惜资源、爱护环境、合理使用化学物质等积极的情感、态度和价值观。教学中注意将科学精神与人文精神进行融合,蕴含基本观点、生活科学知识、环保意识、科学方法等教育。 另外,加强主观性试题答题能力的训练,提高语言表达能力,逻辑思维能力等。
三、对以后教学建议
1. 注重基础知识的教学,面向大多数学生
近几年中考命题注重基础,适当控制难度,强调知识整合应用,体现了化学的学科特点,这有利于发挥中考对教学的导向作用。
但从对考试结果的统计分析我们看到,低分率虽然比往年有所降低,但还是达到了11.5%。尽管在命题过程中已经考虑到了低分层面的学生,并设置了部分送分题目,但学生仍然不会做,送分题送不出去,这已不是仅靠降低试题难度能减少低分人数、降低低分率的问题了,这说明有一部分学生化学基础知识太差,甚至完全没学。由于低分人数过多,也导致了平均分、及格率仍然偏低。造成这种局面的主要原因有:一是在实施新课程的背景下,由于教学内容的呈现形式、教与学的方式方法以及考试要求的改变,师生双方都还有些不适应的地方,导致学生两极分化的现象更为突出;二是各地初中学校普遍开办五花八门的实验班,优秀学生和优秀教师都集中在实验学校、实验班,教学资源不均衡,对普通班的学生降低教学要求,疏于管理,客观上形成了有些学校“双差生”面不减反增的局面。教学面向全体学生,整体提高教学质量,以体现教育的公平性,这是摆在我们每一所初中学校、每一名中学化学教师面前不容回避的问题,我们全体教师都要为之而做出不懈的努力。
2.加强过程教学,注重教学细节,激发和训练学生的创新思维
要提高课堂教学的质量,除扎实对学生的基础知识、基本技能、基本方法教学外,更应注重学生的创新思维能力的培养。在近几年中考试题中,对于纯知识性题目的考核逐渐偏少,取而代之的则是更多的知识应用性题目,考察学生的知识迁移能力、分析问题和解决问题的能力。因此,教学中不要为提高“效率”而简简单单给出结论让学生记,给题目让学生练的死记硬背和题海战术方式,教师应设法激发和训练学生的创新思维的内在品质,从而达到事半功倍的教学效果。
3.加强规范教学,培养学生的科学素养
在阅卷过中程发现,很多考生的失分都是答题不规范造成的,如该写物质化学式的错写成物质名称,书写方程式不用等号、不注明反应条件,简答题叙述不清,计算题格式不规范等等;再如,由于现在强调“不死记硬背”,很多知识该记的也不记了,有些知识虽然学过了,但不少学生脑袋里是一片空白;还有一些知识内容因降低了教学要求,在教学中就采取放弃、完全不做要求,特别是化学计算方面的能力下降明显。种种现象都反映出学生在学习和解答问题的过程中缺乏规范性的意识,这是与一些教师平时教学要求不严有一定关系的。教师在教学过程中要身体力行,做好表率,要重视自己的言行、书写表达习惯和实验操作示范对学生潜移默化的影响,将规范教学寓于常规训练之中,要明白“糊里糊涂做十题,不如明明白白做一题”的道理,加强规范教学,培养学生的科学素养。
4、注重学生能力的培养。
学生的能力是我们在教学过程中逐步培养起来的,不能想靠几套试题就可以训练得好的,“练”只是其中较小的一个方面,在教学中教师的“导”很重要。在中考中我们可以看到对学生的能力要求在不断加强,如思维能力、推理能力、归纳能力、阅读能力(能在阅读中抓住信息)、表达能力、探究能力、计算能力、学习能力等都不是在一朝一夕能练成的,是一个循序渐进逐步渗透的过程。
5、强化实验,发展技能。
教师要积极创造条件强化实验教学,以严谨的科学态度给学生示范,启发学生从生动的直观上升到抽象的思维,并掌握化学实验的基本操作程序要素。重视学生的探究实验,教给学生探究的方法,帮助他们养成预习、设计、动手、观察、记录、思考与实验报告等良好的习惯和实事求是的科学态度。
努力做一个反思型的教师
教学反思是教师对自己已完成的教学实践活动有目的地进行审视,作出理性思考,并用以指导日后的教学。反思型的教师就是通过思考、解剖自己日常教育实践而不断超越和提升自己教育境界的教师。具体途径有:
1、在教学实践中进行自我反思
教师在每一堂课结束后,要进行认真的自我反思,思考哪些教学设计取得了预期的效果,哪些精彩片断值得仔细咀嚼,哪些突发问题让你措手不及,哪些环节的掌握有待进一步改进等等。
2、在理论学习中自我反省
教师要如饥似渴地学习和研究先进的教育教学理论,并自觉地运用理论反思自己的教学实践,指导自己的教学活动,在学习中深刻反思,认真消化,并付诸于实践。
3、在相互借鉴中自我反思
教师之间,多开展相互听课、观摩活动,不但可以避免闭目塞听、孤芳自赏而成为“井底之蛙”,而且能够使我们站在“巨人的肩膀”上高瞻远瞩。教师要对所听和观摩的每一堂课都要研究、思考、探讨,并用以反思自己的教学,进行扬优、集优、储存,从而走向创新。
教学反思既是教学过程的一个必要环节,是努力提高教学效益的重要途径,又是教师积极积累教学经验的有效方法。不断进行教学反思,努力做一个反思型教师,可以获得宝贵的经验、教训,及时发现新问题,激发教师把教学实践提升到新的高度,实现教师的自我超越。
总之,我们要多方面的找原因,多角度的看问题,多途径的提高化学的中考成绩。
第二篇:初中化学-元素质量分数试题例析
元素质量分数试题例析
一、根据化合物中某元素的质量分数求化学式
例1:已知锰元素的一种氧化物中氧元素的质量分数为50.5%,此氧化物的化学式为( )。
A.MnO B.Mn2O3 C.MnO2 D.Mn2O7
分析:设氧化物的化学式为MnxOy,则有55x:16y?495%.:505%.,解得
x:y?2:7。故选D。
二、根据化合物中某元素的质量分数求相对分子质量
例2:“骨质疏松症”是人体缺钙引起的,可服用补钙剂来治疗。乳酸钙是一种常见的补钙剂,测知乳酸钙分子中含有一个钙原子,钙元素的质量分数为18.34%,则乳酸钙的相对分子质量为______________。
分析:根据化合物中,某元素的质量分数?n?相对原子质量?100%,则有: 相对分子质量
18.34%?1?40?100%,解得相对分子质量为218。 相对分子质量
故答案为218。
三、根据混合物中一种元素的质量分数,求另一种元素的质量分数
例3:由Na2S、Na2SO3、Na2SO4三种物质组成的混合物中,测得硫元素的质量分数为32%,则氧元素的质量分数为____________。
分析:观察三种物质的化学式的特征可知,所含Na与S的原子个数比均为2:1,由此可知,两种元素有固定的质量比,其质量比等于相对原子质量之和的比,还等于质量分数比,因此有23?2Na的质量分数?,解得钠元素的质量分数为46%,氧元素的质量分数为:3232%
1?32%?46%?22%。
故答案为22%。
四、根据混合物中某元素的质量分数,确定物质的组成
例4:某气体由CO、CH4、SO2中的一种或几种组成,已知氧元素的质量分数为50%,则该气体的组成可能有____________种,分别为____________。
分析:三种化合物中氧元素的质量分数分别为57.14%、0.50%,如果该气体由一种物质组成,只能为SO2;如果由两种物质组成,根据平均值法,其中一种物质中氧元素的质量分数应小于50%,另一种物质中氧元素的质量分数应大于50%。故该气体应由CO和CH4组成;三种物质都含有也符合要求。
故答案为3种,分别为SO2;CO、CH4;CO、CH4、SO2。
五、根据混合物中某元素的质量分数,求含该元素的化合物的质量分数
例5:有一不纯的硝酸铵(NH4NO3)化肥,杂质中不含氮元素,测知该化肥中氮元素的质量分数为31.5%,则该化肥的纯度为______________。
分析:设化肥的质量为100g,硝酸铵的纯度为x。根据混合物中,氮元素的质量分数?100gx?35%氮元素的质量.??100%,解得x?90%。 ?100%,则有:315%混合物的质量100g
故答案为90%。
巧解初中化学计算题
一. 有关化合物中元素的质量比和质量分数的计算
例1.多少吨NH4NO3的含氮量和1吨尿素[CO(NH2)2]的含氮量相当?
[解题思路]:由一定量的一种物质中所含某元素的质量,求含有相同质量的该元素的另一种物质的量.通常用关系式法进行计算。本题根据化学式NH4NO3中所含氮原子数与化学式[CO(NH2)2]中所含氮原子数相等这一关系解题。 解:设和一吨尿素含氮量相当的NH4NO3的质量为x
关系式: [CO(NH2)2] - NH4NO3
已知量: 60 80
未知量: 1吨 x
比例式:
练习题:
18g水(H2O)中所含氧元素与多少克CO2中所含氧元素的质量相同?(答案:22g)
例2.求氧元素质量相等的CO和CO2和质量比
[解题思路]由于2CO和CO2的氧原子个数相等,即氧元素质量相等,故可按等效相同氧原子的方法,即”等效化学式”
巧解此题。
解:关系式: 2CO - CO2
物质质量比: 56 44
即56份质量的CO和44份CO2中所含氧元素的质量相等
[引申发散]求等质量的CO和CO2中,所含氧元素的质量比 (答案:44:56)
练习题:
1.氧原子个数相等的SO2和SO3的质量比是多少?(答案:16:15)
2.纯净的SO2气体和纯净的SO3气体各一瓶中,硫元素的质量比为5:1,则SO2和SO3的质量比是( ) 6080= x=1.33(吨) 1吨x
A.1:1 B.4:1 C.4:5 D.2:5 (答案:B )
例3.有一不纯的硫酸铵样品的含氮质量百分含量是20%,则该样品含硫酸铵的纯度是多少?
[解题思路]: 若样品中含 (NH4)2SO4100%则含氮的质量分数为2N(NH4)2SO 4X100%=21.2%
解1:设样品中(NH4)2SO4的纯度为x%,则:
(NH4)2SO4 - 2N
100%
x%
解2:关系式法: = 20%21.2% 得样品中(NH4)2SO4纯度为94.3%
(NH4)2SO4 - 2N
132 28
x 20 x=94.3 得样品中(NH4)2SO4纯度为94.3%
很明显,关系式法解此题方便。
练习题:
某氨水中氨(NH3)的含量为8.5%,1000g该氨水中氮元素的质量为( )
A.7% B.7g C.70g D.85g (答案:C)
[引申发散]:某NH4NO3样品中混有一种其他氮肥,经分析产品中氮元素质量分数为20%。那么,该样品中可能含有的氮肥:( )
A. (NH4)2SO4 B. NH4Cl C.CO(NH2)2 D. NH4HCO3
[解题思路]:在解答混合物成分判断选择题中用”平均值”原理,会大大简化计算中的步骤:样品含氮元素质量分数的平均值为20%,纯NH4NO3含氮元素质量分数为35%。因此混入的氮肥含氮元素质量分数必小于20%。 (答案:D)
练习题:
1.有一不纯的NH4NO3样品,经分析知道,200g样品中含氮元素60g(杂质中不含氮元素)。求样品中NH4NO3的质量分数。(答案:85:72)
2.有一不纯的石灰石样品,经分析知道它有9%的碳,则该样品里含CaCO3的质量分数为( )
A.9% B.12% C.25% D.75% (答案:D)
3.MgO,MgSO4和MgHPO4组成的混合物中镁元素的质量分数为33%,则混合物中氧元素的质量分数为多少?
[解题思路]: 三种物质的组成元素为五种,这为一类特殊的物质组成计算题。解题的优选方法是 ”拆分法”。可将三种物质分析为MgO、MgO.SO3、 MgO.HPO3。 (答案:49%)
4.由硫酸铁和硫酸亚铁组成的混合物,经测定知其中硫元素的质量分数为a%,则混合物中铁元素的质量分数为( )
A.1-a% B.1-2a% C.1-3a% D.无法计算 (答案:C)
5.Na2SO4、FeSO4、Al2( SO4)3三种固体的混合物中,Na、Fe、Al三种元素的质量百分含量之和为A%,则混合物中硫元素的质量百分含量为多少?(答案: 100?A%) 3
例4.有一由SO2和SO3组成的混和气体,测知其硫元素的质量分数为48%,此混和气体中SO2的质量分数为( )
A.20% B.80% C.50% D.40%
[解题思路]: 本题的一般解法需分别设出混和气体中SO2和SO3的质量,然后根据含硫的质量分数解代数式求出SO2和SO3的质量关系.据此可得解。
但此题可用平分法巧解:
SO2中S元素的质量分数为50%,若SO2和SO3各占50%。则混和气体中硫元素的质量分数为50%?40%2=45%。此数值比题设中硫元素48%的质量分数小,由此可见硫元素的质量分数大的SO2在混和气体中的含量必大于50% (答案:B)
例5.某碳氢化合物CxHy式量为26,该化合物5.2g完全燃烧。生成的气体通过浓H2SO4时,浓H2SO4增重了
3.6克。再通过澄清石灰水时,析出40克的白色沉淀,求该碳氢化合物的化学式。
[解题思路]:求碳氢化合物CxHy的化学式,实际是求x,y值。据题目说给条件。浓H2SO4增重是因为产物中有水被浓H2SO4吸收。澄清石灰水析出白色沉淀是因为产物中有CO2。故可以分别从生成H2O和CO2的量求出碳氢化合物中含碳,氢的质量比,原子个数比,再根据题目给出的质量求出化学式。
解:关系式法:设5.2g CxHy中含碳的质量为a,含氢的质量为b
CaCO3 - C H2O - 2H
100 12 18 2
40 a 3.6 b
a=4.8g b=0.4g
碳氢原子个数比 C:H=4.80.4:=1:1=x:y 121
据题知:CxHy式量为26
列方程组:
?x?x?2??1 所以,CxHy的化学式为C2H2 y????12x?y?26?y?2?
练习题:
医药上用的阿司匹林经测定知道,它的成分里含有氢4.5%、氧35.5%、碳60%,其式量为180,设阿司匹林的化学式为CaHbOc,则a=( ),b=( ),c=( )。 (答案:a=9,b=8,c=4)

化学式计算的解题技巧
一、逆向思维 化为基本题型
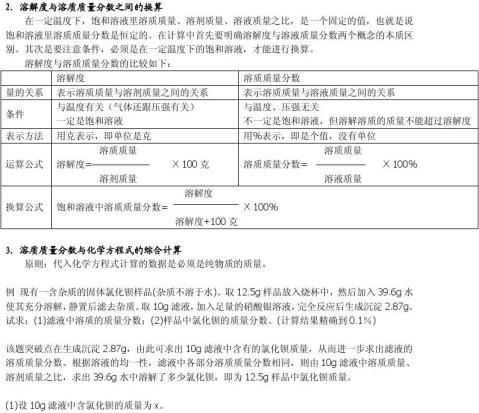
例1 在氮的一种氧化物中氮元素与氧元素的质量比为7∶20,则该氧化物的化学式可能是( )。
(A.)N2O (B)N2O3 (C)NO2 (D)N2O5
分析:若逆向思维,则已知化学式,求各元素质量比,即类型二。可设该氧化物的化学式为NxOy。
14x∶16y=7∶20,解得,x∶y=2∶5。解:选(D)。
例2. 实验室分析某氮的氧化物,已知其中氮元素的质量分数为36.83%,则正确表示这种氮的氧化物的化学式是( )
(A)NO2 (B)NO (C)N2O5 (D)N2O3
分析:若逆向思维,则化为类型三,即已知化学式,求某元素质量分数。因此可设化学式为NxOy。
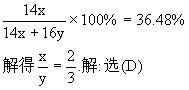
二、稍加增补 靠拢基本题型
例3.用杂质的质量分数为30%的赤铁矿(主要成份为Fe2O3,杂质不含铁)炼铁,若日产120t
铁(假设为纯净的铁),理论上每天至少消耗赤铁矿多少吨?
分析:求Fe2O3中铁元素质量分数是基本题型。在此基础上只需要再理解两点(1)Fe2O3的质量
和铁元素质量分数相乘即得铁元素质量。(2)本题中所给的赤铁矿不纯,必须先打折扣,才成为纯Fe2O3质量。
解:设每天消耗赤铁矿的质量为x。

解之 x=244.9t
三、巧作引申 理清比例关系
例4 当氨肥硝酸铵[NH4NO3]和尿素[CO(NH2)2]所含氮元素质量相同时,它们的质量比是( )
(A)1∶1 (B)8∶3 (C)4∶3 (D)2∶3
分析:若所含氮元素质量相同,则所含氮原子个数相同。根据化学式,NH4NO3与CO(NH2)2中若
所含氮原子个数比为1∶1,则它们的分子个数之比也为1∶1,因此它们的质量比即式量比。解:选(C)。
四、巧算估算 节省解题时间
例5、下列物质中铁元素的质量分数最高的是( )
(A)FeO (B)Fe2O3 (C)Fe3O4 (D)FeS
分析:FeS中S元素的相对原子质量为32,恰为氧的2倍,即可将它看作FeO2,这样四个先项
的差别便在于Fe与O的原子个数之比不同,比值越大,则Fe元素质量分数越大,(A)为1∶1,
(B)为2∶3,(C)为3∶4,(D)为1∶2。解:选(A)。
例6、R、X两元素形成多种化合物在RX中R元素的质量分数为49.7%,则下列化合物中R元
素质量分数大于43%的是( )
(A)RX2 (B)R2X3 (C)R2X (D)R2X5
分析:R、X两元素的原子个数之比越大,R元素的质量分数越大。RX中,R与X原子个数之比
为1∶1,(A)中为1∶2,(B)中为2∶3,(C)中为2∶1,(D)中为2∶5。(C)为最大,R2X中R元素质量分数必大于49.7%,当然也就大于43%。但也可能存在R元素质量分数介于43%与49.7%之间的符合题意的选项,此时可将49.7%近似处理成
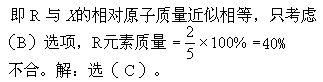
50%
五、极端假设 判断混合物的组成
例7、一包氯化铵(NH4Cl)化肥中,混入了少量某种其它化肥,此包氯化铵化肥中的含氮量为
27.5%,则混入的化肥可能是( )。
(A)CO(NH2)2 (B)(NH4)2SO4
(C)NH4HCO3 (D)KNO3
分析:先假设此包化肥为纯的氯化铵,则其中氮元素的质量分数为26.2%<27.5%,那么混入的杂质中氮元素的质量分数应大于27.5%。解:选(A)。
巧解有关化学式的计算题
相对原子质量:H一1 C-12 O-16 S-32 Fe—56 Cu—64
例题1 某铜矿(主要成分为CuFeS2)中含硫29.75%,该矿中含铜为( )
A、34.78% B、29.75% C、85.53% D、34.5%
解析:由化学式可知,CuFeS2中,两个硫原子的相对质量与一个铜原子的相对质量相等。依题意,含硫29.75%,则含铜与含硫的百分含量相等,故正确选项为B。
小结:等量代换法适用于相对原子质量成倍数的元素的有关计算。
例题2 下列化合物中,碳元素百分含量最高的是( )
A、CH4 B、C2H2 C、C2H6 D、C3H6
解析由化学式可知,它们都是碳氢化合物,其碳 原子与氢原子的个数比分别是1:4、1:1、1:3、1:2,此比值说明与一个碳原子相结合氢原子个数的多少,即氢原子个数越少,碳元素的百分含量越高, 故正确选项为B。
小结:比值法适用于化合物中,所含共同元素的百分含量的大小比较。
例题3 10克一氧化碳(CO)和10克二氧化碳中,所含碳元素的质量是( )
A、相等 B、二氧化碳中多 C、一氧化碳中多 D、无法估计
解析:碳元素质量=化合物质量ⅹ碳元素百分含量。依题意一氧化碳与二氧化碳的质量相等量, 则碳元素质量大小比较就是碳元素百分含量大小的比较,由于一氧化碳的式量小,则可定性判断一氧化碳中碳元素百分含量大,故正确选项为C。
小结:定性判断法适用于等质量的数种物质中,所含共同元素的质量大小的比较。
例题4 (20xx年上海市中考题)在FeO、Fe2O3、Fe3O4三种化合物中,与等质量铁元素相结合的氧元素的质量比为( )
A、6:9:8 B、12:8:9 C、2:3:6 D、1:3:4
解析:由三个化学式可知,铁原子的个数分别为1、2、3,则求得最小公倍数为6,得到如下关系式:6FeO、3Fe2O3、2Fe3O4,即三种化合物中,含有等质量的铁。由题意可知,与等质量铁元素相结合的氧元素的质量比,就是氧原子的个数比,即为6:9:8,故正确选项为A。
小结:最小公倍数法适用于两物质等质量或两物质含有等质量的某元素的相关计算。
例题5 某元素的化合物的化学式为R2O3,其中氧元素的质量百分含量为30%,则R的相对原子质量是( )
A、27 B、23 C、39 D、56
解析:(1)由题意可知,R%=1-30%=70%,则R元素与氧元素的质量比为7:3。
(2)依据题意画出图示分析。请见下图。
(3)列比例式,求得R=56,故正确选项为D。
小结:图解法适用于化合物中,已知元素的质量比或能将百分含量转化成元素质量比的相关计算。
从一道习题谈根据化学方程式计算的常用解法
例:把氯酸钾和二氧化锰的混合物15.5g放入大试管中加热,充分反应后冷却、称量,剩余固体质量为10.7g。剩余固体里有哪些物质?各多少克?(已知相对原子质量:K 39 Cl 35.5 O 16)
解法一:常规法
根据质量守恒定律,氧气的质量为:15.5 g-10.7 g=4.8 g
设:剩余固体中含氯化钾质量为
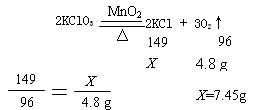
X
二氧化锰的质量为:10.7 g -7.45 g =3.25 g
答:剩余固体中含氯化钾质量为7.45g,二氧化锰的质量为3.25 g。
分析:本题已知反应物(是混合物)的质量,由于是充分反应,反应后的剩余固体里没有氯酸钾,二氧化锰是催化剂,其质量在化学反应前后不变。所以剩余固体里的成分是氯化钾和二氧化锰的混合物。在反应:2KClO32KCl + 3O2↑中,根据质量守恒定律,反应前KClO3与反应后KCl质量之差等于氧气的质量。然后根据氧气质量计算氯化钾的质量,最后求二氧化锰的质量(切忌:列比例求二氧化锰质量)。
特点:已知一种生成物质量或一种参加反应的反应物质量,代入化学方程式列比例即可求出化学方程式中另外所有反应物或生成物的质量。
解法二:量差法
设:剩余固体中含氯化钾质量为

X
二氧化锰的质量为:10.7g -7.45g =3.25g
答:剩余固体中含氯化钾质量为7.45g,二氧化锰的质量为3.25g。
分析:先找准反应前后固体质量之差等于氧气质量。将其相对分子质量列在△m(表示某一反应前后同一种状态质量的改变量)正下方,然后将本题反应前固体15.5g与反应后固体10.7g之差代入,即可求出化学方程式中另外所有反应物或生成物的质量。
特点:已知化学反应前后某一种状态(指固、液或气三态)质量的改变量,先找准化学方程式里这种状态的改变量,然后代入本题这种状态的改变量,列比例即可求出化学方程式中另外所有反应物或生成物的质量。
解法三:关系式法
根据质量守恒定律,氧气的质量为:15.5 g-10.7 g=4.8 g
设:剩余固体中含氯化钾质量为X
2KCl~3O2↑
149 96
X 4.8 g
二氧化锰的质量为:10.7g -7.45g =3.25g
答:剩余固体中含氯化钾质量为7.45 g,二氧化锰的质量为3.25 g。
分析:由方程式已知量(O2)和未知量(KCl)的关系式为:2KCl~3O2↑,本题将已知量氧气代入,列比例即可求出未知量氯化钾的质量。关系式省去了化学方程式中无关物质的质量,使得运算过程得以简化。
特点:找准题目中已知量和未知量之间的关系式。特别要注意化学式前的化学计量数,其数值由化学方程式来确定。关系式法常常用于多步反应的计算。
解法四:元素守恒法
设:剩余固体中含氯化钾质量为X
参加反应的氯酸钾质量为y
由化学方程式:2KClO3 2KCl + 3O2↑知:
根据质量守恒定律,氧气的质量为:15.5g-10.7g=4.8g
根据氧元素质量守恒: y·=4.8g
y=12.25g
根据钾元素质量守恒: 12.25g×=X·
X=7.45g
二氧化锰的质量为:10.7g -7.45g =3.25g
答:剩余固体中含氯化钾质量为7.45g,二氧化锰的质量为3.25g
分析:本题已知氧气的质量,根据KClO3和O2中氧元素质量的相等关系,可求出KClO3质量,再根据KClO3 和KCl中钾元素(或氯元素)质量的相等关系,可求出KCl的质量,最后算出MnO2的质量。
特点:找准化学反应前后化学式中某一种元素质量的相等关系。由于省略无关的化学式和一些元素,使得计算过程大大化简。对于一些较复杂的化学方程式的计算,运用该法显得特别简单。它适用于一切化学反应的计算。
