华 南 师 范 大 学 实 验 报 告
学生姓名 学 号
专 业 年级、班级
课程名称 物理化学实验 实验项目 原电池电动势的测定与应用
实验类型 □验证 □设计 ■综合 实验时间 年 月 日
实验指导老师 实验评分
[实验目的]
1、 掌握电位差计的测定原理和原电池电动势的测定方法。
2、 加深对可逆电极、可逆电池、盐桥等概念的理解。
3、 测定电池在不同的温度下的电动势,计算电池反应的热力学函数△G、△H和△S。
[实验原理]
1、对消法测定原电池电动势
(1)电池的电动势不能直接用伏特计来测量,因为电池与伏特计相接后,便成了通路,有电流通过,发生化学变化、电极被极化、溶液浓度改变、电池电势不能保持稳定。且电池本身有内阻,伏特计所量得的电位降不等于电池的电动势。
利用对消法(又叫补偿法)可是我们在电池无电流(或极小电流)通过时,测得其二级的静态电势,这时的电位降即为该电池的平衡电势,此时电池反应是在接近可逆条件下进行的。因此,对消法测电池电势的过程是一个趋近可逆过程的例子。
(2)电池电动势测定原理:
Hg | Hg2Cl2(s) | KCl(饱和) | | AgNO3 (0.02 mol/L) | Ag
根据电极电位的能斯特公式,正极银电极的电极电位:
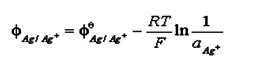
其中 =0.799-0.00097(t-25)
=0.799-0.00097(t-25)
负极饱和甘汞电极电位因其氯离子浓度在一定温度下是个定值,故其电极电位只与温度有关,其关系式:
φ饱和甘汞= 0.2415 - 0.00065(t–25)
而电池电动势 E=φ+-φ-;可以算出该电池电动势的理论值。与测定值比较即可。
2、电动势法测定化学反应的△G、△H和△S
如果原电池内进行的化学反应是可逆的,且电池在可逆条件下工作,则此电池反应在定温定压下的吉布斯函数变化△G和电池的电动势E有以下关系式:
△G=-nFE
从热力学可知: △S=-nF(E1-E2)/(T1-T2)
△H=-nFE+△S
[仪器与试剂]
(1)实验仪器
SDC数字电位差计 1台 饱和甘汞电极 1支
银电极 1支 20mL小烧杯 2个
超级恒温槽 1台 250mL 烧杯 1个
U 形管 1个
(2)实验试剂
0.1mol/L AgNO3溶液 饱和氯化钾溶液 硝酸钾 琼脂 去离子水
[实验步骤]
1、制备盐桥
3%琼脂-饱和硝酸钾盐桥的制备方法:在 250mL 烧杯中,加入 100mL 蒸馏水和3g琼脂,盖上表面皿,放在石棉网上用小火加热至近沸,继续加热至琼脂完全溶解。然后加入 40g 硝酸钾,充分搅拌使硝酸钾完全溶解后,趁热用滴管将它灌入干净的 U 形管中,两端要装满,中间不能有气泡,静置待琼脂凝固后便可使用。制备好的盐桥不使用时应浸入饱和硝酸钾溶液中,防止盐桥干涸。
2、组合电池
将饱和甘汞电极插入装有饱和硝酸钾溶液的广口瓶中。取一个 20mL 小烧杯洗净后,用数毫升 0.02mol/L 的硝酸银溶液连同银电极一起淌洗,然后装此溶液至烧杯的2/3 处,插入银电极,用硝酸钾盐桥不饱和甘汞电极连接构成电池。
3、测定电池的电动势
(1)正确接好测量电池的线路。电池不电位差计连接时应注意极性。盐桥的两支管应标号,让标负号的一端始终不含氯离子的溶液接触。仪器要注意摆布合理并便于操作。
(2)使用对消法测室温下该原电池电动势,平行测量3次,记录数据。
(3) 调节恒温槽至温度35℃,将原电池小心转移至恒温槽内,待温度稳定后进行测量,平行测量3次,记录数据。
(4)测量完毕后,倒去两个小烧杯的溶液,洗净烧杯的溶液。盐桥两端淋洗后,浸入硝酸钾溶液中保存,将其他仪器整理好,恢复到前的状态。
[数据记录与处理]
1、记录数据
室温:24.4℃ 大气压:101.06kPa 水浴恒温:38.0℃
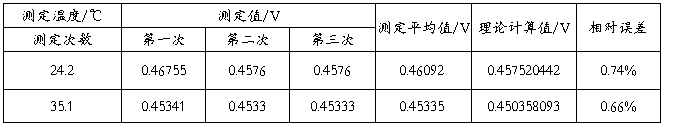
2、原电池的热力学计算
△G=-nFE=-44471.31413J/mol
△S=-nF(E1-E2)/(T1-T2)=-67.00804266 J/(mol?K)
△H=-nFE+T△S=-64396.15561 J/mol
3、将实验所得的电池反应的热力学函数变化值和理论值进行比较
查参考文献得Ag+(aq)、Cl-(aq)、AgCl(c) 各自的的标准生成焓变ΔfHºm、标准生成自由能变ΔfGºm及标准熵Sºm,由此计算出电池反应的ΔfHºm、ΔfGºm、ΔfSºm如下所示
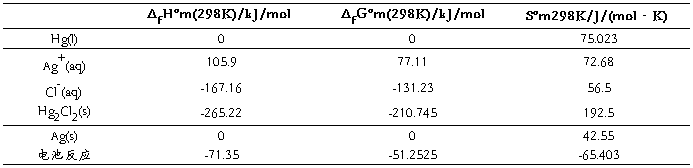
与理论值对比可得
ΔrSºm 相对误差2.45%
ΔrGºm 相对误差-13.23%
ΔrHºm 相对误差-9.75%
[实验结果与讨论]
本实验采用对消法测定原电池电动势,相对误差均在1%以下,说明实验方法可行,操作性与重复性均可,取得了较好的结果。
但在通过测定电池在不同的温度下的电动势,计算电池反应的热力学函数△G、△H和△S时,结果并不理想。实验结果与参考值有较大出入,ΔrSºm 、ΔrGºm 、ΔrHºm 相对误差较大,可能是由于以下原因所造成的:
1、由于时间以及设备的限制,实验只进行了两组不同温度的数据测量,使用的热力学计算方法均为粗略计算,并未使用偏微分作图的方法求出ΔrSºm 、ΔrHºm(只有两组数据无法完整表示线性关系),数据处理方法粗略,计算结果也相对误差较大。这是实验的系统误差,要克服该误差,只能进行更多组不同温度的测定,绘出δE/δT的关系图,拟合线性,求出斜率,才能较好的减少误差。
2、在实际测量的过程中难以找到平衡点,因此在原电池中无可避免地会有少量电流经过,而产生极化现象,当外加电压大于电动势时,原电池相当于电解池,使反应电势增加;相反,当外电压小于电动势时,原电池放电极化,使反应电势降低。影响实验结果的测定。而且有少量电流也会使内阻分走部分电压,导致测量电压并不等于电动势而等于外电路电压。
3、本实验测定的并不是可逆电池,但在溶液间插入了盐桥,近似地当作可逆电池来处理。通常。常用的盐桥是氯化钾盐桥,离子相对迁移速率较为一致。但对于硝酸银溶液,不能使用氯化钾盐桥,而是采用了硝酸钾盐桥。虽然硝酸盐盐桥的正负离子迁移数较接近,但是它们与通电极无共同离子,因而在使用时会改变参考电极的浓度和引入外来离子,从而可能改变参考电极电位,造成实验误差。
本实验通过测定电池在不同的温度下的电动势,计算电池反应的热力学函数△G、△H和△S。,相比于之前使用过的量热法,该方法有明显的优点:操作简便,安全可重复性强,而且测量准确度高。只要正确使用完整的数据处理方法,比量热法优越可行。
[思考题]
1、 为何测电动势要用对消法?对消法的原理是什么?
答:电池电动势不能用伏安法直接测量,因为电池与伏特计连接后有电流通过,就会在电极上发生极化,结果使电极偏离平衡状态。另外,电池本身有内阻,所以伏特计测得的只是不可逆电池的端电压。而测量可逆电池的电动势,只能在无电流通过电池的情况下进行,因此,采用对消法。
对消法是在待测电池上并联一个大小相等、方向相反的外加电源,这样待测电池中没有电流通过,外加电源的大小即等于待测电池的电动势。
2、测电动势为何要用盐桥?如何选用盐桥以适合不同的体系?
答:(1)对于双液电池电动势的测定需用盐桥消除液体接界电势。
(2)选择盐桥中电解质的要求是:①高浓度(通常是饱和溶液);②电解质正、负离子的迁移速率接近相等;③不与电池中的溶液发生反应。 具体选择时应防止盐桥中离子与原电池溶液中的物质发生反应。
3、 对消法测定电池电动势的装置中,电位差计,工作电池,标准电池及检流计各起什么作
用?为什么要用对消法进行测量?
(1)电位差计:利用补偿法测定被测电极电动势;
标准电池:提供稳定的已知数值的电动势EN,以此电动势来计算未知电池电动势。
检流计:指示通过电路的电流是否为零;
工作电池:为整个电路提供电源,其值不应小于标准电池或待测电池的值。
(2)利用对消法(即补偿法)可以使电池在无电流(或极微弱电流)通过的条件下测得两极间的电势差,这时电池反应是在接近可逆条件下进行的,这一电势差即为该电池的平衡电动势。
[参考文献]
[1] ]何广平,南俊民,孙艳辉等.《物理化学实验》[M].华南师范大学化学实验教学中心,化学工业出版社,2007.
[2]傅献彩,沈文霞,姚天扬等.《物理化学·下册》[M].北京:高等教育出版社,2006,1
第二篇:电动势法测定化学反应的热力学函数值
电动势法测定化学反应的?rGm, ?rHm, ?rSm
一实验目的及要求
(1)学习电动势的测量方法;(2)掌握用电动势法测定化学反应热力学函数值的原理和方法。
二实验原理
1本实验采用对消法测量电池的平衡电动势, 在待测电池上并联一个反向的外加电势, 调节回路使得通过待测电池的电流趋近于零, 测量待测电池的电动势。改变实验温度, 测量不同温度下电池的电动势, 求出电池电动势与温度的关系, 据此计算电池反应的热力学函数。
2电池反应热力学函数?rGm、?rHm、?rSm的计算
恒温、恒压下、可逆条件下, ?rGm = -nFE,
由吉布斯自由能的定义式, 在恒温条件下有下式:
?rSm = nF(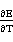 )p; ?rHm = ?rGm + T ?rSm; ?rHm=-nEF+nTF(
)p; ?rHm = ?rGm + T ?rSm; ?rHm=-nEF+nTF(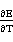 )p
)p
式中, (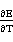 )p称为电池的温度系数。
)p称为电池的温度系数。
3实验中的电池反应式
2Hg+2Cl--2e-=Hg2Cl2; C6H4O2+2H++2e-=C6H4(OH)2 ,测得该电池的温度系数,便可计算电池反应的?rGm, ?rHm, ?rSm。
三实验仪器与试剂
恒温槽,电子电位差计,双层三口瓶,铂电极,温度计,饱和甘汞电极,柠檬酸溶液,KCl,硼氢化钠溶液,醌氢醌
四实验操作
1 打开恒温槽,调节温度比室温高2~3℃
2 组合电池:取0.003mol硼氢化钠(1.07g),0.003mol柠檬酸(0.63g),加50ml水溶解,再用少量多次的方式加入醌氢醌至饱和。搅拌均匀后,装入可通恒温水的双层三口瓶中,插入铂电极和饱和甘汞电极(还有温度计),组成电池。
3 恒温20分钟,用电位差计测量该电池的电动势,测量几次,各次测量差应小于0.0002V,取三次以上测量的平均值。
4改变实验温度,每次升高2~3℃,重复第3步。
5测五个不同温度下的电动势
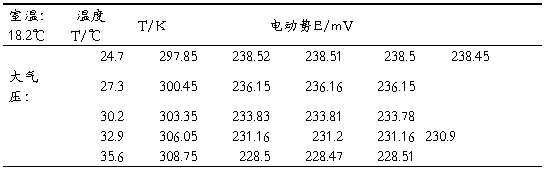
五实验数据记录
六实验数据处理及误差分析
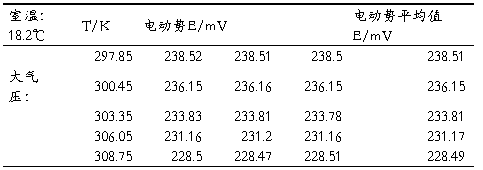
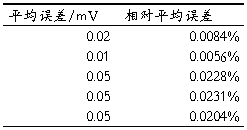
 Xe’=230.9
Xe’=230.9
极差R=231.2-230.9=0.3
t1=(231.09-230.9)/0.3=0.6333<t1表(见课本P7)=1.53
按表不用舍弃,但操作中要求测定之差小于0.0002V,所以舍去。
Xe=231.2
极差R=231.2-231.16=0.04
t1=(231.2-231.16)/0.04=1<t1表(见课本P7)=1.53
所以不用舍弃。
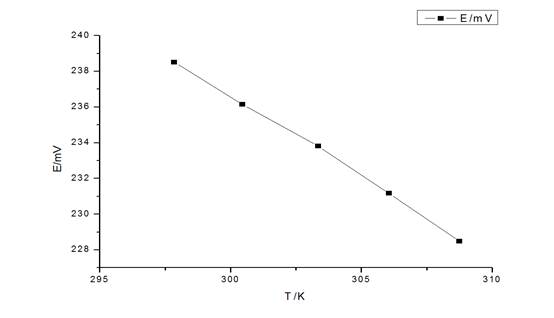
由图得,当T=298K时,斜率k约为-0.912(mV/K)。
根据线性回归方程Y=-0.912x + 510.4,得
当T=298K时,E=238.624mV
由?rGm=-nEF=-2*238.624*0.001*9.648456=-4.60471KJ/mol
?rHm=-nEF+nTF(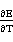 )p=-2*238.624*0.001*9.648456+2*298*9.648456*(-0.912)*0.001
)p=-2*238.624*0.001*9.648456+2*298*9.648456*(-0.912)*0.001
=-9.8491439KJ/mol
?rSm=nF(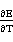 )p=2*9.648456*(-0.912)*0.001=-0.017599KJ/K.mol=-17.599J/K.mol
)p=2*9.648456*(-0.912)*0.001=-0.017599KJ/K.mol=-17.599J/K.mol
七误差分析
用对差法测电动势时,要求电流为0,但调节时电路中总有微小电流通过。当电路中存在电流时,溶液浓度会产生变化,且电池存在内阻,会使所测电动势较真实值偏低。但电流很小,此误差基本可忽略。因此除实验器材的系统误差外,本实验无明显误差。
八问题回答
1因为用来计算热力学函数的公式应用条件为可逆反应
2可逆,氧化还原反应,放热。
