电池电动势及温度系数的测定
一.实验目的:
(1)掌握可逆电池电动势的测量原理和电位差计的操作。
(2)通过原电池电动势的测定求算电池反应的ΔrGm、ΔrSm、ΔrHm等热力学函数。
(3)熟悉原电池的图式表示法和电极、电池反应的书写。
二.实验原理:
1.热力学基础
化学能转变为电能的装置称为原电池或电池。可逆电池的电动势可看作正、负两个电极的电势之差。
可逆电动势为E的电池按指定电池反应式,当反应进度ξ=1mol时,反应
的吉布斯函数变为:
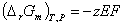 (1)
(1)
式中E为可逆电池的电动势,单位为伏特(V);F为法拉第常数,常取96500 C·mol-1,z为电极反应式中电子的化学计量数,ΔrGm的单位为J·mol-1。
所以,在一定的温度和压力下,测出可逆电池的电动势,即可计算出电池反应的摩尔反应吉布斯函数变ΔrGm。又根据热力学基本方程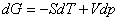 ,可以得到:
,可以得到:
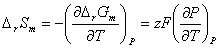 (2)
(2)
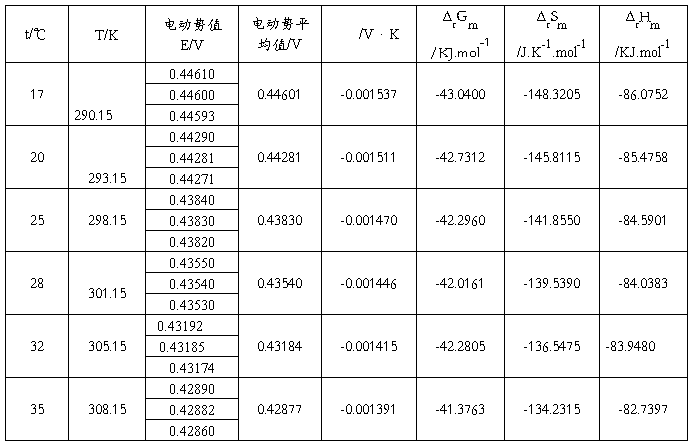
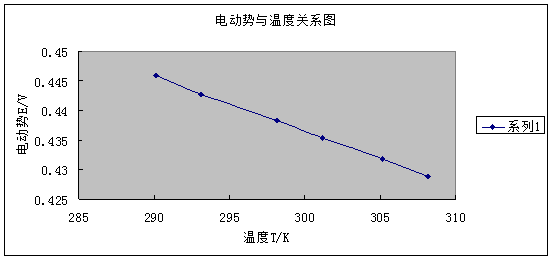
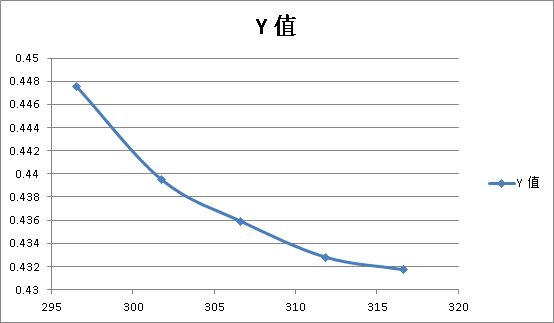
式中 称为电池的温度系数,表示电池电动势随温度的变化。在系列温度下测得系列电动势值,作E—T图,从曲线斜率可求得电池的温度系数。进而算出ΔrSm 。
称为电池的温度系数,表示电池电动势随温度的变化。在系列温度下测得系列电动势值,作E—T图,从曲线斜率可求得电池的温度系数。进而算出ΔrSm 。
由吉布斯-亥姆霍兹公式可计算化学反应的摩尔反应焓,即:
 (3)
(3)
2.对消法测定电动势的原理
根据可逆过程的定义,可逆电池应满足如下条件:
(1)电池反应可逆,亦即电池电极反应可逆。(2)电池中不允许存在任何不可逆的液体接界。
(3)将选择开关SW接 上,调节活动触点的位置至D1时检流计G中没有电流通过,此时标准电池的电动势正好与AD1线段所示的电势差的数值相等而方向相反。即:
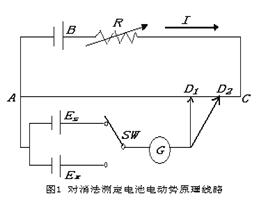
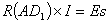 (4)
(4)
完成上述标定后,将SW拨到待测电池Ex上,重新调节接触点,若调到D2位置时检流计G中无电流通过,则AD2线段上的电势降等于待测电池Ex的电动势,即:
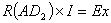 (5)
(5)
由(4)式和(5)式,得:
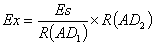 (6)
(6)
由于电阻与电阻线长度l成正比,所以:
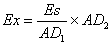 (7)
(7)
分别读出Es和Ex接通时均匀电阻上的AD1、AD2长度,即可计算出Ex。
本实验测定由AgCl Ag和Ag+/Ag电对组成的原电池的电动势,该电池可以用图示式表示为:
(-) Ag|AgCl(s), Cl - (0.1mol·L-1)| |Ag+ (0.1mol·L-1)|Ag (+)
即AgCl/ Ag作为阳极(负极),浸入含Cl -的溶液中,电极反应为:
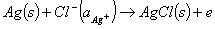 (8)
(8)
Ag+/Ag作为阴极(正极),浸入含Ag+的溶液中,电极反应为:
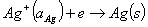 (9)
(9)
总的电池反应为:
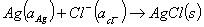 (10)
(10)
电池中用到两种不同的溶液,需通过盐桥连接。
电池电动势的Nernst方程式为:
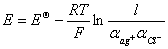 (11)
(11)
三.实验仪器试剂
器材:SDC-II数字电位差综合测试仪,恒温水浴,原电池装置,AgCl/ Ag电极,Ag电极,盐桥。
药品:0.1mol·L-1 NaCl溶液,0.1mol·L-1 AgNO3溶液。
四.实验步骤:
1.组装电池:将AgCl/ Ag电极(负极)插入原电池装置的NaCl溶液中,Ag电极(正极)插入AgNO3溶液中,装入盐桥,将电池与电位差计相接,注意正负极要对应。将电池放入到恒温水浴中。
2.电位差计采零
将电位差计“测量选择”钮打到“内标”,调节各电位钮,使电位指示为1V,然后按一下“采零”钮,使“检零指示”为“0”。
电位差计的详细操作见仪器说明。
3.原电池电动势的测量
待电池中溶液的温度稳定后(约需10~15分钟),可以测量其电动势。
将电位差计“测量选择”钮打到“测量”,调节各电位钮,直到“检零指示”为0,此时电位指示值就是该温度下的电池电动势,每个温度下读三次,每次间隔1~2分钟。在25℃下,待测电池的电动势约为0.45V,调节时可参考此值。第一次测量可以控制恒温槽温度比室温高1~2℃,此后每次升温3~5℃,共测5~6次。注意测量温度不应高于50℃。
五.数据处理:
 六.注意事项:
六.注意事项:
(1) 盐桥内不能有气泡存在,不能拿着盐桥将电池放入或取出水浴。
(2) 恒温水浴液面高度要合适,与电池内的液面处于一个水平面即可。
(3) 在升温的时候,不应使“仪器测量选择”按钮处于“测量”档(如果可以关闭仪器或打到“外标”档)。
七.思考题:
1.对效法测定原电池电动势的原理是什么?电池电动势为什么不能用伏特计直接准确测定?
答:原理将电源的正极与待测电池正极,负极与负极相连,串联一个保护电阻和一个检流计.调可读电源的输出电压至检流计指针不在偏转,此时待测电压与可读电压的值相等。因为对电的测定需灵敏度更高的电流表,如果用伏特计直接则不能准确的测定因为它的灵敏度不高。只能测定一般的电动势。
2.盐桥的选择原则和作用是什么?
答:1.在两种溶液之间插入盐桥以代替原来的两种溶液的直接接触,减免和稳定液接电位(当组成或活度不同的两种电解质接触时,在溶液接界处由于正负离子扩散通过界面的离子迁移速度不同造成正负电荷分离而形成双电层,这样产生的电位差称为液体接界扩散电位,简称液接电位),使液接电位减至最小以致接近消除.2.防止试液中的有害离子扩散到参比电极的内盐桥溶液中影响其电极电位。
原则:在精确度不高的测量下,常用正负离子迁移数比较接近的盐类(应不与电解质发生反应)构成盐桥。
3.可逆电池的条件是什么?测定过程中如何尽可能地减小极化现象的发生?
答:不仅要求电极反应具有热力学上的可逆性,而且反应在无限接近电化学平衡的条件下进行,此外电池中进行的其他可逆过程必须是可逆的。
4.如何由电动势的测定求AgCl的溶度积KSP?
答: 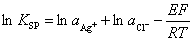
已知aAg+、aCl-,测得电池动势E,即可求KSP
第二篇:电池电动势及温度系数的测定
电池电动势及温度系数的测定
一. 实验目的
1. 掌握可逆电池电动势的测量原理和电位差计的操作.
2. 通过原电池电动势的测定求算电池反应的△rGm,△rSm,△rHm等热力学函数。
3. 熟悉原电池的图式表示法和电极,电池反应的书写。
二.实验原理
1.热力学基础
化学能转变为电能的装置称为原电池或电池,可逆电池的电动势可看做正负两个电极的电势之差。
根据吉布斯函数的定义,在恒温恒压条件下,当系统发生可逆变化时,系统吉布斯函数变等于过程的可逆非体积功。
当反应进度§=1mol时,吉布斯函数变为:
(△rGm)T,P=-ZEF
E为电动势,V;F为法拉第常数,常取96500C·mol-1,z为电极反应式中电子的化学计量数。
又根dG=-SdT+Vdp,可以得到:
△rSm=zF(E/T)P
在系列温度下测得电池的电动势值,作E-T图,由曲线斜率可求得电池在某一温度下的温度系数。
由△rHm=△rGm+T△rSm
2.对消法测定电动势的原理
由可逆过程的定义,可逆电池应满足:
(1).电池反应可逆,即电池电极反应可逆
(2).电池中不允许存在任何不可逆的液体接界。
(3).电池必须在可逆下工作
不能直接用伏特计来测量可逆电池的电动势。
对消法是在待测电池EX上并联一个大小相等,方向相反的外加电势。
有R(AD1)*I=ES
完成上述标定后有R(AD1)*I=EX
由上两式得EX=ES/R(AD1)×R(AD2)
由于电阻与电阻线长度成正比,则EX=ES/AD1*AD2
4. 本实验测定的电池
本实验测定由AgCl/Ag和Ag+/Ag电对组成的原电池的电动势,可表示为
(-)Ag|AgCl(s)|Cl-(0.1mol/L)||Ag+(0.1mol/L)|Ag(+)
即AgCl/Ag作为阳极,浸入含cl-的溶液中
Ag(s)+Cl-1(@cl)→AgCl(s)+e
Ag+/Ag作为阴极
Ag+(@Ag)+e→Ag(s)
电池要用两种不同的溶液,要用盐桥,电池电动势的Nernst方程式为
E=E标-RT/Fln1/@Ag@cl
三.仪器和试剂
电位差综合测试仪,恒温水浴,原电池装置,AgCl/Ag电极,Ag电极,盐桥,0.1mol/lNacl溶液,0.1mol/lAgNO3溶液
四.实验步骤
1.组装电池
AgCl/Ag作为阳极,浸入含cl-的溶液中,Ag+/Ag作为阴极,电池要用两种不同的溶液,要用盐桥,盐桥易断,将电池放到恒温水浴中
2.电位差计采零
将电位差计“测量选择”钮打到“内标”,调节各电位钮,使电位指示为1V,在按“采零”,使“检零指示”为0
3.原电池电动势的测量
待温度稳定后,再测电动势
打到“测量”钮,直到检零指示为0,每个温度下读3次,每次间隔1到2分钟,
此后每次升温3到5℃,重复上述5到6次
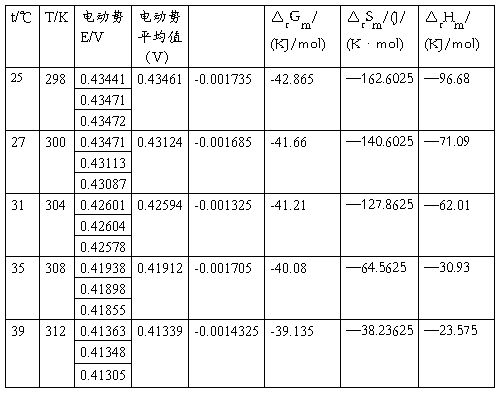
五.数据处理
根据不同温度下测得的E值,作图,求出斜率
求出对应电池反应的△rGm ,△rSm,△rHm
(△rGm)T,P=-ZEF
△rHm=△rGm+T△rSm
△rSm=zF( E/ T)P
六.注意事项
1.盐桥内不能有气泡存在,不能拿着盐桥将电池放入或取出水浴。
2.恒温水浴液面高度要合适
3.升温时,不要处在“测量”档
七.思考题
1.答:将电池正极连正极,负极联负极,串联一个保护电阻和一个检流计,调可读电源的输出电压至检流计指针不在偏转。因为要灵敏度高的电流表,而伏特计的灵敏度不高。
2.答:要用正负离子迁移数比较接近的盐类,盐桥是代替两种液体的直接接触,使液接电位减至最小,也防止有害离子的扩散影响电极电位。
3.答:要求电极反应具有热力学上的可逆性,而且反应无限接近电化学平衡的条件下进行,此外电池中进行的其他可逆过程必须是可逆的。
4.答:因为有lnKsp=lnaAg-+lnacl—EF/RT,如果知道aAg+.acl-,则可测得电池电动势E,即可求出Ksp.
