高中化学必修2实验计划
第一章 物质结构元素周期律
探究实验一 同主族元素性质的递变规律
实验目标:认识碱金属元素性质的递变性,认识卤族元素性质的递变性
实验器材:酒精灯 坩埚 铁三脚架 泥三角 培养皿 小刀 火柴 滤纸 试管若干支 实验试剂:金属钾 新制的饱和氯水 NaBr溶液 KI溶液 溴水
探究实验二 同周期元素性质的递变规律(学生实验)
实验目标:通过实验,探究同周期元素性质的递变规律(从左到右,金属性逐渐减弱,非金属性逐渐增强)
实验器材:试管 试管夹 试管架 胶头滴管 酒精灯 镊子 锥形瓶(100mL) 培养皿 实验试剂:金属钠 镁条 NaCl溶液 MgCl2溶液 NaOH溶液(1mol/L) AlCl3溶液 稀盐酸(0.5mol/L) 酚酞试液 MgO粉末 P2O5固体 石蕊
第二章 化学反应与能量
探究实验三 化学反应中的热量变化
实验目标:认识放热和吸热反应;认识化学反应中的热量变化
实验器材:试管 研钵 烧杯 玻璃片 玻璃棒 量筒
实验试剂:6mol/L盐酸 铝条 Ba(OH)2·8H2O晶体 NH4Cl晶体 50mL烧杯 2mol/L
盐酸 2mol/LNaOH溶液
探究实验四 化学能与电能的相互转化
实验目标: 理解原电池的原理,探究构成原电池的条件
实验器材: 烧杯 镊子 导线 灵敏电流表 金属夹 手电筒 手电筒用小灯泡 实验试剂:稀硫酸 铜片 锌片 铁片 碳棒 果汁 硫酸铜溶液
探究实验五 化学反应的速率和限度
实验目标: 加深温度、催化剂、浓度等条件对化学反应速率的影响的理解 实验器材: 试管 烧杯 量筒 滴管 温度计 药匙 酒精灯
实验试剂:
5%H2O2溶液 1mol/LFeCl3溶液 5℃左右冷水 40℃左右热水 MnO2粉末 大理
石颗粒 1mol/L盐酸 0.1mol/L盐酸 1mol/LCaCl2溶液 1mol/LNa2SO4溶液 1mol/LNa2CO3溶液
铁粉 铁片 火柴 木条
第三章 有机化合物
探究实验六 甲烷的制取和性质
实验目标: 了解实验室制取甲烷的方法,练习实验仪器的连接;探究甲烷气体的性质
实验器材:
酒精灯 铁架台 试管 带导管的单孔胶塞 水槽 玻璃棒 药匙 烧杯 黑纸 带尖嘴的导管
实验试剂:
无水醋酸钠 干燥的碱石灰 KMnO4酸性溶液 稀溴水 澄清石灰水 KMnO4固体 浓盐酸
探究实验七 乙烯的制取和性质
实验目标: 学习从石油中获得乙烯的方法,认识乙烯的可燃性和还原性,加成反应
实验器材: 铁架台 酒精灯 硬质 试管 胶塞 导管 水槽 石棉
实验试剂: 石蜡油 酸性高锰酸钾溶液 溴的CCl4溶液 碎瓷片
探究实验八 探究苯的性质
实验目标: 苯是否使溴水和酸性高锰酸钾溶液褪色
实验器材: 试管
实验试剂: 苯 溴水 酸性高锰酸钾溶液
探究实验九 乙醇的化学性质
实验目标: 认识乙醇与金属钠的反应,乙醇的催化氧化反应
实验器材: 试管 针头 单孔塞 小烧杯 酒精灯 镊子 玻璃片 小刀 滤纸 实验试剂: 乙醇 金属钠 铜丝 澄清石灰水
探究实验十 乙酸的化学性质
实验目标: 实验探究乙酸的酸性和乙酸乙酯的制备方法
实验器材: 分液漏斗 平底烧瓶 试管 酒精灯 量筒 带铁夹的铁架台 双孔胶塞 导管 胶管 石棉网 三角架 碎瓷片 玻璃棒 玻璃片 pH试纸
实验试剂: 0.1mol/L醋酸溶液 CaCO3 澄清石灰水 乙酸 乙醇 浓硫酸 饱和Na2CO3溶液 稀硫酸(1:5) 30%NaOH溶液 蒸馏水 Zn粒
探究实验十一 糖类 油脂 蛋白质的性质
实验目标: 认识葡萄糖、淀粉、蛋白质的特征反应;认识蔗糖的水解 实验器材: 试管、试管夹、蒸发皿、酒精灯、铁架台、石棉网、烧杯 实验试剂:葡萄糖 硫酸铜溶液 NaOH溶液 浓HNO3 稀H2SO4 Cu(OH)2 蔗糖 稀碘酒溶液
其他:土豆 面包 鸡皮
第四章 化学与自然资源的开发利用
探究实验十二 铝热反应
实验目标: 学习铝热反应,理解冶炼的方法
实验器材: 铁架台 蒸发皿 铁圈 滤纸
实验试剂:Fe2O3粉末 铝粉 镁粉
其 他:沙子 木条
第二篇:高中化学必修一1.2化学计量在实验中的应用学案
【统一编号1.2.1】 化学计量在实验中的应用 (课时1)
【学习目标】
1、了解物质的量及其单位
2、理解阿伏加德罗常熟的涵义
3、掌握物质的量与微粒数目之间的简单换算关系
【学习重点难点】
重点:物质的量及其单位的理解
难点:物质的量与微粒数目之间的换算
【学习过程】
【思考】
大米为何要成袋销售,而不用米粒数来计量?火柴为什么要成盒销售,而不论根?
一、物质的量的单位——摩尔
1、定义:物质的量是一个__________,它表示含有___________________的_______。
符号:_________,单位:_________单位符号:________
问题: (1)物质的量能否称为物质量或物质的质量?为什么?
(2)使用摩尔时,为什么必须指明基本粒子或其组合?
(3)计算微粒的基准是什么?1mol粒子数目是多少呢?
附表:国际单位制的(SI)7个基本单位

2、阿伏伽德罗常数
定义:把_______任何粒子的________叫做阿伏伽德罗常数
符号:______,单位:_________ 数值:_____________
3、物质的量( ),阿伏伽德罗常数( ),和粒子数( )之间的关系表达式为:
使用物质的量的注意事项:
(1)作为物质的量的单位,mol仅能计量________,如_______、______、_______、_______
_____、________、________等,不能用于计量宏观物质。
(2)使用时应用_________指明粒子的种类,
如1摩尔氢原子___________,1摩尔氢气_________,0.5摩尔氢离子__________
练习:
(1)、1mol H2O中含有多少个H2O分子?多少个H原子?多少个O原子?
(2)2mol H2SO4分子中,含有多少个H2SO4分子?多少mol H原子?
(3)1.204×1024个O2分子,是多少mol的O2?含有多少mol的O原子?
结论:
【知识检测】
1、0.1molH2中,含有( )mol H;
1mol CH4中,含有( )mol C ;( )g H;
3.01×1023个H2O中,含有( )g H2O;( )mol O
2、判断下列表述是否正确,并说明理由
(1)1mol氮。
(2)0.5mol CO2
(3)摩尔是7个基本物理量之一。
(4)0.5mol H2含有3.01×1023个氢原子
(5)3mol NH3中含有3molN原子,9mol H原子
【统一编号1.2.2】 化学计量在实验中的应用 (课时2)
【学习目标】
1、了解摩尔质量及其单位
2、掌握物质的量与物质的质量之间的简单换算关系
【学习重点难点】
重点:摩尔质量及其单位的理解
难点:物质的量,物质的质量与微粒数目之间的换算
【学习过程】
思考感悟:1mol物质的质量有多少g?1mol物质的体积有多少?
3、摩尔质量
定义:单位___________的物质所具有的_____
符号:_______,单位:______
练习:填写下列空白:
1mol Cu质量是( )g,约含有( )个铜原子
1molO2质量是( )g,约含有( )个氧气分子
1molCO2质量是( )g,约含有( )个二氧化碳分子
1mol Cl—质量是( )g,约含有( )个氯离子
1mol NaCl质量是( )g,约含有( )个钠离子,( )个氯离子
讨论 1mol物质的质量在数值上有什么特点
练习:填写下列空白
Mg的摩尔质量为( )
N2的摩尔质量为( )
H2O的摩尔质量为( )
Na2CO3的摩尔质量为( )
SO42—的摩尔质量为( )
物质的量( )摩尔质量( )与质量( )之间的关系
4、计算下列问题
(1)H2O的摩尔质量是多少?
(2)2mol H2SO4的摩尔质量是多少?
(3)下列物质各多少克?含粒子数多少个?
20mol H2O 0.5mol OH—
(4)下列物质的物质的量是多少?含有多少个粒子?
72g水 84g氮气
(5)19.6g H2SO4中,氧元素的质量是多少克?
(6)24.5g H2SO4的物质的量是多少?1.50mol Na2CO3的质量是多少?
【知识检测】
S1、下列关于摩尔的说法中正确的是( )
A、摩尔只适用于分子、原子和离子
B、摩尔是物质的数量单位
C、摩尔是一个基本物理量
D、摩尔是物质的量的单位
SS2下列叙述不正确的是( )
A、摩尔质量的常用单位为g/mol
B、阿伏伽德罗常熟约为6.02x1023mol-1
C、二氧化硫的摩尔质量为64g/mol
D、摩尔质量就是相对原子质量的6.02x1023倍
SS3NA为阿伏伽德罗常数的数值,下列说法中错误的是( )
A、4.6g金属钠变成Na+,失去的电子数为0.2NA
B、117gNaCl中所含Cl—数为NA
C、17g NH3中所含电子数为10NA
D、9.5g MgCl2溶于水所得溶液中含Cl—数为0.2NA
【统一学案1.2.3】化学计量在实验中的应用(课时3)
【学习目标】
1、了解气体摩尔体积的涵义
2、掌握物质的量,气体摩尔体积,与气体体积之间的换算关系
【重点难点】
重点:气体摩尔体积的概念和相关计算
难点:气体摩尔体积的概念辨析及在化学计算中的应用
【学习过程】
思考:1 mol物质的质量就是摩尔质量,在数值上等于其相对原子质量或者相对分子质量或化学式的式量,那么,1mol物质的体积,我们如何定义,数值又是多少?
计算0℃、101Kpa(标准状况)时O2和H2的密度,请计算出1molO2和H2的体积
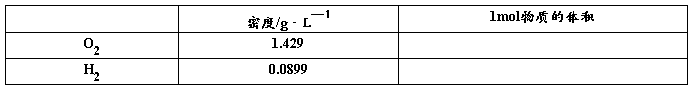
结论:
计算几种固体和液体的体积
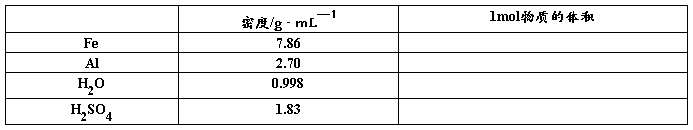
结论:
探究得到上述两个结论的原因
(1) 影响物质体积大小的因素
取决于 、 、和 三个因素、
(2) 对1摩尔固体、液体来说,影响体积大小的主要因素
1mol不同的固态物质和液态物质所含的 相同,而粒子间距____ ,使得固体和液体物质的体积主要取决于 。但因粒子的大小是 的,所以1mol不同的固态物质和液态物质的体积 。
(3) 对1摩尔气体来说,影响体积大小的主要因素
对于气体,粒子间的距离 粒子本身的直径,所以,当1mol气体所含粒子数相同时,气体体积主要取决于 。同温同压下任何气体粒子间距可以看成是 ,因此1mol任何气体的体积 。
三、气体摩尔体积
1、气体摩尔体积定义:单位 的气体所占的 。
符号_____,单位__ ___。
标准状况下(0℃,101kPa) Vm=___________
问题:
(1)、在标准状况下,1mol 气体的体积是22.4L,如果当1mol气体的体积是22.4L时,一定是标准状况下吗?
(2)、1mol任何气体的体积都是22.4L吗?
(3)、在标准状况下,1mol 水分子的体积约为22.4L,这个结论对吗?为什么
2、气体体积V、气体摩尔体积Vm和物质的量之间的关系表达式 。
3、阿伏伽德罗定律
(1).在相同的温度和压强下,相同 的任何 所含 相同,此定律称为阿伏加德罗定律。
(2).推论:同温同压下,任何气体的体积之比= 之比= 之比。
练习:
(1)在标准状况下,2.2g CO2的体积是多少?
(2)在标准状况下,测得1.92g某气体的体积为672mL。计算该气体的相对分子质量
(3)相同情况下,10m LX2气体与5m L Y2恰好完全反应,生成10m L A气体,则A气体的分子式为:
(4)判断下列说法是否正确
A、标准状况下,6.02x1023个分子所占体积约为22.4L
B、0.5mol氢气所占体积为11.2L
C、标准状况下1mol水的体积为22.4L
D、标准状况下28g CO与N2混合气体的体积约为22.4L
E、各种气体的气体摩尔体积都约为22.4L/mol
F、标准状况下,体积相同的气体分子数相同
挑战:在0℃,101Kpa的条件下,将2.00g氦气,1.40g氮气,1.60g氧气混合,该混合气体的体积是( )
A、6.72L B、7.84L C、10.08L D、13.44L
(5)下列叙述中正确的是( )
A、氢气的摩尔质量是2
B、相同质量的SO2和SO3所含硫原子数相等
C、在标准状况下,相同体积的O2和O3所含分子数相等
D、1mol任何气体的体积都是22.4L
(6)在标准状况下,0.5molH2占有的体积约为( )L
标准状况下,44.8LH2的质量约为( )g
标准状况下,3.01×1023个氧气分子所占的体积约为( )L
标准状况下,44.4L氧气所含的氧分子数约为( )个
【知识检测】
S 1.关于2mol二氧化碳的叙述中,正确的是 ( )
A.质量为44g B.有4mol原子 C.分子数为6.02×1023 D.摩尔质量为44g/mol
S 2.分析下列叙述正确的是( )
A.摩尔是物质的量的单位,1mol任何物质都含有6.02×1023个分子。
B.1molH2的质量为2g,它含有阿伏加德罗常数个氢原子。
C.氧气的摩尔质量为32g,氧气的分子量也为32g。
D.12g碳-12所含的碳原子数是阿伏加德罗常数,每摩尔物质含有阿伏加德罗常数个微粒。
S 3.标准状况下,5.6L某气体的质量为8g,则该气体的相对分子质量是( )
A.64 B.48 C.32 D.16
SS 4.在常温常压下,把1mol O2和4mol N2混合后占有的体积是( )
A.22.4L B.89.6L C.112L D.大于112L
SS 5.0.3mol氧气和0.2mol臭氧(O3) ( )
A.分子数相等 B.原子数相等
C.标准状况下的体积比是1:1 D.标准状况下体积比是2:3
SS 6.下列说法正确的是(NA表示阿伏加德罗常数) ( )
A.在常温常压下,11.2LN2含有的分子数为0.5NA
B.在常温常压下,1molHe含有的原子数目为NA
C.71gCl2所含原子数为2NA
D.在同温同压下,相同体积的任何气体单质所含原子数相同
SSS 7.对相同质量的SO2和SO3来说,下列关系正确的是( )
A、含氧原子个数比为2:3 B、含硫原子个数比为1:1
C、含硫元素质量比为4:5 D、含氧元素质量比为5:6
SSS 8.下列说法正确的是( )
A.在标准状况下,1mol水和1molH2的体积都约是22.4L
B.2gH2和44gCO2的体积相等
C.1mol某气体的体积为22.4L,则该气体一定处于标准状况
D.在标准状况下,1gH2和11.2LO2的物质的量相等
SSS 9.同温同压下,等质量的CO2和SO2两种气体相比较,下列叙述正确的是( )
A.密度比为11:16 B.密度比为16:11
C.体积比为1:1 D.体积比为16:11
SSS 10.同一状态下,20mLA2气体与30mLB2气体恰好完全反应生成20ml某气体X,则可推出X的化学式为( )
A.AB2 B.AB3 C.A2B3 D.A3B2
S 11.标准状况下,1.7gNH3和____________LH2S含有相同的氢原子数.
SS 12.2molSO3和3molSO2其分子数之比为_____________;相同状况下(均为气体)体积之比为_____________;氧原子数之比为__________________.
SSS 13.同温同压下,同体积的氢气和甲烷各种量的比应是:
分子个数比( );原子个数比( );
物质的量之比( );质量 之比( )
【统一学案1.2.3】物质的量在化学实验中的应用(课时4)
【学习目标】
1、理解物质的量浓度的概念
2、会运用物质的量浓度的概念进行简单的计算
【重点难点】
重点:物质的量浓度的概念;
难点:溶液中的离子浓度的计算
【教学过程】
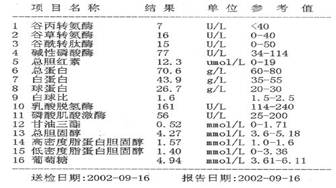
上图是体检的一些指标各个检测的浓度,却不是同学们初中熟悉的质量分数,那么,这种表示浓度的物理量,究竟是什么呢?
我们为什么要引入它呢?
四、物质的量浓度
1、定义:单位______溶液里所含溶质B的__________,来表示溶液组成的物理量
符号:_______常用单位:________
物质的量浓度( ),溶质物质的量( )和溶液体积之间的关系为:
注意:
a、 对于某浓度的溶液,取出任意体积的溶液,其_______、_______、_______不变,所含溶质的_________、________则因体积不同而改变
b、 体积必须是________的体积,而不是______的体积
[练习]:
1、用5mol NaOH配成500m L溶液,其浓度为________________,取5m L该溶液,其浓度为_______________,物质的量为______________.
2、0.5mol/L的H2SO4溶液中,H+的浓度为___________,SO42—的浓度为___________
3、8g NaOH溶于水配成100m L溶液,其物质的量浓度为___________
4、配制500ml,0.1mol/L NaOH溶液,需要NaOH的质量是多少?
【知识检测】
(1)将30m L 0.5mol/L NaOH溶液加水稀释到500m L,稀释后溶液中NaOH的物质的量浓度为( )
A、0.3mol/L B、0.03mol/L C、0.05mol/L D、0.04mol/L
(2)某硫酸溶液物质的量浓度时X mol/L,含H2SO4的质量分数为a%,则该溶液的密度是( )
(3)0.5L 1mol/L FeCl3溶液与0.2L 1mol/L KCl溶液中的Cl—的数目之比为( )
A、5:2 B、3:1 C、15:2 D、1:316
(4)同温同压下,1mol CO2和1mol CO具有( )
A、相同的质量 B、相同的体积
C、不同的分子数 D、相同的原子数
【统一学案1.2.4】物质的量在化学实验中的应用(课时5)
【学习目标】
1、理解物质的量浓度的概念
2、学会配制一定物质的量浓度溶液的方法和技能
【重点难点】
重点:一定物质的量浓度溶液的配制
难点:误差分析
【教学过程】
2、【实验】——一定物质的量浓度溶液的配制
【思考】怎样配制250mL 0.5mol/L的NaCl溶液?需要什么仪器?步骤如何?(阅读P15—16)
(1)仪器
托盘天平:______称量一定量固体质量的仪器,精确度为____________.
容量瓶:标有________、____________和___________,常用规格有_____mL____ mL ______ mL _____ mL,精确度____________
其他仪器:_______、_________、_____________、____________
(2)步骤——以配置500mL1.0mol/L NaOH溶液为例
A、“算”计算:需称量NaOH固体的质量为________g
B、“量”称量:用____________称量NaOH固体
C、“溶”溶解:将称好的NaOH放入_________中,加入适量的蒸馏水溶解
D、“移”转移:待烧杯中溶液______后,用__________引流,将溶液注入______mL容量瓶中
E、“洗”洗涤:用少量蒸馏水洗涤烧杯内壁________次,洗涤液转移到容量瓶中,轻轻摇动容量瓶,使混合液均匀
F、“定”定容:将蒸馏水注入容量瓶中,当液面距瓶颈刻度线_________时,改用________滴加蒸馏水至___________与_________相切
G、“摇”摇匀:盖好瓶塞,反复上下颠倒,摇匀
F、“贴”装瓶贴签
【实际操作】根据步骤找同学到讲台前实际操作
问题:
(1) 在配制一定物质的量浓度的溶液时,量筒的作用是什么?
(2) 溶液混合时,体积能相加吗?
(3) 等体积等物质的量浓度的两种不同溶液中,其溶质的物质的量相同吗?所含溶质的粒子数目相同吗?
3、实验中的误差分析:
(1)称好后的药品放入烧杯中,有少量撇在烧杯外。
(2)溶解搅拌时有部分液体溅出
(3)转移时有部分液体溅出
(4)未洗涤烧杯和玻璃棒
(5)定容时,仰视读数。
(6)定容时,加水超过刻度线,再用胶头滴管吸出多余部分
(7)加水至刻度线后,摇匀过程中,发现液面低于刻度线
(8)洗涤容量瓶后,未干燥,瓶中有少量蒸馏水
4、物质的量浓度与溶液的质量分数之间的换算
【思考】如果将5mL浓硫酸稀释为20mL的稀硫酸,得到的稀硫酸与原浓硫酸中所含H2SO4的物质的量相等吗?说出你的理由。
5、稀释定律
【知识检测】
1.容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的
A.②④⑥ B.③⑤⑥ C.①②④ D.①③⑤
2.实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是
A.950mL,111.2g B.500mL,117g
C.1000mL,117g D.任意规格,111.2g
3.要配制物质的量浓度约为2mol·L-1 NaOH溶液100mL,下面的操作正确的是
A.称取8g NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8g NaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
C.称取8g NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D.用100mL量筒量取40mL 5mol·L-1NaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
【课后小结】
