陕西香菊药业集团有限公司
20xx年产品质量稳定性考察方案
方案起草: 日期: 年 月 日
方案审核:年月日
方案批准: 日期: 年 月 日
质 量 技 术 部
20xx年产品质量稳定性考察方案
一、目的
20xx年我公司在商丹循环工业园区建造新厂房,生产地址进行了变更,为了考察生产地址变更后公司生产品种的质量稳定性,现对试生产品种进行长期稳定性考察试验,为确保患者能够安全、有效的用药提供有效数据。 二、职责
QC主管负责稳定性考察方案与报告的起草、检验结果的汇总。 QC人员按照该方案完成实验并报告检验结果。 QA主管负责稳定性考察方案及报告的复核。
质量部经理、质量受权人、稳定性考察方案及报告的批准。 三、稳定性考察的品种
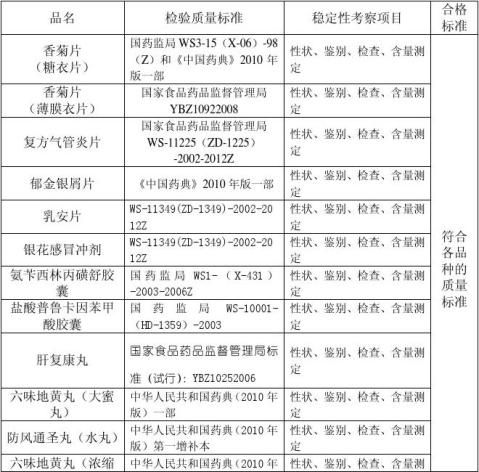
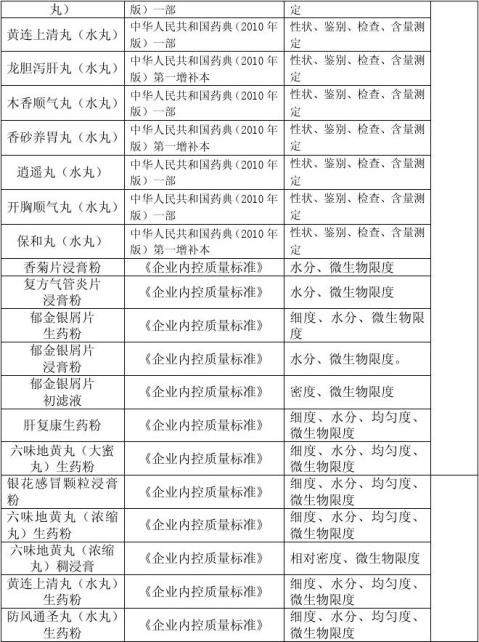
四、考察要求
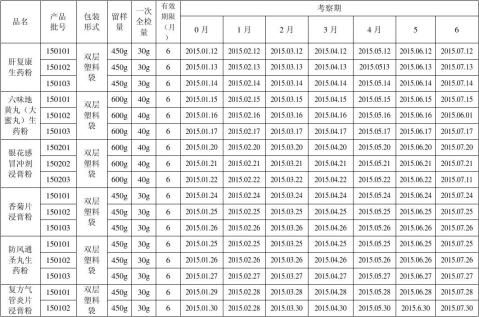
1对各品种生产的不同包装规格成品在正式生产前三批进行稳定性考察,以后每年对同一包装规格取一批次产品进行稳定性考察。 2考察方法
2.1成品药品按市售包装,在23~27℃,50%~70%储存条件下保存至有效期,分别于0、3、6、9、12、18、24、36月份取样,按各剂型品种具体的稳定性考察项目进行检测,结果与零月进行比较,以证明药品在规定贮存条件下的质量稳定性。
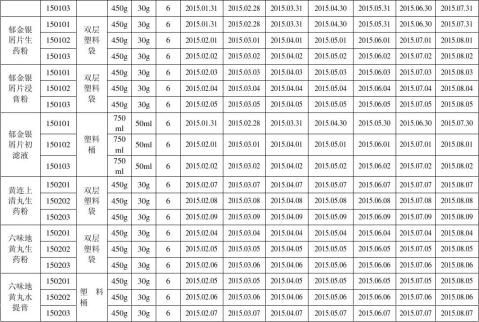
2.3中间体模拟实际包装情况,生药粉、浸膏粉用双层塑料袋包装,流浸膏、初滤液用塑料瓶包装,在23~27℃,50%~70%环境下保存至有效期,分别于0、1、2、3、4、5、6个月取样,按照稳定性项目进行检测,结果与零个月进行比较,以证明中间体在规定的贮存条件下的质量稳定性。
2.4对于每种规格、每种内包装形式的药品和中间体,每年以首生产批次考察一个批次,若是原计划考察当月的指定包装规格的品种未生产,则选取离原计划最近月份所生产的相同包装形式的品种进行稳定性考察,除非当年没有生产。
2.5如重大变更或生产和包装有重大偏差的药品应列入稳定性考察,持续稳定性考察中应当额外增加批次数,此外,重新加工,返工或回收的批次,也应当考虑列入考察,除非已经过验证和稳定性考察。
五、方案的实施
本方案由质量技术部完成,记录上述所有数据,并对试验过程中不符合质量标准的结果或者重要异常情况记录和调查。对任何已经确认的不符合质量标准的结果或重大不良趋势,必要时对产品实施召回,并对调查结果及时采取的措施报告当地药品监督管理部门。
六、考察结果的报告
产品质量稳定性考察完毕后,根据所获得的全部资料,包括考察的阶段性结论,撰写总结报告并保存,并每年审核总结报告。
附表一:2015制剂试生产产品长期稳定性考察品种
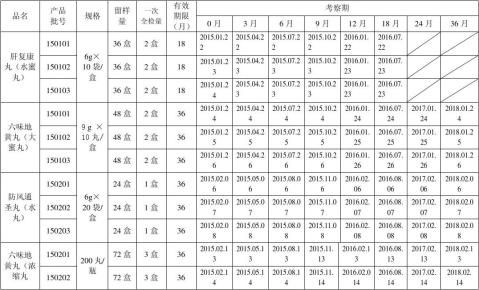

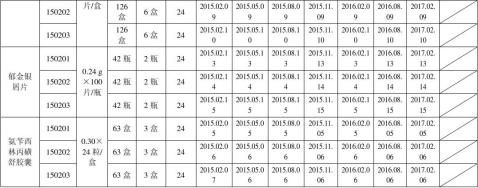
附表二:2015中间体长期稳定性考察品种
附表三:长期稳定性考察结果以及评价

附表四:持续稳定性考察汇总表
年质量技术部产品持续稳定性考察汇总表
品 名: 批 号: 生产日期: 年 月 包装形式: 贮存条件: 温度: ℃ 湿度: 效期限:
第二篇:药品生产持续稳定性考察计划
药品生产持续稳定性考察计划1.应按照适当的持续稳定性考察计划监控已上市药品的稳定性,以发现市售包装药品与生产相关的任何稳定性问题(如杂质含量或溶出度特。2.持续稳定性考察计划的目的是在有效期内监控药品质量,并确定药品可以或预期可以在标示的贮存条件下,符合质量标准的各项要求。(奥咨达医疗器械咨询)3.持续稳定性考察计划主要针对市售包装药品,但也需兼顾待包装产品。例如,当待包装产品在完成包装前,或从生产厂运输到包装厂,还需要长期储存时,应在相应的环境条件下,评估其对包装后产品稳定性的影响。此外,还应考虑对储存时间较长的中间产品进行考察。4. 持续稳定性考察计划应有考察方案,结果应有报告。用于持续稳定性考察计划的设备(尤其是稳定性试验箱)应按照第七章和第五章的要求进行确认和维护。5.考察方案应涵盖药品有效期,应至少包括以下内容:(一)每种规格、每种生产批量药品的考察批次;(二)相关的物理、化学、微生物和生物学检验方法,可考虑采用稳定性考察专属的检验方法;(三)检验方法依据;(四)合格标准;(五)容器密封系统的描述;(六)试验间隔时间(测试时间点);(只专注于医疗器械领域)(七)贮存条件(应采用与药品标示贮存条件相对应的《中华人民共和国药典》长期稳定性试验的标准条件);(八)检验项目,如检验项目少于成品质量标准所包含的项目,应说明理由。6.考察批次数和检验频率应能获得足够的数据,以供趋势分析。通常情况下,每种规格、每种内包装形式的药品,至少每年应考察一个批次,除非当年没有生产。7.某些情况下,持续稳定性考察计划中应额外增加批次,如重大变更或生产和包装有重大偏差的药品应列入稳定性考察。此外,任何采用非常规工艺重新加工、返工、或有回收操作的批次,也应考虑列入考察计划,除非已经过验证和稳定性考察。8. 关键人员,尤其是产品放行责任人,应了解持续稳定性考察的结果。当持续稳定性考察不在待包装产品和成品的生产企业进行时,则相关各方之间应有书面协议。生产企业应保存持续稳定性考察的结果以供药品监督管理部门审查。9. 应对不符合质量标准的结果或重要的异常趋势进行调查。任何已确认的不符合质量标准的结果或重大不良趋势,都应向当地药品监督管理部门报告;企业还应考虑是否可能对已上市药品造成影响,并与当地药品监督管理部门磋商。10. 应根据所获得的全部数据资料,包
括考察计划的阶段性结论。撰写总结报告并保存。应定期审核总结报告。
