《遗传学》实验指导
福建农林大学作物科学学院遗传育种教研室
前言
遗传学诞生至今,已有一百多年的历史,已是当今生命科学中发展最快的一门前沿学科,它涉及生命科学的各个领域,引领生命科学从各个水平探讨生命的奥秘。而且,遗传学与农、林、牧、渔、工业发酵、医药、优生优育等密切相关,是动物、植物、微生物育种实践的理论基础,具有很强的实践性,因此,遗传学实验课是遗传学教学中的重要环节。通过实验验证遗传学基本规律、掌握遗传学试验技术、分析遗传学试验结果,从而加深理解遗传学理论知识,初步掌握遗传学研究的基本实验技能。
本实验教材适合本科生物技术、生物科学专业和农业院校的农学、植物保护等专业。
随着生命科学的发展,在基本遗传学实验基础上,增加群体遗传学实验内容。
实验共分为五大部分:
第一部分:遗传的细胞学基础
第二部分:染色体变异
第三部分:验证遗传规律
第四部分:数量遗传
第五部分:群体遗传
生物技术专业和生物科学专业遗传学实验课为18学时,开设6次实验,每一部分内容为1-2次实验,并结合多媒体示范实验。
农学专业遗传实验课为15学时,开设5次实验,内容为第一,三、四、五部分,同时也结合多媒体示范实验。
植物保护专业遗传实验为9学时,开设了3次实验,内容为第一、三、四个部分。
实验分组进行,每组30-40人。
目 录

实验一 有丝分裂制片技术和显微观察
一、实验目的
通过对植物组织的取材、预处理、解离、染色、压片等制片步骤的学习,掌握植物制片技术,奠定细胞遗传学的研究技术;通过对植物根尖细胞的观察,掌握有丝分裂过程中染色体的形态特征和动态变化。
二、实验原理
有丝分裂是植物细胞分裂的主要方式,细胞分裂过程中,核内染色体准确地复制,并有规律地、均匀地分配到两个子细胞中去,使子细胞和母细胞的遗传组成一样,保证了植物细胞的遗传性状的一致。各种生长旺盛的植物组织中,如根尖组织、茎尖组织、居间分生组织、愈伤组织等,常进行着剧烈的细胞有丝分裂。在细胞分裂的适当(分裂旺盛期)时候取材,进行预处理,固定、解离、染色和涂抹压片等方法,使细胞、染色体分散,便于在显微镜下观察染色体的形态特征和变化特点及进行染色体计数。
三、实验材料
蚕豆(Vicia faba, 2n=12)干种子
洋葱(Allium cepa, 2n=16)鳞茎
四、实验仪器及用具
多媒体显微演示系统、显微镜、培养箱、分析天平、水浴锅、酒精灯、剪刀(或刀片)、镊子、解剖针、载玻片、盖玻片、滤纸、铅笔、标签纸、胶水、棕色瓶等。
五、药品和试剂
秋水仙碱、8-羟基喹啉、苏木精、水合三氯乙醛、铁矾[铁钾矾KFe(SO4)2?12H2O或铁铵矾NH4Fe(SO4)2·12H2O]、无水酒精、冰醋酸、1N盐酸、50%丙酸
六、实验步骤
(一)材料准备:
1. 蚕豆根尖:选取新鲜无病斑的蚕豆干种子,经日晒后,放在烧杯内,室温下清水浸泡一昼夜。种子吸水膨胀后,放在搪瓷盘上20℃左右保湿培养(双层纱布覆盖),待根长1~2cm时,于上午9:00~10:30或下午14:00~16:00进剪下根尖备用。
2. 洋葱根尖:通过休眠的洋葱鳞茎,经日晒后,置于盛有清水的小烧杯上,根部与水接触,20~25℃光照条件下培养2~3天,待根长1~2cm时,于上午9:00~11:00剪下根尖备用。
(二)预处理
为了获得较多中期分裂相的细胞,同时使染色体缩短和分散,可对根尖进行预处理,处理方法如下:
1. 0.05%~0.2%的秋水仙碱水溶液处理2~4小时。
2. 0.002M的8~羟基喹啉溶液处理3~4小时。
3. 根尖浸在蒸馏水中于在1~4℃低温下处理24小时。
(三)固定:
用蒸馏水洗净材料,再用卡诺氏(冰醋酸:无水酒精=1:3)固定液(用量应为材料体积的15倍以上)室温下固定30~60分钟。固定的材料如暂不制片,可经90%酒精→80%酒精→70%酒精(各半小时)浸泡进行转换,最后置于70%酒精内放入0~4℃冰箱,约可保存半年。如保存时间太长,需重新固定后再用。
(四)解离:
根尖、茎尖等体细胞需经处理,除去细胞间的果胶层,并使细胞壁软化,才便于压片。这种处理过程称为解离,解离时间的长短依植物材料和解离液的不同而不同。时间短细胞不易压散,时间过长,细胞被压破,且影响染色效果。
方法1:固定的材料(洋葱或蚕豆根尖)用蒸馏水冲洗2遍,然后放入预热的60℃的1N盐酸中,60℃恒温处理5分钟左右,倒去盐酸,用蒸馏水冲洗3遍后,将材料浸泡在蒸馏水中2小时。
方法2:固定的材料用蒸馏水冲洗干净后,置1N的盐酸中,蚕豆根尖在室温(约28~30℃)处理30分钟左右,洋葱根尖室温处理15分钟左右。然后倒去盐酸,蒸馏水洗3遍后,置于蒸馏水中浸泡2个小时以上。将材料中的酸洗净。
方法3:取材料的根尖,在生长点处切取1毫米左右(一般一个根尖可取4~5段),放入1N HCl酸解10分钟左右,取出,用水漂洗三遍。
注:1N HCl由36%~38%浓盐酸取83ml定容至1升配置而成。
(五)染色液和制片
1. 染色液:
(1)丙酸-铁矾苏木精
贮存组:A液:苏木精2克,溶于100ml 50%丙酸,
B液:铁钾矾0.5克溶于100ml 50%丙酸。
染色液:A液和B液等量混合,每5ml的A液和B液的混合液中加入2克水合三氯乙醛,充分溶解摇匀,存放一天后使用。贮存液可较长久保存,染色液只能保存一个月,在两周内使用效果最好。
(2)改良卡宝品红
甲液:3克碱性品红,溶于70%酒精100ml(可长期保存),
乙液:甲液10ml,加入5%苯酚(石炭酸)水溶液90ml(限2周内使用),
染色液母液:B液45ml,
37%甲醛6ml,
冰醋酸6ml。
改良卡宝品红染色液:染色液母液10ml,
45%醋酸90ml,
山梨醇1克
配制后立即使用着色能力差,两周后着色能力增强。
2. 制片:
选(挑)取已处理过的根(茎)尖一枚,放在干净载玻片中央,除去非分生组织的部分,并吸去多余水分。另取一张干净载玻片,呈十字形交叉盖在有根尖的载玻片上,用大拇指按压在载玻片的中央,使根(茎)尖压成一簿层,然后将两载玻片分开,各滴一小滴上述染色液进行染色,稍等片刻,取一盖玻片,盖玻片一边靠在离材料不远的载玻片上,左手握镊子顶着盖玻片,右手握解剖针托住盖玻片徐徐放下,若染色液不能布满盖玻片时,可在盖玻片边缘稍加染色液,然后用一张大小合适的滤纸覆盖在盖玻片上,一手固定盖玻片,另一手持铅笔橡皮头,对准材料轻敲,使根尖细胞分散均匀。制好的片子若不能及时进行显微镜观察,可用矾士林临时封住盖玻片四周。
(六)显微观察
制备好的细胞学片子,置于显微镜的载物台上,先用低倍镜(10×10)调焦观察,寻找具有分裂相的细胞后,再转换到高倍镜(10×40)下观察。
(七)实验作业
1. 制作细胞有丝分裂各时期图象片子1-2张
2. 描绘所观察到的细胞有丝分裂过程中各时期的图象,并简要说明染色体的行为特征。
实验二 染色体组型分析
一、实验目的
分析植物细胞有丝分裂中期染色体数目、大小、着丝粒位置和随体等形态特征,学习染色体组型分析的方法。为物种起源和进化提供依据,为遗传育种研究提供细胞学证据。
二、实验原理
各种生物染色体的形态,结构和数目都是相对稳定的。每一生物细胞内特定的染色体组成叫染色体组型。染色体组型分析也称核型分析。通过一定的方法制得染色体有丝分裂的玻片标本,经显微照相,冲洗放大等步骤获得染色体照片。从染色体玻片标本和染色体照片的对比分析,进行染色体分组,并对组内各染色体的长度,着丝点位置,臂比和随体有无等形态特征进行观测和描述,从而阐明生物的染色体组成,确定其染色体组型,这种过程称为染色体组型分析。
三、实验材料
蚕豆(Vicia faba, 2n=12),洋葱(Alliums cepa, 2n=16),大麦(Hordeum vulgare, 2n=14),黄麻(Tiliaceae Corchorus, 2n=14)。
四、实验仪器及用具
显微镜,显微照相系统,相片冲洗放大整套设备,目镜测微尺,镜台测微尺,4#放大纸,135黑白胶卷,计算器,透明尺,剪刀,坐标纸,胶水以及制作有丝分裂玻片所需的用具。
五、药品和试剂
制作有丝分裂玻片所需的药品和试剂(见实验一)以及显微摄影冲洗放大所需的药品和试剂:米吐尔,无水亚硫酸钠,几奴尼(对苯二酚),无水碳酸钠,溴化钾,硫代硫酸钠,硼酸,钾矾(硫酸铝钾),28%醋酸
六、实验方法与步骤
(一)染色体标本玻片的制作
染色体组型分析一般用有丝分裂中期的分裂细胞,通常采用植物根尖细胞。有丝分裂中期的染色体具有典型的形态特征,便于进行分析,具体制作方法见实验一。
(二)镜检和测量
当染色体玻片制好后,放在显微镜下观察,选出符合染色体组型分析要求的细胞,这些细胞是处于有丝分裂中期,染色体分散良好,没有重叠,数目完整,随体和着丝点明显,没有断裂,着色鲜明,形态清晰,且各条染色体处于同一平面上。
选择染色体较平直的一条或几条,用目微尺(目镜测微尺)测量其长度。
(三)显微照相、冲洗和放大
将在显微镜下选定的符合要求的细胞进行显微照相(可用10×100倍的油镜),然后冲洗,选取图像清晰的底片,放大、洗印出染色体形态清晰的照片。在显微照相的同时,对镜台测微尺进行同样倍数(油镜10×100倍)拍摄,放大,然后根据照片上的实际长度,计算放大倍数。
(四)测量和计算
1. 测量:在放大的照片上用透明尺准确地量出各条染色体的总长度和每条染色体两臂的长度(分别量到着丝点的中部)。随体的长度可计入或不计入染色体长度之内,应注明。染色体弯曲不能用直尺测量时,可先用细线量取染色体相等的长度,再用尺量出细线的相应长度。
2. 计算

 (1)放大倍数=
(1)放大倍数=

 或=
或=

 (2)绝对长度=
(2)绝对长度=

 或=
或=
(3)相对长度:(取小数点后两位数)

 =
=

 或=
或=
(4)臂比(取小数点后两位数)

 =
=
(五)染色体形态测量数据表
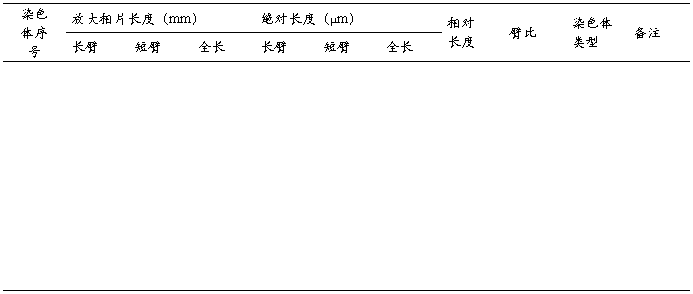
(六)剪贴和配对
将放大照片上的各条染色体剪下,根据目测和染色体的相对长度、臂比、着丝粒位置、次缢痕的有无和位置、随体的有无和形态大小等特征,进行同源染色体配对。
(七)排列和粘贴
将配对好的染色体按照由大到小的顺序依次排列起来。排列时把各对染色体的着丝粒排在一条直线上,并且使短臂在上,长臂在下。等长的染色体,把短臂较长的染色体排在前面。随体染色体排在最后,性染色体和额外染色体单独排列。
已排好的同源染色体按染色体编号先后顺序粘贴在绘图纸上,粘贴时着丝粒要处在同一直线上。
(八)分类
根据着丝点的位置,确定染色体的形态类型,臂比是反映着丝点在染色体上的位置。

具随体染色体(sat)用*标出。
(九)翻拍和绘图
将剪贴排列的染色体组型图进行翻拍,并用座标纸绘制成染色体模式图。
七、实验作业
1. 提交植物染色体组型剪贴图
2. 植物染色体组型的模式图
3. 染色体形态测量数据
4. 简述本实验的染色体组型结果,核型公式。
实验三 染色体显带技术和带型分析
一、实验目的
学习和掌握植物染色体Giemsa显带技术和带型分析方法,进一步鉴别植物染色体组和染色体结构。
二、实验原理
对植物有丝分裂中期染色体进行酶解,酸、碱、盐等处理,再经染色后,染色体可清楚地显示出很多条深浅、宽窄不同的染色带。各染色体上染色带的数目、部位、宽窄、深浅、相对稳定,为鉴别染色体的形态提供依据,也为细胞遗传学和染色体工程提供新的研究手段。
植物染色体显带技术包括荧光分带和Giemsa(吉姆萨)分带两大类。在植物染色体显带上最常用的是Giemsa分带技术,其中C带和N带较为常用。C带的形成认为是高度重复序列的DNA(异染色质)经酸碱变性和复性处理后,易于复性,而低重复序列和单一序列DNA(常染色质)不复性,经Giemsa染色后呈现深浅不同的染色反应。这种差异反映染色体结构的差异。
三、实验材料
洋葱、蚕豆、大麦、黄麻的根尖。
四、实验仪器及用具
多媒体系统(附显微演示),显微镜(附摄影装置),半异体致冷器,冰箱,恒温水浴锅,电子天平,液态氮装置,容量瓶,试剂瓶烧杯,染色缸,载玻片,盖玻片,剪刀,镊子,玻璃板,滤纸,标签,铅笔
五、药品和试剂
冰醋酸,无水酒精,甲醇,盐酸,柠檬酸钠,氢氧化钡,氯化钠,磷酸二氢钠,磷酸二氢钾,磷酸氢二钠,甘油,Giemsa粉剂,果胶酶,纤维素酶
试剂1:Giemsa液:0.5克Giemsa,33ml甘油,33ml甲醇,用少量甘油将Giemsa粉末研磨至无颗粒,剩余甘油分次洗涤至棕色瓶内,置56℃恒温2h,加入甲醇,过滤后保存于棕色瓶中。
试剂2 :5%氢氧化钡:5gBa(OH)2加入100ml沸蒸馏水中溶解后过滤,冷却至18-28℃。
试剂3:2×SSC溶液:0.3M氯化钠+0.3M柠檬酸钠。
试剂4:1M NaH2PO4溶液。
试剂5:1%纤维素酶和果胶酶混合液。
试剂6:1/15磷酸二氢钾和1/15磷酸氢二钠缓冲液。
六、实验步骤
(一)染色体分带
1. 材料准备 待洋葱鳞茎发根长2cm左右,切取根尖进行预处理。蚕豆种子浸种发芽,待幼根长至3cm左右,切取根尖进行预处理。蚕豆主根根尖切去后继续长出的次生根,可再切取次生根根尖进行预处理。大麦种子发芽至幼根长1cm左右,切取白色的幼根进行预处理。
2. 预处理 洋葱和蚕豆根尖在0.05%秋水仙碱溶液中预处理2~3h。处理温度一般为25℃。预处理后须用清水冲洗多次,洗去药液。
3. 固定 以上各材料经预处理后,放入卡诺氏固定液中固定0.5~24h,转换到70%酒精,置于冰箱中保存备用。
4. 解离 洋葱、蚕豆根尖在0.1N盐酸溶液中置于60℃恒温下处理10~15min。大麦根尖在37℃下用1%果胶酶处理30min,然后在0.1N盐酸溶液中置于60℃下处理5min。
上述材料用酸处理后,须用蒸馏水冲洗多次,除去残留酸液,否则将会影响染色体的显带效果。
5. 压片 与常规的植物染色体压片方法相同。在45%醋酸中压片,制成白片。在相差显微镜下检查染色体分散程度,挑选出分裂相多,染色体分散均匀的片子。选出的玻片经液氮、CO2干冰或半导体致冷器冻结,用刀片揭开盖玻片。置室温下干燥。
6. 空气干燥 脱水后的染色体标本一般需经过4~7天的空气干燥,再进行分带处理。不同的材料所需干燥的时间不一样。洋葱要求空气干燥的时间较严,未经空气干燥的染色体不显带,干燥一周后经显带处理显示末端带,干燥半个月后能同时显示末端带和着丝点带。而蚕豆、黑麦、大麦则要求干燥时间不十分严格。
7. 显带处理 空气干燥后的染色体标本即可进行显带处理。处理方法不同,可显示不同的带型。
(1)C带 HSG法(Hydrochloric acid~Saline~Giemsa method)将空气干燥后的洋葱、蚕豆染色体标本浸入0.2N盐酸(25℃左右)分别处理30和60min。用蒸馏水冲洗多次后,在60℃的2×SSC溶液中保温30min,再用蒸馏水冲洗数次,室温风干,即可染色。
BSG法(Barium~Saline~Giesa method) 将空气干燥后的黑麦、大麦的染色体标本浸入盛有新配制的5%氢氧化钡饱和液的染色缸中,在室温条件下处理5~10min,然后用蒸馏水小心地多次冲洗浮垢后,在60℃的2×SSC溶液中保温60min,再用蒸馏水冲洗数次,室温风干,即可染色。
(2)N带 将黑麦、大麦种子发根1cm左右切取,在0℃冰水中预处理24h。卡诺氏固定液中固定半小时以上,1%醋酸洋红染色液中染色2h,然后在45%醋酸中压片,冰冻法揭开。尔后在45%醋酸60℃条件下脱色10min,再在95%酒精室温下脱水10min,气干过夜。最后在1M NaH2PO4溶液中95℃恒温下保温2min,蒸馏水冲洗,气干后即可染色。
8. 吉姆萨染色 吉姆萨母液用1/15M磷酸缓冲液按一定的比例稀释。例如,10份磷酸缓冲液加1份吉姆萨母液稀释即为10:1,一般都采用扣染法染色。在一干净的玻璃板上,对称放置两根牙签或火柴棒,距离与载玻片上的材料范围相等。将带有材料的玻片翻转向下,放在牙签上,然后沿载玻片一边向载玻片与玻璃板之间的空隙内缓缓滴入染色液,在室温下染色。染色时间因材料而异,因吉姆萨染料批号不同、质量上有差异,因此其染色液浓度和染色时间需作适当调整。下列材料的染色浓度和染色时间可供参考。

9. 镜检和封片 染色后的玻片标本,用蒸馏水洗去多余染料,染色过深可用磷酸缓冲液脱色。室温下风干后即可镜检,挑选染色体带型清晰的片子,用树胶封片。
(二)染色体带型分析 经过上述处理的植物染色体标本,可以显示出C带或N带的带型,一般有以下四种带型:
1. 着丝粒带(C带) 带纹分布在着丝粒及其附近,大多数植物的染色体可显示C带。蚕豆、黑麦、大麦等的染色体着丝粒带比较清楚,洋葱染色体的着丝粒带较浅。
2. 中间带(I带) 带纹分布在着丝粒至末端之间,表现比较复杂,不是所有染色体都具有中间带。
3. 末端带(T带) 带纹分布在染色体末端。洋葱和黑麦染色体具有典型的末端带,而蚕豆、大麦的末端带不明显。
4. 核仁缢痕带(N带) 带纹分布在核仁组织者中心区。蚕豆的大M染色体和黑麦的第Ⅶ染色体具有这种带型。
同时具有以上四种带型的叫完全带,以“CITN”表示,其它称为不完全带,有“CIN”和“以CTN”型、“TN”型和“N”型。
根据植物各染色体上显示的不同带纹和带纹的宽窄,可按染色体组型分析的方法对同源染色体进行剪贴排列,绘出模式图,从而对各染色体的带型作出分析。
七、实验作业
1. 将提供的植物染色体C带带型进行同源染色体排列剪贴,
2. 绘制带型模式图并作出带型特点分析描述。
实验四 减数分裂制片技术及显微观察
一、实验目的
学习植物花粉母细胞制片技术,观察减数分裂过程中不同时期的染色体形态,了解性细胞形成过程中染色体的动态变化,明确遗传的细胞学基础。
二、实验原理
减数分裂是生物在性母细胞成熟形成配子过程中发生的一种特殊有丝分裂,它包括连续两次的细胞分裂,第一次分裂是减数的,第二次是等数的。第一次分裂的前期较长,染色体变化较复杂,可细分为5个时期,即细线期、偶线期、粗线期、双线期和终变期。在减数分裂的整个过程中,同源染色体之间要发生联会、交换和分离,非同源染色体之间要发生自由组合。通过染色体规律性变化,最终产生的四个子细胞内染色体数目只有母细胞的一半,以后每一个子细胞进一步发育为雌配子和雄配子。雌雄配子通过受精作用又结合成为合子,发育成为新的个体,染色体数目恢复为全数(2n)。染色体是遗传物质的载体,因此染色体在减数分裂的行为对遗传物质的分配和重组产生重大影响。形成不同染色体组合的雌雄配子,经受精后,产生大量的遗传变异个体。有利于生物的适应和进化,为人工选择提供丰富的材料。
由于植物花药取材容易,操作方便,一般作为减数分裂制片材料,在发育的适宜时期取样、固定、压片等程序,便可在显微镜下观察到减数分裂时染色体的行为变化。
三、实验材料
水稻(Oryza sativa 2n=24) 银杏(Ginkgo biboba 2n=24) 豌豆(Pisum sativum 2n=14)
四、实验仪器及用具
多媒体显微演示系统、显微镜、电子天平、载玻片、盖玻片、镊子、刀片、滤纸、标签纸、铅笔
五、药品和试剂
苏木精、铁钾矾、丙酸、水合三氯乙醛、冰醋酸、无水酒精、丙酸—铁矾苏木精染色液,卡诺氏固定液(同实验一)
六、实验步骤
(一)取材
水稻:幼穗当剑叶的叶枕距为0左右(早稻 –7~0厘米,晚稻 –3~0厘米),幼穗和颖花为终长的1/2时,处于减数分裂期。于早上8:00~10:00采集水稻幼穗进行固定(卡诺氏固定液)1小时,保存在70%酒精中。
银杏花蕾:3月下旬当银杏进入减数分裂时,采集整个花枝将整朵花蕾置于卡诺氏固定液固定1小时,然后转入70%乙醇保存。
豌豆:从现蕾开始,选取1mm左右大小的花蕾或小段花序进行固定然后保存在70%酒精中。
(二)制片
取1~3枚花药放在洁净的载玻片上,吸去多余的保存液,用刀片或两支解剖针将花药横向切断,滴一小滴丙酸—铁矾苏木精染色液于花药上,用镊子挤压花药,使花粉母细胞从花药中逸出,再用镊子把药壁等残渣镊走。用低倍镜预先观察是否取到处于减数分裂期的细胞。取到适合要求细胞时,用一盖玻片的一边靠在载玻片,待染色液布满整个边缘时,左手用镊子顶着盖玻,右手用解剖针托着盖玻片轻轻放下,染色液不能布满盖玻片时,则在盖玻片边缘补充少许染色液。然后在酒精灯上手持载玻片来回移动烤片,以片子不烫手为宜。烤片使细胞质颜色变浅,染色体着色深。烤片后在盖玻片上加一滤纸,用拇指按压盖玻片或用铅笔的橡皮头轻敲盖玻片。注意不要使盖玻片移动。
(三)显微镜观察
先在低倍镜下寻找具分裂相的花粉母细胞,然后依次转换到高倍镜观察减数分裂各个时期染色体的行为和形态特征。
七、实验作业
1. 制作具减数分裂图象的细胞学片子1-2张
2. 绘制细胞学片子的分裂相,并作染色体行为特征的描述。
实验五 染色体结构变异
一、实验目的
了解染色体结构发生变异后,在有丝分裂的细胞中,可以观察到在后期出现染色体桥或染色体断片,在间期的细胞可以观察到微核。
二、实验原理
染色体结构变异主要有缺失、重复、倒位、易位四种。其发生过程是由于同源染色体或非同源染色体之间发生断裂,然后发生错误重接的结果。各种结构变异的杂合体,在细胞分裂过程中常常表现不正常的细胞学行为,可以进行细胞学鉴定。在减数分裂过程粗线期,可以观察到缺失杂合体的“缺失环”,重复杂合体的染色体突出的环或瘤,倒位杂合体的“倒位圈”或者后期的染色体桥,易位杂合体的“十字形”联合或者终变期“四体环”“四体链”“8字形环”。在有丝分裂细胞中可见到后期的染色体桥,染色体断片,以及间期的细胞核显出现“微核”等。
染色体结构变异一般可导致花粉和胚珠的部分不育,或者半不育,产生遗传性状的变异,以及假显性,假连锁、剂量效应、位置效应等等改变基因连锁关系遗传后果,严重的可造成个体死亡。通过染色体行为观察和遗传效应实验相互印证,鉴别染色体结构变异的类型。
三、实验材料
蚕豆(vicia faba, 2n=12)干种子
四、实验仪器及用具
多媒体系统(带显微演示)、显微镜、培养箱、分析天平、水浴锅、酒精灯、剪刀、镊子、解剖针、载玻片、盖玻片、滤纸、铅笔、标签纸、胶水
五、药品和试剂
8-羟基喹啉、苏木精、水合三氯乙醛、铁铵矾、无水酒精、70%酒精、1N盐酸、5%丙酸
六、实验步骤
(一)材料准备:选购具强生活力的蚕豆干种子,经45格伦钴60照射处理后。浸种24小时,然后置搪瓷盘上摊平催芽,上盖三层纱布保温,于20℃上培养,待根长1~2厘米时,切取顶端根尖5毫米左右于卡诺氏固定液0.5小时,然后换入70%酒精保存备用。
(二)解离:
(1)取70%酒精保存的根尖,冲洗后置入1N的盐酸中,室温处理20分钟,将酸冲洗干净备用。
(2)取出经固定的备用根尖,切取具分生组织部分约1~2毫米,(去除根冠和伸长区细胞)置1NHCl中解离10分钟。然后用蒸馏水洗尽材料上盐酸,准备制片和染色
(三)染色制片
取一枚经解离的蚕豆根尖,置载玻片正当中,两片载玻片呈十字形对压,然后揭开,在有材料的部位各滴上一小滴丙酸―铁矾苏木精(见实验一)染色,再用盖玻片压片(见实验一)。
(四)镜检:
观察有丝分裂细胞后期的染色体桥和染色体断片,间期细胞的微核。
七、实验作业
(1)交染色体结构变异的细胞学制片一张
(2)绘制经染色体结构变异处理所观察到的变异染色体,并说明变异特点。
实验六 染色体数目变异
一、实验目的
观察植物染色体数目的各种变异及其在有丝分裂过程中的细胞学特征。
二、实验原理
植物染色体数目一般为二倍体(2n),但是在自然条件下和人工条件下可以诱发染色体数目的变异。染色体数目变异分为整倍性变异和非整倍性变异。整倍性变异有同源多倍体变异和异源多倍体变异。非整倍性变异有单体、缺体、三体、四体等。由于染色体数目的变异可以导致有丝分裂和减数分裂过程出现不正常的细胞学行为以及形态特征的变化。
人工诱导多倍体的方法很多。用秋水仙碱诱发多倍体是常用而且是最有效方法。秋水仙碱是从秋水仙(Colchium autumnale. L.)器官和种子的提炼出来的一种植物碱,其化学分子式为C22H25O6N,有剧毒。其作用是阻止分裂细胞形成纺锤丝,使复制了的染色体不能分向两极,细胞也不能分裂成二个细胞,仍处于同一个细胞中,于是每个细胞内的染色体数目发生了加倍。成为多倍性细胞,进一步发育成多倍体植物。
多倍体诱变结果鉴定:
1.多倍体植物的个别部分如气孔、花器、种子、果实等明显增大,叶片肥厚,植株比二倍体高大,叶表皮组织气孔明显增大。
2.多倍体植物在减数分裂时,由于同源染色体联会和分离不正常,导致育性降低。
3.经诱变的多倍体植物有丝分裂时,可以染色体数目成倍增加。
三、实验材料:
蚕豆(Vicia faba, 2n=12)种子
洋葱(Alliumcepa, 2n=16)鳞茎
四、实验仪器及用具:
多媒体系统(带显微演示)、显微镜、培养箱、分析天平、水浴锅、酒精灯、剪刀(或刀片)、镊子、解剖针、载玻片、盖玻片、滤纸、铅笔、标签纸、胶水
五、药品和试剂
秋水仙碱、苏木精、水合三氯乙醛、铁铵矾、无水酒精、冰醋酸、1N盐酸、5%丙酸
六、实验步骤
(一)材料准备
取蚕豆干种子或洋葱鳞茎,经浸种催芽后,待根长1厘米左右时,吸干水分,将根部用0.1~0.2%秋水仙碱药液浸没,根尖朝下,20℃继续催芽生长,一直浸到根尖明显膨大时,(大约36~48小时),冲洗干净取下根尖0.5厘米部位,经卡诺氏固定液固定0.5~1小时,然后70%酒精保存。
(二)解离:
(1)取70%酒精保存的根尖,冲洗后置入1N的盐酸中,室温处理20分钟,将酸冲洗干净备用。
(2)取出经固定的备用根尖,切取具分生组织部分约1~2毫米,(去除根冠和伸长区细胞)置1NHCl中解离10分钟。然后用蒸馏水洗尽材料上盐酸,准备制片和染色
(三)染色制片
取一枚经解离的蚕豆根尖,置载玻片正当中,两片载玻片呈十字形对压,然后揭开,在有材料的部位各滴上一小滴丙酸―铁矾苏木精(见实验一)染色,再用盖玻片压片(见实验一)。
(四)镜检
观察有丝分裂中期和早后期细胞,并进行染色体计数。
七、作业
(1)交染色体数目变异的有丝分裂制片一张,
(2)绘制观察的染色体数目变异的形态并说明。
实验七 分离规律的验证
一、实验目的
通过一对相对性状的遗传杂交实验,分析杂种后代的性状表现,验证分离规律。
二、实验原理
在减数分裂形成配子时,同源染色体上的等位基因,随所在染色体的分离而分离。将具有一对相对性状差异的两个亲本杂交,其F1产生的雌雄配子各有两种,其比例为1:1,F2的表现型也是两种,其比例为3:1。
水稻的种子胚乳糯性和非糯性、玉米的籽粒黄色和白色及种子胚乳糯性和非糯性为一对相对性状,一般由单基因控制。例如:水稻种子非糯性(WxWx)品种与糯性(wxwx)品种杂交,其F1的种子表现为非糯性的杂合体(Wxwx),当其花粉母细胞减数分裂形成配子时,这对等位基因分离,形成含有基因Wx或wx的花粉粒,具有非糯性基因Wx,产生直链淀粉,遇碘液呈蓝色;具有糯性基因wx,产生支链淀粉,遇碘液呈棕色。这两种花粉粒在数量上的理论比例为1:1。F1的雌雄配子相互受精结合,形成F2种子的非糯性对糯性比例为3:1。
三、实验材料
水稻(Oryza sativa):糯性x非糯性 F1植株的花粉、 F2种子。
玉米(Zeamays):多79(黄色,非糯)x多67-1(白色,糯) F1自交的果穗。
四、实验用具
多媒体演示系统、显微镜、培养皿、载玻片、盖玻片、镊子、解剖针、玻棒、培养箱。
五、药品试剂
碘、碘化钾、酒精、冰醋酸。
1%碘—碘化钾溶液的配制:取2g碘化钾溶于5ml蒸馏水中,加入1g金属碘,待其溶解后再加入295ml蒸馏水,保存于棕色瓶中。
六、实验步骤
(一) 水稻
观察水稻花粉粒: 从糯稻x非糯稻的F1植株上取花药(水稻散粉前,把雄花序放入卡诺氏液固定,70%酒精中保存备用)一枚放在载玻片上,用镊子(或解剖针)将花粉粒压出,散开,加1滴1%碘-碘化钾液染色,盖上盖玻片。在低倍镜下(10 X 4倍)观察花粉粒的染色反应,并记录10个视野下蓝色与棕色的花粉粒数。
观察水稻F2种子胚乳性质的分离: 取糯稻x非糯稻杂种F2植株成熟的稻穗,晒干、脱粒、剥去颖壳,用目测法检测糯性与非糯性的米粒数。一般非糯性的米粒透明,有光泽,而糯性的米粒则呈乳白色,无光泽。如用肉眼难以区分,则可对各米粒的胚乳加1滴1%碘-碘化钾染色液区分,根据其棕色和蓝色的反应,分析记录糯性和非糯性的粒数。
(二)、玉米
观察玉米花粉粒: 从多79x多67-1的F1植株上取1枚花药(于散粉前,把雄花序放入卡诺氏液固定,70%酒精中保存备用),按观察水稻花粉粒的步骤观察。
玉米籽粒黄色和白色的分离及种子胚乳糯性和非糯性: 玉米籽粒黄色对白色为显性,胚乳非糯性对糯性为显性。每人取玉米杂合体F1植株上自交的果穗,按籽粒颜色及糯性计数各果穗上黄色粒数和白色数,非糯性粒数和糯性粒数。最后按各小组观察的数据汇总进行统计分析。
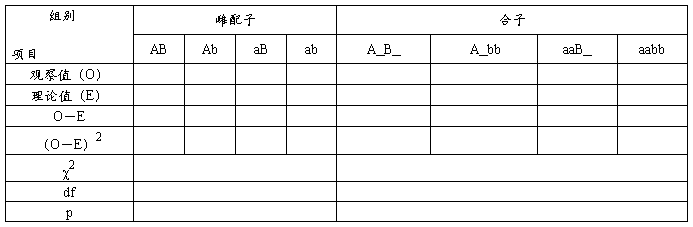
为了验证分离规律,对所观察的资料须按下式进行X2(卡方)测验。
X2=∑(O-E)2∕E
上式中,O:为实际观察数,E:为预期理论数,∑为各项总和。
求得X2值后,根据自由度df (即分离类型组数N减去1),查X2值表(附录),求出概率值P。再根据P值决定实得结果与理论数是否有显著差异。P<O.05,表示差异显著,实际观察值不符合预期理论数;如P>O.05,则表示差异不显著,即说明实际观察数符合预期理论数。
七、实验作业
1、上述各实验材料所获得的观察资料,全班汇总填表,然后分别进行X2 测验,根据自由度和估算的X2值,查阅X2值表,求其概率值P。
2、通过分析对各相对性状的遗传表现作出解释。
附:X2表

实验八 自由组合规律验证
一、实验目的
通过两对相对性状的遗传杂交实验,分析杂种后代的性状表现,验证独立分配规律。并了解基因互作的现象。
二、实验原理
在减数分裂过程中,位于非同源染色体上的两对等位基因在形成配子时,每对等位基因既随同源染色体的分离而分离,又随非同源染色体的重组而自由组合,形成四种基因型的配子,其比例相等。因此,两对基因的杂合体在完全显性的条件下,其自交子代的表现型分离比例为9:3:3:1,测交子代的表现型分离比例为1:1:1:1。如果基因间发生互作,则随着互作方式的不同,产生的表现型分离比例有所不同。
玉米籽粒是由果皮、胚乳和胚三部分组成,其中胚乳包括糊粉层和淀粉层。如图:
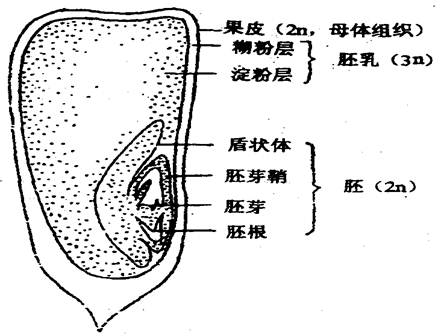
已知控制玉米籽粒各种性状的基因,具有下列的遗传表现。果皮颜色性状有红色、棕色和无色。在基本色素基因A1存在时,果皮颜色的表现一般是由P和BP两对基因互作的结果。
胚乳性状有非甜粒和甜粒,非甜粒外形饱满,甜籽粒外形皱缩。已知皱缩性状是受位于第6染色体上的隐性基因su所控制。
糊粉层颜色性状有紫色、红色和无色。它主要由7对基因 (花青素基因:Alal、A2a2、A3a3;糊粉粒色基因:Cc、Rr、PrPr;色素抑制基因:Ii) 所控制。只有当显性基因Al、A2、A3、C、R同时存在、而抑制基因又呈隐性纯合ii时,色素才能形成。而色素形成的类别是由Prpr决定的,当显性基因Pr存在时,呈现为紫色,当隐性基因纯合prpr存在时则表现为红色。当显性基因A1、A2、A3、C、R中缺少任何一个或所有这些色素基因均为显性,但当显性抑制基因I存在时,均表现为无色。
由于控制玉米籽粒、果皮和糊粉层颜色,以及胚乳性状的基因分别位于非同源染色体上,故这些性状的遗传表现为独立分配和基因互作现象。
三、实验材料
1.水稻植株
水稻(Oryza sativa):V20A(叶鞘有色、不育)、明恢77(叶鞘无色、可育)、V优77的F1、F2群体。
2.玉米果穗:
玉米(Zeamays)果穗:PC5-2 (淡黄色、非糯性、硬粒)
2041 (白色、糯性、硬粒)
PC5-2 × 20## F1植株的自交果穗;
用于观察基因互作的不同杂交组合的果穗材料。
四、实验用具
计算器、计数器。
五、实验步骤
(一)自由组合规律验证
配制玉米自交系PC5-2和自交系2041,将自交系(PC5-2×20414)杂交,产生杂交F1植株的自交果穗,观察果穗上籽粒性状的分离现象。每一果穗的籽粒表现是:有色、非糯,有色、糯性,白色、非糯,白色、糯性,四种表现型。每位(或两位)同学统计一果穗,各组统计实验结果,最后全班汇总,进行X2测验。
(二)观察基因互作现象
1 互补作用:
1)玉米果穗:由于A、C、R中缺少任何一个色素显性基因,籽粒均为无色。因而将籽粒无色、基因型分别为aaCCRR、AAccRR或AACCrr亲本间杂交,例如aaCCRR×AAccRR产生F1为AaCcRR,由于显性基因A和C的互补作用,其F1籽粒表现有色。让F1植株自交产生果穗,观察果穗上F2籽粒的分离现象,按有色和无色两种表现型记数,其F2籽粒色的分离比例为9有色(9A C RR):7无色(3aaCcRR+3AaccRR+1aaccRR)。
2)水稻植株:V优77叶鞘色由两对基因互作控制,F1植株表现为有色,F2叶鞘色分离为紫色和无色。播F2种子,光照培养至4叶期,观察叶鞘色分离现象。按紫色和无色两种表现型记数,其F2叶鞘色分离比例为9紫色:7无色。
2 抑制作用: 将有色籽粒Ccii与无色籽粒ccII的亲本杂交,产生F1的自交果穗。然后观察果穗上籽粒性状的分离现象,按无色和有色两种表现型记数。上述组合中,由于抑制基因I能抑制所有色素基因的表达,故其双亲虽均具有纯合的A和R基因,但其F1的自交果穗籽粒的性状表现为13无色(9C I+3ccI +lccii):3有色(3C ii)。
3 隐性上位作用
糊粉层颜色: 将玉米籽粒糊粉层颜色表现为紫色的亲本(CCPrPr)与无色的亲本(ccprpr)杂交,产生F1的自交果穗。观察统计 F1的果穗上籽粒糊粉层颜色的分离现象。由于cc隐性纯合基因对产生紫色糊粉层的基因Pr具有隐性上位作用,故F1植株(CcPrpr)的自交果穗上的籽粒糊粉层颜色的分离比例为9紫色(9C Pr ):3红色(3C_prpr):4无色(3ccPr +lccprpr)。
六、实验作业
(一)、观察上述各杂交实验的性状分离和重组的表现型,并写出它们的基因型。各
实验观察结果分别按下表填写和分析。
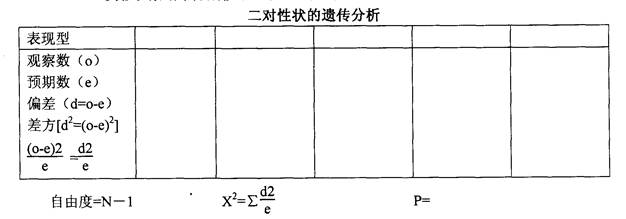
(二)、对以上各实验结果进行X2测验,从而对各性状的遗传表现作出解释。
1、 验证自由组合规律。
2. 观察基因互补现象
(1)、互作作用
(2)、抑制作用
(3)、隐性上位作用
实验九 概率和统计原理如遗传研究中的应用
一、实验目的
1、验证概率原理,建立概率和统计的思想。
2、加深理解概率原理在孟德尔遗传规律中的作用。
3、学会应用卡平方测验的方法来检验遗传实验中观察值与理论值之间的符合度。
二、实验材料
面值一角或五角的硬币各一枚(学生自备)。
三、实验说明
(一)基本概念
1、频率与概率:在N次试验中,若事件A共发生n次,则比值n/N就称为事件A的频率。记为fA,它定量地表示了事件A发生的可能性的大小。频率的缺点是不稳定,会上下波动。不过当试验次数N趋于无穷大时,频率fA就趋于一个固定的常数P(A),这就是事件A发生的概率。所以,概率是频率的极限值。由于实际上我们不可能进行无穷次试验,因此概率只能从理论上推得,但我们可以通过有限次试验所得到的频率,来验证概率的真实性。
2、事件的独立性与不相容性:一事件的发生同另一事件的发生无关,称为事件的独立性;一个事件的发生并不包含另一个事件的发生,称为事件的不相容性。
3、概率的两个重要定理:
(1)加法定理:两个互不相容事件(A和B)组成的复合事件的发生概率等于两事件各自概率之和,即P(A+B)=P(A)+P(B)。另外,事件总体的概率总是为1。
(2)乘法定理:两个相互独立事件(A和B)同时发生的概率等于两事件各自概率之和,即P(A·B)=P(A)·P(B)。
(二)实验原理
从数学观点看,基因的分离和重组不过是一些微观的随机事件,本质上是概率问题。因此,我们可以利用一些宏观的随机事件来直观地模拟基因的分离和重组,从而加深对孟德尔遗传规律的理解。
(三)χ2测验(卡平方测验)
在遗传实验中,实际观察值一般不会跟理论值完全一致。例如就一对性状的分离而言,若实际共观察100株,则根据分离定律理论上应有显性75株,隐性25株,但实际情况可能是显性80株,隐性20株。现在问题是,这些观察值与理论值的偏差,到底是属于随机误差,还是反映了这一对性状根本就不符合分离?为此,就要进行统计学的符合度测验。常用的是χ2测验法,其计算公式为:
(o-e)2 d2
χ2 =Σ——————=Σ——
e e
上式中:o为实际观察数;e为预期理论数;d= (o- e )2 ,d为实际观察数和预期理论值的差数。 Σ 为各项总和。χ2 的自由度df(即分离类型组数N减去1)=K-1。在上例中,有df=2-1=1。根据自由度,可从χ2分布表(附录1)查出χ2 的概率范围。一般要求χ2 的概率P>0.05时,才认为观察值与理论值是相符的,亦即它们之间的偏差属于随机误差。
四、实验方法
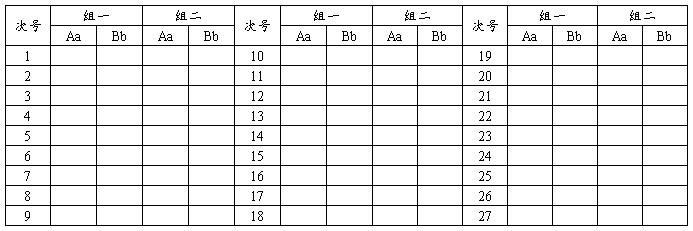
(一)实验操作与结果记录
同时随机地抛掷一角和伍角硬币每次抛币结果记入“抛币试验结果登记表”。分两组进行,每组抛币120次。抛币结果的登记符号为:
一角硬币:字面朝上A 画面朝上a
伍角硬币:字面朝上B 画面朝上b
(二)实验结果的统计分析
将第一组视为雌配子,第二组视为雄配子,并将同一次的雌雄配子组合成一个合子。这样,就可进行如下分析:
1、概率原理在分离规律中的作用
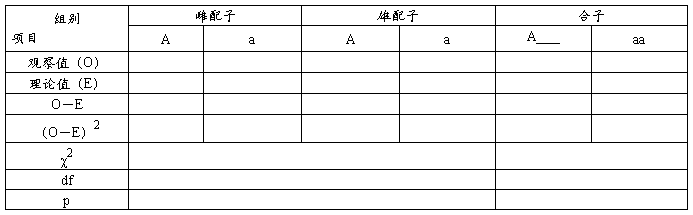
结论:
结果分析提示:(1)一对等位基因Aa在形成配子时,随机分离,因而对任一配子而言,含有A或a的机会相等。概率皆为1/2。结果在产生配子总数中,A配子与a配子数量均等。
(2)雌、雄配子的形成是相互独立的,结合也是随机的。因此,根据概率乘法定理,各种类型的合子的概率应是:
P(AA)=P(A)?P(A)=1/2×1/2=1/4
=P(A)?P(a)=1/2×1/2=1/4
=P(a)?P(A)=1/2×1/2=1/4
P(aa)=P(a)?P(a)=1/2×1/2=1/4
又根据概率加法定理,有
P(A )=P(AA+Aa+aA)
=P(AA)+P(Aa)+P(aA)
=1/4+1/4+1/4=3/4
所以,后代表型比例应为A :aa=3:1
2、概率原理在独立分配规律中的作用
结论:
结果分析提示:(1)两对相互独立的等位基因在形成配子时,每对基因各自随机分离,互不干扰,从而非等位基因在进入一个配子时能自由组合,每种概率皆为1/2×1/2=1/4,所以形成的四种根子完全等量。(2)四种雌、雄配子的结合也是完全随机的,每种结合类型的概率都是1/4×1/4=1/16。按表现型归类,就可得到9︰3︰3︰1的比例。
五、作业
统计实验数据并进行χ2测验,作出分析,写出实验报告
抛币试验结果登记表
实验十 数量性状的遗传分析
一、实验目的
学习统计分析数量性状遗传试验的数据,估算遗传率。
二、实验原理
数量性状受多基因控制,且各基因间的关系复杂,因此进行数量性状遗传分析时,往往从一对基因(如A,a)的遗传模型及其基因效应分析着手。现根据加性-显性遗传模型,假设纯合型AA和aa的加性效应值分别为d和-d,中亲值(m)为[d+(-d)]/2=0,由杂合体Aa的显性作用所引起的显性偏差为h,则其基因的作用效应可分解为:
 纯合型(AA和aa,其加性效应值分别为d和-d)
纯合型(AA和aa,其加性效应值分别为d和-d)
加性效应
 等位基因间
等位基因间
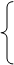 无显性(h=0)
无显性(h=0)
 基因作用效应 杂合型 部分显性(-d﹤h﹤d)
基因作用效应 杂合型 部分显性(-d﹤h﹤d)
完全显性(h=d或h=-d) 非加性效应
超显性(h﹥d或h﹤-d)
非等位基因间………………………上位性
由于数量性状的表现是由基因型和环境两方面决定的,假定基因型与环境之间没有相关和互作,则群体的表现型方差(VP)应为基因型方差(VG)和环境方差(VE)之和:
Vp= VG+ VE
基因型方差是由加性方差(Vd)、显性方差(Vh)和非等位基因间的上位性方差(Vi)所组成,故上式可进一步列为:
VP=Vd+Vh +Vi +VE
根据F2、B1(F1×P1)、B2(F1×P2)群体的方差组成分析为:
VF2=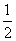 D+
D+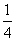 H+VE
H+VE
上列二式相减,可求得VB1 +VB2 =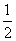 D+
D+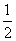 H+2VE
H+2VE
F2的基因加性方差为:Vd =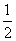 D=2VF2 -(VB1 +VB2)
D=2VF2 -(VB1 +VB2)
式中D=Σd2,是各基因加性效应方差的总和;H=Σh2 是各基因显性偏差方差的总和。
根据上述群体方差的组成分析,可统计分析数量性状遗传试验的数据,并按公式估算遗传率。
三、实验材料
1.玉米果穗长度的遗传试验材料:将P1(PC-5,长果穗)、P2(2041,短果穗)及其杂种后代F1、F2、回交后代B1、B2于同年种植,收获后分别按世代测量记录果穗长度。
2.水稻生育期、棉花纤维长度的遗传试验资料。
四、实验仪器
计算器、尺子。
五、实验步骤
1、基本参数的计算
(1)计算各世代的平均数( )、方差(V)及标准差(S) 将本实验所附已经分组整理的水稻生育期、棉花纤维长度次数表,按下列公式分别计算各世代的基本参数。
)、方差(V)及标准差(S) 将本实验所附已经分组整理的水稻生育期、棉花纤维长度次数表,按下列公式分别计算各世代的基本参数。
平均数 =
= 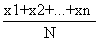 =
= 
或 =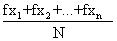 =
=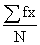
V= =
=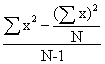
或 =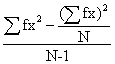
 S=
S=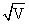
式中x指个体值或指分组的各组值;f指分组的各组次数;N指所观察的个体数。
(2)计算环境方差(VE) F2的环境方差一般可根据不同情况采用下列方法估算:
VE=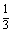 (VP1+VP2 +VF1)
(VP1+VP2 +VF1)
或 =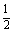 (VP1+VP2) (适用于无F1数据)
(VP1+VP2) (适用于无F1数据)
或 = VF1 (适用与异花授粉作物)
2、遗传率的估算 遗传率是指一个群体内某数量性状由于遗传原因引起的变异在表现变异中所占的比值。广义遗传率(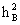 )指基因型方差占表现型方差的比值;狭义遗传率(
)指基因型方差占表现型方差的比值;狭义遗传率( )指加性方差占表现型方差的比值。
)指加性方差占表现型方差的比值。
(1)广义遗传率(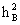 )
)
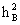 =
=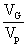 ×100%=
×100%=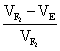 ×100% =
×100% =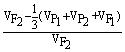 ×100%
×100%
如供试材料为异花授粉作物,可用下式估算:
 =
=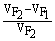 ×100%
×100%
(2)狭义遗传率( )
)
 =
=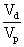 ×100%=
×100%=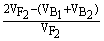 ×100%
×100%
六、实验作业
根据本实验测量各世代玉米果穗材料的长度或水稻生育期和棉花纤维长度的试验材料,分别估算该性状的广义遗传率、狭义遗传率。
实验十一 杂种优势现象的观察
一、实验目的
通过实验增加杂种优势现象的感性认识并掌握杂种优势的评估方法
二、实验原理
杂种优势是指杂种一代(F1)在产量、品质、生活力、生长势、抗逆性和适应性等方面比其双亲及其子代优越的现象。杂种优势原理通常用显性学说和超显性学说解释,但这两者都不能完善地解释杂种优势原理。一般概括地说,杂种优势可能是由于双亲显性基因的互补、异质等位基因互作和非等位基因互作的单一作用,也可能是由于这些因素的综合作用。同时杂种优势也不是一、二个性状的突出优势,而是许多单位性状的优势的综合表现。
形成杂种优势必须具备两个重要条件:第一,杂交亲本的基因型应高度纯合;第二,杂交亲本的遗传差异大,且能相互补充。评价杂种优势大小的指标有平均优势、超亲优势、竞争优势、显性势能等。
三、实验材料
玉米自交系,自交系之间的杂交种及对照种的穗。
四、仪器用具
尺子,托盘天平,计算器
五、实验步骤
1、 以小组为单位,分别观察比较亲本、F1和对照相互之间在性状上的差异。
2、 分别调查上述群体的穗长、穗重,并将结果记录下来。
3、 根据调查结果,按照下述公式,分别计算F1代杂种优势的程度。
平均优势:F1代均值与双亲均值的比较,用百分数表示。
平均优势(%)=(F1-MP)/MP ×100
超亲优势:F1代均值同较好的一个亲本均值作比较所呈现出的优势。
超亲优势(%)=(F1-HP)/HP×100
竞争优势:F1代同对照种比较所呈现出来的优势。
竞争优势(%)=(F1-CK)/CK×100
优势指数:F1代均值与双亲均值的比较,用比值形式表示。
优势指数(IH)= F1/MP
显性势能或相对优势:将一对杂合基因的显性效应h与一对纯合基因的加性效应d相比较,用以表示显性程度的相对大小。显性与优势是同一遗传现象的不同程度的表现。假定个体中所有各对显性(或隐性)基因的d大小相等,方向相同,同时假定所有对杂合基因的作用h也是大小相等,方向相同,则显性势能hp为:
hp=[F1-(P1+P2)/2] / [(P1-P2)/2]
hp=+0.05——+0.5,无显性;
hp=+0.6——+0.95,无显性;
hp=+0.96——+1.05,无显性;
hp>+1.06,hp<-1.06, 正负超显性(优势)。
六、实验作业
1.根据观察和计算,说明杂种一代(F1)和其亲本在表现型上有什么不同,主要在哪些方面表现了优势。
2.求平均优势,超亲优势,竞争优势,优势指数和显性势能。
实验十二 人类ABO血型检查
一、实验目的
了解基因座位(locus)和基因位点(site)的关系,基因突变、复等位基因、基因共显性概念及基因频率的分布。
二、实验原理
血液的组成是:
 血浆:优良溶剂,含蛋白质、葡萄糖、无机盐、代谢产物、O2、CO2
血浆:优良溶剂,含蛋白质、葡萄糖、无机盐、代谢产物、O2、CO2
 血液 红细胞:含血红蛋白,容易和O2和CO2结合
血液 红细胞:含血红蛋白,容易和O2和CO2结合
血细胞 白细胞:具免疫(淋巴细胞),吞噬机能
血小板:止血,凝血
血型:指红细胞上所含抗原的不同,应用抗原与抗体的反应,产生凝集与否,对血型进行判断:
A型:红细胞上具有A抗原,能与特异性抗体A发生凝集反应,而不与B抗体发生凝集反应。
B型:红细胞上具有B抗原,与特异性抗体B发生凝集反应,而不与A抗体发生凝集反应
AB型:红细胞上具有A抗原和B抗原,既与抗体A发生凝集反应,也与抗体B发生凝集反应
O型:红细胞上缺乏A抗原,也缺乏B抗原,均不与抗体A或抗体B发生凝集反应。
三、实验材料
参试人员的手指毛细管血液两滴
四、仪器药品
显微镜、载玻片、抗A、抗B、消毒药棉、70%乙醇、一次性采血针
五、实验步骤
1.在载玻片上划分两格,分别标明A与B,如下图:

2.在A处滴加抗A标准血清一滴,在B处加抗B标准血清一滴;
3.用70%酒精药棉消毒手指采血部位(一般为无名指末端),再用此药棉消毒一次性采血针;
4.用采血针刺手指,挤出血液;
5.一滴血液滴在加抗A血清处,另一滴血液滴在加抗B血清处;
6. 分别用采血针调匀,调匀一处血液后揩擦采血针,再调另一处;
7.两分钟内肉眼观察反应结果,或用最低倍显微镜观察其凝聚的情况,反之可能产生假凝集现象。
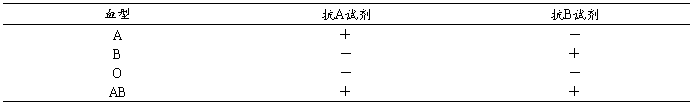
+:表示凝集反应;-:表示无凝集反应
六、作业
1. 实验报告;
2. 表述全班ABO血型频率。
实验十三 同功酶遗传标记分析
一、实验目的
1.掌握聚丙烯酰胺凝胶电泳技术
2.同工酶遗传标记的分析
二、实验原理
同工酶是一类由具有不同分子结构和大小但具有相同催化功能的酶。同工酶分子的多种形式是由基因决定的,也即同工酶是基因表达的直接产物。由同一基因座的不同等位基因编码的各种同工酶又称为等位酶,它们从分子水平上反映了等位基因的相对差异。因此,同工酶不仅是一种生理生化指标,而且也是一种可靠的遗传标记。
在同工酶分析和鉴定中,电泳法是最为广泛应用,它能简便、快捷地分离某类酶的各同工酶组分,而不破坏酶的活力。电泳的支持介质——聚丙烯酰胺是目前最常用的。是由丙烯酰胺单体和交联剂甲叉双丙烯酰胺在催化剂的作用下聚合成含酰胺基侧链的脂肪族长链,相邻的两个链通过甲叉桥交链起来,链纵横交错,形成三维网状结构。丙烯酰胺的单体和双体的聚合有两种类型,一种是化学聚合,常采用过硫酸胺——四甲基乙二胺(TEMED)催化系统。过硫酸胺是引发基团,供给游离氧基,TEMED是催化加速剂。另一种是光照聚合。常采用核黄素——TEMED催化系统。核黄素在光下形成无色基,TEMED放氧再氧化,产生自由基,从而引发聚合作用。制备丙烯酰胺凝胶时其凝胶的孔径由凝胶浓度(100毫升凝胶溶液中含有单体和交联剂总克数)决定。当采用垂直平板不连续聚丙烯酰胺凝胶电泳体系时,一般上层是大孔径的浓缩胶(pH 6.7),下层为小孔径的分离胶(pH 8.9),电泳缓冲液为Tris-甘氨酸缓冲液(pH 8.3)。在这种不连续系统里,存在着电荷效应,分子筛效应和浓缩效应。蛋白质(酶)按其电荷效应和分子筛效应而被分离在凝胶的不同位置上。用此凝胶板与酶反应底物进行催化反应,再用生物染料染色便形成肉眼可见各种酶带。
酯酶同工酶谱带的差异,反映了基因产物的差异,据研究认为以萘乙酸酯为底物的同工酶属于羧基的酯酶类,为单体或二聚体的蛋白质。酯酶同工酶中也存在等位酶,表现出共显性的遗传特性。因此,酯酶同工酶可以作为孟德尔遗传的一种分子标记。
本实验所用的材料为我省种植面积较大的水稻特优63的材料,其父母本和杂种F1酶带有差异。酶带的差异反映其基因型的差别。父本和母本有两条酶带上的差别,杂种F1是双亲这两条酶带的互补带。
如图:
负 极 父 本 母 本 F1



 正 极
正 极
水稻酯酶同工酶主要酶带
三、实验材料
水稻(Oryza Sativa):龙特浦A、明恢63,特优63(F1),F2四种植株群体的幼苗
四、仪器用具
电泳仪,电泳槽,离心机,冰箱,移液管
五、药品试剂
丙烯酰胺、甲叉双丙烯酰胺、Tris、甘氨酸、过硫酸铵、核黄素、磷酸二氢钠、磷酸氢二钠、 HCl、蔗糖、乙醇、丙酮、维生素C、半胱氨酸、MgCl2、硫基乙醇、TEMED、溴酚兰、坚牢蓝RR、α~萘酯
六、实验步骤
(一)溶液配制
1. 样品提取液
0.35M蔗糖、5mM vit c、3mM半胱氨酸、1mM MgCl2、5mM硫基乙酸、50mM Tris。
2. 分离胶(A:B:C:D=1:2:1:4)pH 8.9
A、甲液(100ml)
三羟甲基氨基甲烷(Tris) 36.6g
四甲基乙二胺(TEMED) 0.46ml
1N HCl 48ml(84ml浓HCl定容至1000ml成1N HCl)
B、丙液(100ml)
丙烯酰胺(Acr)28.0g
甲叉双丙烯酰胺(Bis)0.753g
C、蒸馏水
D、0.28%过硫酸胺(现用现配)
3. 浓缩胶(a:b:c:d=1:2:1:4)
a、乙液(100ml)pH 6.7
三羟甲基氨基甲烷(Tris) 5.98g
四甲基乙二胺(TEMED) 0.46ml
1N HCl 48ml
b、丁液(100ml)
丙烯酰胺(Acr)10.0g
甲叉双丙烯酰胺(Bis)2.5g
c、戊液(100ml)
核黄素 4mg
d、己液(100ml)
蔗糖 40g
4. 电泳缓冲液母液(pH8.3)1000ml
Tris 6.0g
甘氨酸 28.8g
用时稀释10倍
5. 前沿指示剂
溴酚蓝 1%
6. 磷酸缓冲液
0.2M Na2HPO4
0.2M NaH2PO4
7. 染色液(酯酶)
磷酸缓冲液(pH6.4)90ml
坚牢蓝RR 0.1g
1% α-萘酯 10ml(以少许丙酮溶解后,用80%酒精配制)
(二)操作步骤
1. 清洗:玻璃板、橡胶密封圈、电泳槽
2. 装板:将高、矮玻璃板各一片,矮板嵌入橡胶圈内圈,高板装在外圈
3. 装槽:将装好的玻璃各两组装到电泳槽上,两高玻璃板相对,两矮玻璃板朝外,旋紧螺丝,防止漏胶。
4. 封边:用滚烫的2%琼脂沿高玻璃板的底边灌注约0.5-1.0厘米。
5. 配灌分离胶:按溶液A:B:C:D=1:2:1:4比例(胶浓度=7.2%)配制分离胶,混合均匀,不要有气泡,沿着玻璃板壁缓缓倒入电泳槽上的玻璃板夹层里到一定的高度。
6. 隔氧:在上述分离胶上立即滴一层蒸馏水,隔绝空气,促进聚合。
7. 分离胶化学聚合:分离胶在28℃左右约30~40min可聚合,可透过玻璃看到胶与水之间出现界面时,表明凝胶已聚合好。
8. 配灌浓缩胶:分离胶聚合后,吸去上部的水分,按溶液a:b:c:d=1:2:1:4比例(胶浓度=3.1%),配制浓缩胶,混合均匀,灌入玻璃板夹层到顶部。
9. 制备加样口:将1mm厚的“样品梳子”(50个板品)插入浓缩胶溶液中。
10. 浓缩胶光照聚合:将灌制好的凝胶板置于自然光照条件下(或40W日光灯下)聚合1小时左右。直到界面出现乳白色,说明浓缩胶已聚合好。
11. 制备样品:取2厘米左右的水稻幼苗于0.5ml的Eppendorff管中,加入样品提液70~80ml,用捣样器捣烂后,离心后置冰箱备用,每组制备龙特浦A、明恢63、F1各5株样品,F2样品85株。(制备的每个样品插于塑料泡沫内)。
12. 加样:将浓缩胶上端的“样品梳”小心取出(若样品孔中有多余水份,用注射针吸干),每一样品孔,按顺序用移液枪加入15μl的上述制备的样品。
13. 稳压稳流电泳:在电泳槽的内层(正极)和外槽(负极)应加入Tris-甘氨酸电泳缓冲液(母液稀释10倍),负极方向的电泳缓冲液量应超过其玻璃板(矮板),电泳槽的正负极与电泳仪的正负极要对应连接。插上电源,调整电压到220v,并使之处于稳流状态。在电泳槽的负极处滴两滴1%溴酚兰,作为电泳的前沿指示剂。待前沿指示剂离凝胶板底部1厘米时,停止电泳,即调整电压到0点,关掉电源开关,取下电泳槽的电极连线。
14. 卸凝胶板:倒去电泳槽中的电泳缓冲液,旋松螺丝,卸下两组玻璃凝胶板,去掉橡胶密封。
15. 剥离分离板:轻轻撬开每组玻璃凝胶板的高低两片玻璃,去除凝胶板中的上部浓缩胶和底部的封边琼脂。小心剥离分离胶于染色缸中,或将带分离胶玻璃板浸泡于清水中,利用水的浮力剥离分离胶。然后再将凝胶小心滑入染色缸中。
16. 染色:将0.2M磷酸缓冲液(pH6.4)90ml和1%α-萘酯10ml倒入染色缸中。37℃轻轻振荡,让分离胶与底物充分接触起酶促反应,10分钟后加入生物染色剂坚牢蓝RR 100mg,继续振荡,直到酶带清晰为止(染色不要过长)。
17. 观察纪录:染色好的凝胶倒去染色液,用清水洗3~4遍,置于透光箱上观察酯酶同工酶的酶带,及其变化情况。
六、作业
1. 绘出各种样品中酯酶同工酶谱,并说明酶谱差异;
2. 分析F2酯酶同工酶标记的遗传分布及其规律。
实验十四 人类性状的遗传分析
一、实验目的
人类是随机交配的群体,其性状的表现反映出群体的遗传组成,从群体性状的遗传分析,可以了解不同种族(民族)的基因频率和基因型频率。以期了解控制不同性状的基因的分布情况。
二、实验原理
人类性状的遗传可以区分为两大类:
(1)单对基因遗传:单对基因遗传是指某一性状的表現,是由一对基因所決定。
(2)多对基因遗传。多对基因遗传是指某一性状的表現,是由二对或二对以上的基因所決定。
人类的ABO血型是单对基因遗传,不过控制血型的基因則有三种:IA、IB及i,其中IA和IB分別对i为性。例如基因型为IAIA或IAi者,血型为A型;IBIB或IBi者为B型;而ii者为O型。特別一提的是IA和IB都为显性,所以基因型为IAIB者,血型为AB型。
人类的身高、体重或皮肤色泽的深浅,则是多对基因遗传。例如皮肤的色泽是由两对基因(A,a和B,b)所控制,显性基因A和B会使皮肤內黑色素的量增加,二者的影响相同且可以累加,因此其显性基因越多的人,肤色越深。
在自然界,无论动植物一种性别的任何一个个体有同样的机会与其相反性别的任何一个个体交配。假设某一位点有一对等位基因A和a,A基因在群体出现的频率为p,a基因在群体出现的频率为q;基因型AA在群体出现的频率为D,基因型Aa在群体出现的频率为H,基因型aa在群体出现的频率为R。群体(D,H,R)交配是完全随机的,那么这一群体基因频率和基因型频率的关系是:
D=p2 H=2pq R=q2
这说明任何一物种的所有个体,只要能随机交配,基因频率很难发生变化,物种能保持相对稳定性。根椐遗传平衡定律,可以对人类群体进行基因频率的分析。
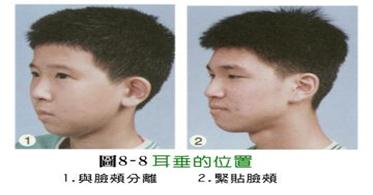
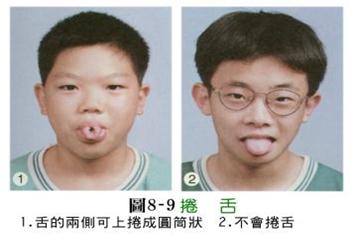
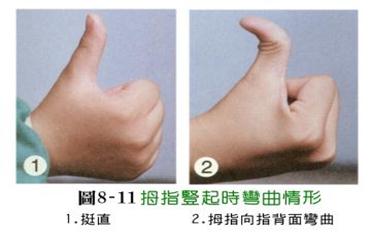
表一 人类单对基因遗传的实例

单对基因控制性状的显隐性表型:
左:显性 右:隐性

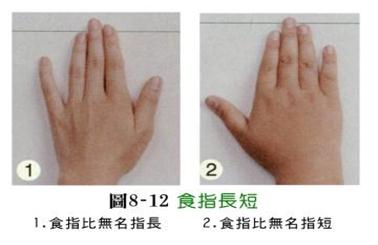
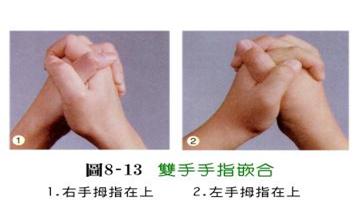


三、实验材料
以班级的每一位同学的8种性状作为研究小群体。
四、实验用具:笔和纸
五、实验步骤
1.以10个人为一组,由小组长观察上述的前8个单对基因控制性状的表现,并作记录。
2.统计全班(年段)的资料,进行基因频率和基因型频率的计算。
计算公式:D+H=p2+2pq R=q2
六、作业
上交8种性状的基因频率和基因型频率。
