溶胶的制备与电泳
一、实验目的
1.学会溶胶制备的基本原理,并掌握溶胶制备的主要方法。
2.利用界面电泳法测定AgI溶胶的电动电位。
二、实验原理
溶胶是溶解度极小的固体在液体中高度分散所形成的胶态体系,其颗粒直径变动在范围。
1.溶胶制备
要制备出稳定的溶胶一般需满足两个条件:固体分散相的质点大小必须在胶体分度的范围内;固体分散质点在液体介质中要保持分散不聚结,为此,一般需要加稳定剂。
制备溶胶原则上有两种方法:将大块固体分割到胶体分散度的大小,此法称为分散法;使小分子或粒子聚集成胶体大小,此法称为凝聚法。
(1)分散法
分散法主要有3种方式,即机械研磨、超声分散和胶溶分散。
①研磨法:常用的设备主要有胶体磨和球磨机等。胶体磨由两片靠得很近的盘或 磨刀,均由坚硬耐磨的合金或碳化硅制成。当上下两磨盘以高速反向转动时(转速约 5000-10000rpm),粗粒子就被磨细。在机械磨中胶体研磨的效率较高,但一般只能将质点 磨细到 1um 左右。
②超声分散法;频率高于 16000Hz 的声波称为超声波,高频率的超声波传入介质, 在介质中产生相同频率的疏密交替,对分散相产生很大的撕碎力,从而达到分散效果。 此法操作简单,效率高,经常用作胶体分散及乳状液制备 。
③胶溶法:胶溶法是把暂时聚集在一起的胶体粒子重新分散而成溶胶。例如,氢氧 化铁、氢氧化铝等的沉淀实际上是胶体质点的聚集体,由于制备时缺少稳定剂,故胶体 质点聚在一起而沉淀。此时若加入少量的电解质,胶体质点因吸附离子而带电,沉淀就 会在适当的搅拌下重新分散成胶体。
有时质点聚集成沉淀是因为电解质过多,设法洗去过量的电解质也会使沉淀转化成溶胶。利用这些方法使沉淀转化成溶胶的过程成为胶溶作用。胶溶作用只能用于新鲜的沉淀。若沉淀放置过久,小粒经过老化,出现粒子间的连接或变化成大的粒子,就不能利用胶溶作用来达到重新分散的目的。
(2)凝聚法
主要有化学反应法及更换介质法,此法的基本原则是形成分子分散的过饱和溶液,控制条件,使形成的不溶物颗粒大小在溶胶分散度内。此法与分散度相比不仅在能量上 有限,而且可以制成高分散度的胶体。
①化学反应法:凡能形成不溶物的复分解反应、水化反应以及氧化还原反应等皆可用来制备溶胶。由于离子的浓度对胶体的稳定性有直接的影响,在制备溶胶时要注意控 制电解质的浓度。
②改换介质法:此法系利用同一物质在不同溶剂中溶解度相差悬殊的特性,使溶解 于良溶剂中的溶质,在加入不良溶剂后,因其溶解度下降而以胶体粒子的大小析出,形 成溶胶。此法作溶胶方法简便,但得到的溶胶粒子不太细。
2.溶胶的电泳
在电场的作用下,胶体粒子向正极或负极移动的现象叫电泳。电泳现象粒子的带电性。胶体粒子带电是因为在其周围形成了扩散双电层。按对固体的关系,扩散双电层离子可沿滑动面分为吸附层离子和扩散层离子两部分,使固体表面和分散介质之间有电势差,即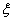 电势。
电势。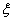 电势的大小可通过电泳试验测得。
电势的大小可通过电泳试验测得。
在外电场的作用下,根据胶体粒子的相对运动速度计算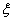 电势的基本是
电势的基本是
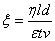
式中:
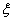 ——胶体粒子的电动电势(
——胶体粒子的电动电势(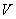 );
);
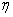 ——介质的动力粘度(
——介质的动力粘度(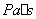 );
);
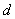 ——溶胶界面移动的距离(
——溶胶界面移动的距离( );
);
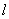 ——两电极之间的距离(
——两电极之间的距离( );
);
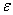 ——介电常数(
——介电常数(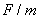 );
);
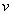 ——两极间的电位差(
——两极间的电位差(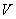 );
);
 ——电泳进行的时间(
——电泳进行的时间(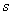 );
);
利用电泳测定电动势有宏观法和微观法:宏观法是观察在电泳管内溶胶与辅助液间界面在电场作用下的移动速度;微观法借助于超显微镜观察单个胶体粒子在电场作用下的移动速度。本试验用宏观法测定,如图1所示。
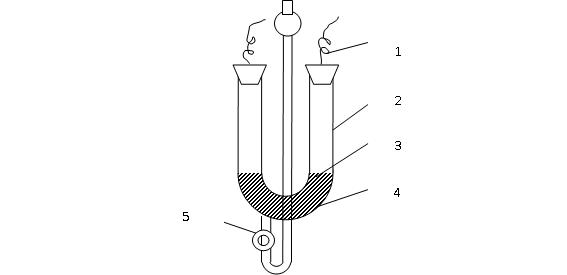
图1 电泳管示意图
1.电极;2.辅助液;3.界面;4.溶胶5.活塞
三、仪器与药品
1.仪器
电泳仪,电导率仪,电炉,秒表,电极2支,100mL烧杯2个,50mL、150mL、250mL 、500mL、烧杯各1个,滴定管2个,滴管1个,10mL量筒2个,250mL量筒1个,100mL、500mL锥形瓶各2个,试管2支,漏斗2个,洗瓶1个。
2.药品
20%FeCl3,3%FeCl3, 0.02mol/L AgNO3, 0.02mol/L KI, 0.1mol/LAgNO3, 10%NH3,水,0.01mol/L KCl, 2%松香乙醇溶液,火棉胶。
四、实验步骤
(一)溶胶的制备
1.胶溶法
氢氧化铁溶胶的制备:取10毫升20%氯化铁放在小烧杯中,加水稀释到100毫升然后用滴管逐滴加入10%氨水到稍微过量为止。过滤生成的氢氧化铁沉淀,用蒸馏水洗涤数次。将沉淀放入一烧杯中,加10毫升蒸馏水,再用滴管滴加约10滴20%氯化铁溶液,并用小火加热,最后得到棕红色透明的氢氧化铁溶胶。
2.改换介质法
松香溶胶的制备:配制2%的松香乙醇溶液,用滴管将溶液逐滴滴入到盛有蒸馏水的烧杯中,同时剧烈搅拌,可得到半透明的溶胶。如果发现有较大的质点,需将溶胶再过滤一次。
3.化学反应法
(1)氢氧化铁的溶胶制备:再一个250mL的烧杯中加入150mL蒸馏水并加热至沸腾,在不断搅拌下滴加8毫升3%的氯化铁溶液,溶液变成暗棕红色的氢氧化铁胶体。然后对此溶胶进行渗析,除去多余的电解质。渗析的方法是按下列步骤先做一个渗析用的火棉胶袋:将一个500毫升的锥形瓶洗净烘干,将火棉胶液倒入锥形瓶中,倾斜锥形瓶并慢慢的移动,使锥形瓶内均匀地涂上一层胶液,然后倒出火棉胶。当火棉胶干后,将瓶口的胶膜剥离开一小部分。从此剥离口慢慢的加入蒸馏水,胶带逐渐与瓶壁剥离,取出胶袋,再蒸馏水中浸泡数小时。
将上面制备的氢氧化铁溶胶倒入火棉胶袋,并悬挂在盛有蒸馏水的大烧杯中,每小时换一次蒸馏水,直到用0.1mol/L硝酸银溶液检验无氯渗析便可结束。
(2)碘化银溶胶的制备:在两个锥形瓶中分别准确的加入5mL0.02mol/L KI和0.02mol/L硝酸银溶液,在盛有KI溶液的瓶中在搅拌下再准确地滴加4.5mL0.02mol/L硝酸银溶液。在另一盛有硝酸银溶液的瓶中再准确的滴加4.5ml0.02mol/L KI溶液。观察两锥形瓶中AgI溶胶透射光及散射光颜色。
(二)AgI溶胶的电泳
1.AgI负溶胶的制备
在400ml的烧杯中加入100ml0.01mol/L的K溶液,搅拌下用滴定管加入95ml0.01mol/L的AgNO3溶液即制的AgI负溶胶
2.辅助液的制备
先测定溶胶的电导率。用少量溶胶将试管及电导率池洗3次,在试管中加入适量溶胶,插入导电池,测定室温下溶胶电导率。向 0.01mol/L KI溶液中加蒸馏水至其电导 率与溶胶相同,本实验用的辅助液是浓度约为0.005mol/L的KCl。
3.电势的测定
(1)仔细洗净电泳管,检查活塞是否润滑良好,且不漏。用少量已配好的AgI溶胶将电泳管的漏斗至活塞的支管洗一遍。用滴管由漏斗加入少量溶胶,使活塞孔内充满溶胶,迅速关闭活塞。用辅助液洗涤U型管部分。活塞以上若有溶胶也应洗去。
(2)关闭电泳管活塞,将电泳管垂直固定在铁架台支架上。
(3)用胶头滴管由漏斗向电泳管中加入值得的溶胶至漏斗细支管顶部,然后倒入烧杯中剩于的溶胶。
(4)用烧杯取一定量的KCl辅助液,沿U型管倒入电泳管。若使用长电极,则将辅助液倒入U型管至刻度4;若使用短电极,则将辅助液倒入U型管至刻度9。
(5)将黑色挡板放在U型管后,慢慢打开活塞使溶胶慢慢上升。注意,不要全部打开,一定要慢,否则得不到清晰的溶胶界面。至溶胶上升至刻度线0时,关闭活塞。
(6)将两个电极轻轻插入电泳管的U型管中。整个过程注意保持平稳,不使电泳管受振动。
(7)将电泳仪电泳仪电源开扳下(关),将输出调节旋钮反时针方向旋至输出电压最小位置,接好电源线,,做好开机准备。将两电极引线接在电泳仪上,将电泳仪电源开关扳上(开),指示灯亮,预热5分钟后,调节输出旋钮到电压指示为150V。按电泳仪的开始按钮,同时计时,指示灯显示为R。注意:由于电泳仪输出电压较高,在通电过程中不要接触电极,否则有触电危险。
(8)观察溶胶上升界面清晰后,用秒表测量界面上升0.5、1.0、1.5cm所需时间。测量完毕,按电泳仪的停止按钮,指示灯灭。拆下电极引线,卸下电泳管,将管内的液体倒入指定的废液杯中。
(9)用钢尺仔细量出U型管的距离,减去U型管的两个半径,即为两电极之间的距离。
(10)实验结束,洗净使用过的所有玻璃仪器。将药品和仪器放回原处。
五、结果处理
1.总结溶胶的制备方法
制备溶胶有两种方法:将大块固体分割到胶体分散度的大小,此法称为分散法;使小分子或粒子聚集成胶体大小,此法称为凝聚法。
(1)分散法
分散法主要有3种方式,即机械研磨、超声分散和溶胶分散。
①研磨法:常用的设备主要有胶体磨和球磨机等。胶体磨由两片靠得很近的盘或磨刀,均由坚硬耐磨的合金或碳化硅制成。当上下两磨盘以高速反向转动时,粗粒子就被磨细。
②超声分散法:频率高于16000Hz的声波称为超声波,高频率的超声波传入介质,在介质中产生相同频率的疏密交替,对分散相产生很大的撕碎力,从而达到分散效果。
③胶溶法:胶溶法是把暂时聚集在一起的胶体粒子重新分散而成溶胶。
(2)凝聚法
主要有化学反应法及更换介质法,此法的基本原则是形成分子分散的过饱和溶液,控制条件,使形成的不溶物颗粒大小在溶胶分散度内。此法与分散度相比不仅在能量上有限,而且可以制成高分散度的胶体。
①化学反应法:凡能形成不溶物的复分解反应,水化反应以及氧化还原反应等皆可用来制备溶胶。由于离子的浓度对胶体的稳定性有直接的影响,在制备溶胶时要注意控制电解质的浓度。
②改换介质法:此法系利用同一物质在不同溶剂中溶解度相差悬殊的特性,使溶解于良溶剂中的溶质,在加入不良溶剂后,因其溶解度下降而以胶体粒子的大小析出,形成溶胶。此法作溶胶方法简便,但得到的溶胶粒子不太细。
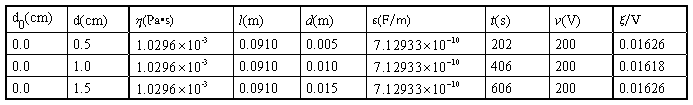
2.计算AgI负溶胶的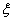 电势,并取平均值
电势,并取平均值
(1)实验数据
电压:200V 实温:18.9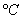
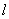 :9.10cm
:9.10cm
表1 移动长度与时间记录表

(2)查表得各参数
在19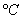 时,水的粘度
时,水的粘度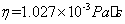 ,在18
,在18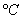 时,水的粘度
时,水的粘度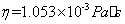 则
则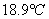 时水的粘度近似为:
时水的粘度近似为:
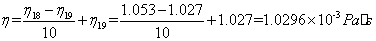
在18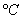 时,水的介电常数
时,水的介电常数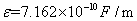 ,在20
,在20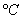 时,水的介电常数
时,水的介电常数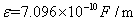 ,则18.9
,则18.9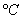 时水的介电常数近似为:
时水的介电常数近似为:
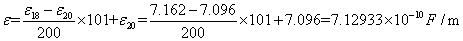
(3)计算电势差
表2 计算相关数据表
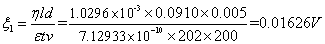
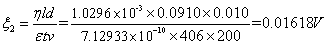
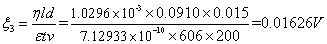
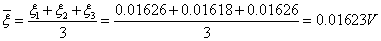
六、思考题
1. 试比较不同溶胶的制备方法有什么共同点和不同点?
(1)共同点:不同溶胶的制备方法均服从以下两点:
a.分散系中的分散质分散不聚结
b.分散质的颗粒直径在1nm~100nm之间
(2)不同点:分散法是将大于胶体范围的物体分散成胶体分散质大小;而聚集法则是将小于胶体范围的物质聚集成胶体分散质大小。分散法中,研磨法适用于脆而易碎的物体,超声分散法适用于胶体分散和乳状液制备,胶溶法适用于新县沉淀,若沉淀放置过久则不实用;凝聚法中,化学反应法适用于能形成不容物的复分解反应、水解反应等来制备溶胶,改换介质法适用同一物质在不同的溶剂中溶解度相差悬殊的物质。
2.为什么要求辅助液与溶胶的电导率相同?这对计算电动电势有什么作用。
测量电势时,电势与介质的电导率关系较大。若辅助液与溶液的电导率不同,势必会导致辅助液与溶液的电导率不同,导致其移动速度不一致,使得界面模糊,影响实验结果。
辅助液与溶胶的电导率相同可以使计算更加精确。
3.注意观察,电泳时溶胶上升界面与下降界面的颜色、清晰程度及移动速度有什么不同。分析产生这些差别的可能原因。
(1)不同
溶胶上升界面颜色浅、更不清晰、移动速度快;下降界面颜色深,较清晰,移动速度慢。
(2)原因
上升界面的I- 受正极吸引,上升较快,溶胶较少,所以颜色浅,由于移动速度快,所以界面不清晰;下降界面则是K+ 受负极吸引,由于距离远,所以其速度慢,由于I- 浓度降低,导致溶胶浓度上升,故颜色变深,由于移动速度慢,所以界面清晰。
第二篇:中国石油大学(华东) 物理化学 大纲
附件20xx年硕士研究生入学考试大纲考试科目名称:物理化学 考试科目代码:[813]考试要求:闭卷考试,书写规范、工整,所有答案均写在答题纸上,否则无效。二、考试内容:1)气体p-V-T性质:a: 理解理想气体模型、实际气体和理想气体p-V-T性质的差别。b: 掌握理想气体状态方程、范德华方程、分压、分容概念及应用、气体液化与临界性质、临界参数、对比参数、对应状态原理、压缩因子等概念。2)热力学第一定律:a: 理解系统和环境、状态和状态性质、过程和途径、可逆过程、功和热的概念。b: 掌握热力学第一定律、焓、Cp、Cv、、、相变焓等重要概念以及、与温度关系的重要关系式。熟练掌握单纯pVT变化过程、相变过程、化学反应过程的Q、W、、的计算。c: 会设计过程计算复杂情况下的热、功、温度、热力学能及焓的变化。d: 掌握化学反应焓、相变焓和温度的关系、热力学第一定律对理想气体的应用、节流过程特点。知道溶解焓、稀释焓、离子生成焓的概念。3)热力学第二定律:a: 掌握卡诺循环、热机效率概念。会在p-V,T-S,H-S等图上表示卡诺循环。b: 理解第二定律的表述、实质、卡诺定理及其推论。掌握熵的概念、实质、统计意义、克劳修斯不等式、熵增原理、熵判据、、判据。c: 理解第三定律、规定熵、标准熵的概念及其数值求取。d: 熟练掌握单纯pVT变化过程、相变过程、化学反应过程的、、、、的计算。掌握热力学基本关系式、麦克斯韦关系式及其应用,能够较熟练地做有关证明题。熟练克拉佩龙及克劳修斯-克拉佩龙方程的各种形式和应用。4)多组分体系热力学:a: 熟练掌握拉乌尔定律和亨利定律。b: 掌握偏摩尔量和化学势的定义,理解其物理意义、偏摩尔量间关系。c: 掌握理想气体、理想溶液、稀溶液中化学势的表达、各种标准态的选取和化学势在化学平衡、相平衡中的应用、理想溶液、稀溶液定义、特点及微观说明。d: 理解并会计算理想溶液的混合性质,会用吉布斯-杜亥姆公式。理解稀溶液的依数性质,熟练它们的应用和计算。e: 掌握逸度、活度概念和路易斯-兰德尔规则,会计算活度系数。5)化学平衡:a: 掌握和及化学反应亲和势概念、化学反应等温方程及其应用、理想气体化学反应的各种平街常数及其相互关系。b: 掌握温度、压力、浓度、惰性气体等因素对化学平衡的影响、多相化学平衡。c: 熟练计算化学反应的、不同温度的平衡常数和平衡组成,会推导关系式。d: 理解实际气体化学平衡、同时平衡、反应耦合。e: 知道溶液中平衡常
数和的关系,化学平衡近似计算,反应有利温度。f: 利用红外光谱、核磁共振谱并结合理化性质推断结构。6)相平衡:a: 掌握相、自由度、物种数、组分数的概念及求法。b: 理解相律的推导和表达,能熟练进行相数、自由度、组分数的计算。c: 熟练相图分析(单组分相图,二组分理想溶液、真实溶液、部分互溶,完全不互溶体系的气-液平衡、液-液平衡相图,二组分固态不互溶及生成稳定、不稳定化合物的固-液平衡相图,水-盐体系相图,三组分一对液体部分互溶的液-液平衡相图:点、线、面、自由度、相、动态分析、冷却曲线、方程计算等)。d: 理解精馏原理和各类气-液平衡体系的精馏特点。e: 熟练杠杆规则及其计算。7)电化学:a: 明确电化学和热力学之间的关系。b: 熟悉阳极、阴极、正极、负极、标准氢电极、电极电势的规定。c: 理解电解质溶液导电机理。d: 掌握法拉第定律和离子迁移数的希托夫法测定。e: 熟练掌握电导率、摩尔电导率、离子独立运动定律,离子摩尔电导率、离子迁移率的概念、影响因素和计算。f: 掌握电导测定应用、电解质平均活度和平均活度系数、德拜-许克尔极限公式及有关计算,理解可逆电池概念。g: 熟练掌握各类可逆电极、电极反应、原电池热力学、能斯特方程、E和E的测定及应用、原电池的书写和设计。h: 掌握盐桥的作用、浓差电池、极化、极化曲线、极化造成的影响和极化原因及影响极化的因素。i: 知道电解时电极反应的影响因素、电动势产生的机理、液接电势的计算。8)统计热力学初步:a: 熟悉统计系统分类和统计热力学基本假设。b: 明白能级、简并度、能级分布、状态分布、能级分布的微态数、系统的总微态数、数学几率、热力学几率、最可几分布、平蘅分布的概念。c: 理解定域子系及离域子系能级分布热力学几率计算方法。d: 掌握粒子配分函数、玻尔兹曼分布、配分函数析因子性质、能量零点的选择对配分函数的影响、玻尔兹曼熵定理、各种运动形式对热容的贡献,熟悉平动、转动、振动、电子、核、振动特征温度、转动特征温度的表达式。e: 知道热力学能、熵与配分函数的关系,残余熵概念,理想气体化学平衡常数与配分函数的关系。9)表面现象:a: 掌握表面张力及其影响因素,曲界面压力差、毛细现象,弯曲液面上的饱和蒸气压极其应用(液体的过冷、过热、过饱和现象及毛细凝结现象等)、单分了层吸附理论、溶液的表面吸附、表面活性物质基本性质。b: 熟悉润湿现象、物理吸附、化学吸附、吸附热、Freundlich吸附等温式。
c: 知道吸附等压,等量线概念、溶液中吸附、多分子层吸附。10)化学动力学基础:a: 掌握反应速率定义、反应级数、反应分子数、基元反应,质量作用定律、反应速率测定、速率方程微分和积分形式,零级、一级、二级、n级反应的特点,确定速率方程的方法、温度对反应速率的影响等。b: 明确活化能、表观活化能、碰撞理论活化能、过渡状态理论活化能、阿累尼乌斯活化能以及活化能对反应速率的影响、影响活化能的因素。c: 熟练动力学计算。掌握平行,对峙,连串,链反应的特点,会推导有关公式。d: 掌握复杂反应近似处理方法、反应速率理论要点及其与阿累尼乌斯公式的关系。明白单分子反应、爆炸反应的分类和影响因素。11)各类特殊反应:a: 掌握催化剂基本特征、催化反应一般机理、气-固相催化与吸附、光化反应定律、机理和速率方程,温度对光化反应速率影响。b: 明白溶液中反应、酶催化反应。知道酸碱催化、络合催化。12)胶体化学:a: 掌握分散体系分类,胶体的基本性质、光学性质、动力性质、电学性质(胶团结构)以及胶体稳定和聚沉的影响因素。b: 熟悉乳状掖的类型,稳定原因及破坏方法,高分子溶液的渗透压、黏度和唐南平衡、盐析;凝胶,冻胶,触变的概念。c: 知道溶胶制备、悬浮液的斯托克斯公式、泡沫和气溶胶的性质。三、试卷结构:1)考试时间:180分钟,满分:150分2)题型结构a: 选择、填空题(30分)b: 简 答 题(30分)c: 计算、证明题(90分)四、参考书目:1、《物理化学》(第五版)傅献彩等编,高等教育出版社,20xx年版;2、《物理化学》(第五版)王正烈等编,高等教育出版社,20xx年版。
