植物多倍体的诱导及其鉴定
一、实验目的
1、通过实验,掌握化学诱导植物多倍体的原理以及方法,学习利用秋水仙素诱 导植物多倍体的一般方法及多倍体诱导在植物育种上的意义。
2.学习利用细胞学方法观察鉴定多倍体的特点以及诱导染色体加倍后的细胞学表现,利用染色体分析的方法对多倍体的细胞做出准确判断。
二、实验原理
生物体的细胞核中都有相对稳定的染色体数目,这是物种的基本特征之一。多倍体是细胞中具有3个或3个以上的染色体组的生物体。在植物育种上,利用多倍体可以改良作物的经济性状,同时还可以利用多倍体克服远缘杂交过程中的障碍。
利用一些化学因素诱导植物产生多倍体,秋水仙素是诱导多倍体形成最有效和常用的药品之一,利用秋水仙素处理正在进行有丝分裂的细胞,可以抑制纺锤丝的形成,使细胞有丝分裂中期纺锤丝断裂或纺锤体形成受抑制,有丝分裂后期,复制的染色体无法移向两级,细胞内的染色体加倍,形成多倍体。因此在适宜浓度的秋水仙素作用下,它既可以有效的阻止纺锤体的形成,又不至于对细胞发生较大的毒害,因此,细胞经一定时期后仍可恢复正常,继续分裂,只是染色体数目加倍成为多倍性细胞,并在此基础上进一步发育成为多倍体植物。将秋水仙素处理的植物根尖,制成临时装片,利用显微镜观察根尖分生区细胞中的染色体数目而确定是否形成染色体。
三、实验材料、器具及试剂
1、实验材料:发芽的蚕豆,蚕豆幼苗
2、实验器具:显微镜、解剖针、小试管、刀片、镊子、载玻片、盖玻片、吸水纸、试管、培养皿、烧杯。
3、实验试剂:秋水仙素: 0.1%浓度。
卡诺固定液:3份95%酒精与1份冰醋酸配制而成。
1mol/l盐酸,45%醋酸,改良苯酚品红,70%酒精。
四、实验步骤
1、取材: 将种子消毒,并于无菌水中浸泡24小时后,将蚕豆种子(2n=16)培养在培养皿内的湿滤纸上,室温或28℃发芽,待胚根长达1~2cm时,取出萌发的种子,用自来水洗2~3次,备用。
2、预处理:将胚根长到1~2cm的蚕豆种子移到盛有0.1%秋水仙素的润湿的的吸水纸的培养皿内,室温下处理48h,待观察到根部有膨大时取出固定,与在水中进行培养的蚕豆种子(一般植物生长周期为17~18h)做对照。同时,将实验组蚕豆根尖的生长情况与对照组的蚕豆根尖生长情况拍照做对比。
3、固定: 取出秋水仙素处理的蚕豆种子,用清水洗净萌发的蚕豆种子上的秋水
仙素溶液,剪取约0.5cm长的根尖,投入carnoy固定液中固定24h,清水洗净固定液,再移入70%酒精中保存,对照组的蚕豆根尖也需取
0.5cm长的根尖投入carnoy固定液固定24h,再移至70%的乙醇中保存。
4、解离:将蚕豆根尖放入小试管中,加入1mol/L的盐酸,量没过根尖0.5mm,在室温下解离8~15min(解离可以使细胞之间的果胶层软化,经解离的组织可以使压片步骤顺利进行)
5、染色:倒掉解离液,用清水反复冲洗根尖,将根尖置于干净的载玻片上,滴加改良苯酚品红少许,染色20~30min.
6、压片:用蒸馏水冲洗干净根尖上的染液,置干净载玻片上,滴加45%醋酸,盖上盖玻片,其上放一片吸水纸,吸干多余染液的水分,左手指压住吸水纸的左边,右手指从吸水纸的左端向右方轻轻抹去,再用铅笔擦头从垂直均匀的轻轻敲打盖玻片,将材料压成一层细胞(薄雾状),使细胞均用散开。
8、镜检:把压好的片子放在显微镜下,先观察细胞分散状况和中期分裂相的多少,再检查分裂中期细胞中染色体是否完全散开。如若染色体分散不好而难以分辨和计数,可取下片子,平放桌面上,用手指隔着吸水纸在盖玻片上稍施压力,如果操作细心,用力适度,便可很容易得到染色体分散良好的压片标本,然后观察染色体的数目,统计染色体组的数量,以确定染色体是否加倍。
五、蚕豆幼苗的处理和多倍体间接鉴定
(1)蚕豆幼儿苗的处理:
在蚕豆幼苗的幼芽长到3-5mm时,用解剖刀在芽上作一纵切,然后用一浸有秋水仙素(0.05%浓度)溶液的纱布条包在切口处,纱布条的另端浸在一个盛有秋水仙素水溶液的小烧杯内, 烧杯的口用封口膜封好以防处理液蒸发,处理12h.隔天后再处理1次,然后将幼苗洗干净,种到花盆内或地里。同时种植没有处理过的幼苗作为对照。
(2)形态观察和细胞学鉴定:
比较处理与对照的外部形态有什么差异,将叶面的表皮撕下,在显微镜下观察,多倍体植物的气孔和花粉粒比二倍体大很多,叶片也比较肥厚。用根尖压片法制成染色体载玻片标本,在显微镜下认真观察和计数,与对照进行对比。
六、实验注意事项:
1、要保证植物种子的发芽成功,即要注意室内温度在28°C内,给予适当充足
的水分,不能让种子干涸死亡。若发芽条件不适宜,导致种子发芽结果不理想,
最终将影响实验的观察结果。
2、取材:取根尖分生区,尽量要小。
3、秋水仙素液的浓度要在0.1%之内,不能过浓或稀,处理时间在24~28小时,
若处理时间不够长,则有可能使抑制纺锤体失败,导致不能成功诱导染色体加倍。
4、解离要充分,(最好在50~60°C水浴锅内进行)水洗要彻底,否则不易着色。
不宜解离太长时间,以免根尖破碎,下一步处理材料时由于材料过软易丢失。
5、染色时,染色时间应在内,时间不宜过长,否则使染色过深为紫色,不易观
察到染色体,染色师要注意添加染液,不要使染液变干,在吸取多余染液时小心
操作不要吸走样品。
6、压片时不要移动盖玻片,不能留有气泡,否则影响镜检的效果,用铅笔擦头
从盖玻片上轻轻敲打时,要用力适度,敲打均匀,若用力过猛,则容易将盖玻片
压碎,同时使细胞均用散开,若染色体不完全分散开,则镜检时难以分辨和计数。
7、本实验所用的秋水仙素溶液具有强致癌性,请在使用过程中务
必注意安全,尤其是不能乱倒废液。
8、由于本实验涉及的时间较长,应认真记录各时期植物变化情况。
七、实验前要注意思考的问题:
1.什么是多倍体?
答:体细胞中含有三个或三个以上染色体组的整倍体为多倍体。
2.秋水仙素诱导植物染色体加倍的原理是什么?
答:秋水仙素可以抑制纺锤丝的形成,使细胞有丝分裂中期纺锤丝断裂或纺锤体形成受抑制,有丝分裂后期,复制的染色体无法移向两级,细胞内的染色体加倍,形成多倍体。
3、实验中为什么取2~3cm的根尖部分制作装片?
答:因为在2~3cm的根尖部位,是细胞进行有丝分裂的分生区,制成装片易于实验观察。
4、为什么染色时间不能超过30min?
答:因为染色时间过长,细胞核会被染成深紫色,颜色太深不易观察到染色体的具体数目和形态。
八、实验结果
图1:用秋水仙素处理已发根至1~2cm的蚕豆种子48h之后,与未处理的蚕豆种子发根情况对照图。
实验组 对照组
图2:把用秋水仙素处理的发芽的蚕豆根尖制成临时装片,镜检如下图所示:
实验组的分生区40倍 对照组的分生区40倍
六、实验结果分析
一、从图1:用秋水仙素处理已发根至1~2cm的蚕豆种子48h之后,与未处理的蚕豆种子发根情况对照图中,可以明显的看到,用秋水仙素处理过的蚕豆种子根尖明显膨大变粗,而未处理过的蚕豆根尖则正常形态,并未加粗,相对较长而细。这是因为用秋水仙素处理蚕豆根尖之后,在细胞的分裂中期抑制纺锤体的形成,从而导致在有丝分裂后期,复制的染色体无法移向两级,细胞内的染色体加倍,形成多倍体,即具有多个染色体组,具有多套遗传物质,所以合成的蛋白质等营养物质更多,因此,细胞体积膨大,又因为秋水仙素进入细胞后,使细胞的渗透压增大,导致细胞大量吸水,细胞体积膨大。所以,综上两个原因,用秋水仙素处理的蚕豆根尖就膨大而粗,而对照组则无此变化。
二、图2:用秋水仙素处理的发芽的蚕豆根尖制成临时装片的镜检图中,可以明显的看到,用秋水仙素处理过的蚕豆根尖的分生区细胞的细胞体积、细胞核都比对照组的要大的多,实验组伸长区的细胞明显比对照组的细胞更长,细胞核大而明显,细胞质浓,这是因为秋水仙素处理根尖细胞之后,染色体加倍,形成多倍体,即具有多个染色体组,具有多套遗传物质,所以合成的蛋白质、糖类等营养物质更多,因此,细胞体积膨大,又因为秋水仙素进入细胞后,使细胞的渗透压增大,导致细胞大量吸水,细胞膨胀。最终导致细胞体积膨大,细胞核变大,质浓的结果。
同时,从细胞内染色体数目的变化来看,对照组中正常的蚕豆根尖染色体共有12条6对(2n=12),在图2中,经过用秋水仙素处理以后,可以明显的看到大量的细胞中的染色体数目加倍,即具有3个或3个以上的染色体组,因此,说明蚕豆根尖经过秋水仙素处理之后,成功的形成了多倍体。另外,从制片中染色体的形态来看,图2中的染色体制片质量是比较好的,因为在一张染色体制片中,可以明显的观察到较多的中期分裂相,染色体分散而不重叠;染色体不扭曲,不断裂,主缢痕,随体都比较清晰;且制片基本上为一层平展的细胞, 视野内的细胞都在一个平面上;染色体着色较深,而细胞质不着色或着色很浅,背景清晰,无过多的杂质。因此,能十分清楚地观察细胞内染色体形态,并且对染色体的数目进行计数,以确定是否形成多倍体。
七、实验出现的问题
一、出现问题:在实验组和对照组的蚕豆根尖制成的装片内,只能观察到细胞膜,细胞质,细胞核,但都没有观察到核内的染色体。(如图3所示)
可能原因:1、取材时,没有取到根尖分生区的细胞,所以处于分裂期的细胞很少,所以 不易观察到染色体。
2、解离时只在常温下进行,没有在50~60℃的水浴锅内进行解离,且解离时间仅为10min。由于解离的时间不够长,温度也不够高,所以解离不够充分,压片时细胞不易分散,有可能使导致染色体不能分散开来,所以观察不到染色体;
3、染色时间不够长,滴加的染色液的量不够多,导致染色太浅,细胞核内的染色体没有着上颜色,所以无法清楚的观察到染色体;
4、由于解离不够,加上压片不够均匀和充分,导致细胞没有完全分散开来,进而可能使细胞核内的染色体没有分散开来,所以只能观察到细胞核的形态,而不能清晰的观察到核内的染色体形态和数目。
二、出现问题:视野中许多染色体缠绕成团。
可能原因:压片时用力小,没有完全打散。
三、出现问题:局部染色浅。且多出现在分生区。(如下图所示)
可能原因:染色不均匀;分生区不易着色,可能与其分裂时产生某些物质有关,不排除秋水仙素的干扰。
八、【思考题】
1.什么是多倍体?
答:体细胞中含有三个或三个以上染色体组的整倍体为多倍体。
2.秋水仙素诱导植物染色体加倍的原理是什么?
答:秋水仙素可以抑制纺锤丝的形成,使细胞有丝分裂中期纺锤丝断裂或纺锤体形成受抑制,有丝分裂后期,复制的染色体无法移向两级,细胞内的染色体加倍,形成多倍体。
3、实验中为什么取2~3cm的根尖部分制作装片?
答:因为在2~3cm的根尖部位,是细胞进行有丝分裂的分生区,制成装片易于实验观察。
4、为什么染色时间不能超过30min?
答:因为染色时间过长,细胞核会被染成深紫色,颜色太深不易观察到染色体的具体数目和形态。
讨论:植物染色体标本的制备与观察的实验要获得成功,关键要注意哪几个问题?
1、要保证植物种子的发芽成功,即要注意室内温度在28°C内,给予适当充足的水分,不能让种子干涸死亡。若发芽条件不适宜,导致种子发芽结果不理想,最终将影响实验的观察结果。
2、取材:取根尖分生区,尽量要小。
3、秋水仙素液的浓度要在0.1%之内,不能过浓或稀,处理时间在24~28小时,若处理时间不够长,则有可能使抑制纺锤体失败,导致不能成功诱导染色体加倍。
4、解离要充分,水洗要彻底,否则不易着色。但也不宜解离太长时间,以免根尖破碎,下一步处理材料时由于材料过软而易丢失。
5、染色时,染色时间应在内,时间不宜过长,否则使染色过深为紫色,不易观察到染色体,染色师要注意添加染液,不要使染液变干,在吸取多余染液时小心操作不要吸走样品。
6、压片时不要移动盖玻片,不能留有气泡,否则影响镜检的效果,用铅笔擦头从盖玻片上轻轻敲打时,要用力适度,敲打均匀,若用力过猛,则容易将盖玻片压碎,同时使细胞均用散开,若染色体分散不开或不完全则镜检时难以分辨和计数。
第二篇:植物多倍体的诱导及鉴定8
大蒜多倍体的诱导及鉴定
胡小鹏
(生命科学学院 生物技术 08级 2008300118)
组员:李美瑶、魏祎、刘利、彭冰心
指导老师:黎双飞 王娟
摘要 以大蒜为实验材料,以0.1%的秋水仙素诱导12h和24h后,采用根尖压片方法对空白组和处理组染色体进行染色观察。转移盆栽,于5周后进行对照组和处理组的形态、生理生化指标观察测定。通过数理统计发现,处理组植株高度和根长、气孔数等形态学指标与空白组对比具有显著差异,表明处理组产生多倍体;0.1%的秋水仙素诱导12h的植株组与诱导24h的相比,各指标均表示没有显著性差异。
关键词 时间 多倍体 形态 秋水仙素 生理生化指标
前言 多倍体普遍存在于植物界,且具有巨大性、代谢合成强、适应性强的特点,因此研究多倍体诱导在现代农业中具有重要意义。在诱导多倍体的方法中,以化学试剂秋水仙素应用较多,秋水仙素的主要作用是抑制细胞分裂时纺锤体的形成,阻止染色体向两级移动,而停留在分裂中期,但染色体的复杂不受影响,这样细胞不能继续分裂,从而产生染色体加倍的细胞,细胞继续分裂,产生多倍体植株[1],目前对植物多倍体诱导的研究多集中于不同浓
[2]度的秋水仙素对材料的作用效果,并没有充分考虑不同时间的作用效果,因此本实验以
大蒜为实验材料,采用了同浓度秋水仙素不同时间处理,研究多倍体的诱导效果,为植物多倍体的研究提供参考。
1.材料与方法
1.1实验材料
选取成熟、饱满的新鲜大蒜。
1.2实验处理方法
⑴. 准备六个培养皿,1,4号培养皿分别用于B1实验组;2,5号培养皿分别用于B2实验组;3,6号培养皿分别用于A空白对照组。
⑵. 4,5,6号培养皿中分别放置15颗蒜头,然后再加入一定量的水。
⑶.在1,2号培养皿中滴加1%秋水仙素1ml,使培养皿内秋水仙素浓度稀释到0.1%,3号培养皿中滴加1ml水。
⑷.将4,5,6号已浸泡16h的蒜头转移到1,2,3号培养皿中培养,其中1号培养皿中B1组培养12h,2号培养皿中B2组培养24h
⑸. 4号培养皿中加入10mlH2O
⑹. 将1号培养皿中的蒜头取出放入4号培养皿进行脱毒,2号和3号培养皿不变 ⑺. 5号培养皿中加入10ml H2O
⑻ 将2号培养皿内的蒜头转移到5号培养皿中进行脱毒,5号和3号培养皿不变
1.3幼苗培养
于A、B2、B3三组中分别挑选6个大蒜,转移盆栽,每天定时浇水。
1.4染色体加倍观察
⑴.将1号培养皿内残液倒掉,重新配制50ml 0.1%的秋水仙素(5ml秋素+45ml水)并注明标签,在1号培养皿内加入10ml0.1%的秋水仙素
⑵ 取4号培养皿中的蒜头1~2颗种子的10余个根尖,置于1号培养皿中培养4h,其余精选4号培养皿内6颗带根尖蒜头按顺序进行盆栽并在标签上写上时间和B1实验组
⑴.将1号培养皿内残液倒掉,重新配制50ml 0.1%的秋水仙素(5ml秋素+45ml水)并注明标签,在1号培养皿内加入10ml0.1%的秋水仙素
⑵ 取4号培养皿中的蒜头1~2颗种子的10余个根尖,置于1号培养皿中培养4h,其余精选4号培养皿内6颗带根尖蒜头按顺序进行盆栽并在标签上写上时间和B1实验组
⑴.将1号培养皿内残液倒掉,重新配制50ml 0.1%的秋水仙素(5ml秋素+45ml水)并注明标签,在1号培养皿内加入10ml0.1%的秋水仙素
⑵ 取4号培养皿中的蒜头1~2颗种子的10余个根尖,置于1号培养皿中培养4h,其余精选4号培养皿内6颗带根尖蒜头按顺序进行盆栽并在标签上写上时间和B1实验组
⑴.将1号培养皿内残液倒掉,重新配制50ml 0.1%的秋水仙素(5ml秋素+45ml水)并注明标签,在1号培养皿内加入10ml0.1%的秋水仙素
⑵ 取4号培养皿中的蒜头1~2颗种子的10余个根尖,置于1号培养皿中培养4h,其余精选4号培养皿内6颗带根尖蒜头按顺序进行盆栽并在标签上写上时间和B1实验组 ⑴.将卡诺氏固定液B1中的根尖转入70%乙醇中待用。
⑵从固定液中取出根尖,用蒸馏水漂洗,分别放入1 mol/L盐酸和酸解液(浓盐酸:95%酒精=1:1)中,60度水浴解离10分钟,用蒸馏水漂洗后,放在培养皿中。
⑶把根尖放在载玻片上,用解剖针把身长。把伸长区部分截去,加少量染液(几滴),染色10分钟,盖上盖玻片。用镊子轻轻敲打,使分生组织细胞展成薄薄一层
⑷将解离好的材料用蒸馏水冲洗以后,转入45%醋酸中软化5min,滤纸吸取多余的醋酸,滴一滴改良苯酚品红染色10-15min
⑸对装片进行数码显微拍照
1.5生物学形态观察
将盆栽的大蒜连根拔起,测量各组的根长、茎宽、叶长,并做详细记录。然后再将大蒜洗净擦干,称量每组大蒜的鲜重,然后做好标记放入烘箱烘干水分,直至称量的重量不再变化时即为各组植株的干重。
2.实验结果
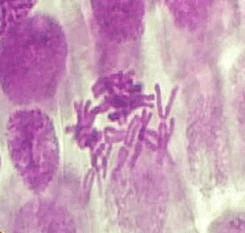
2.1大蒜根尖染色结果
[3]。
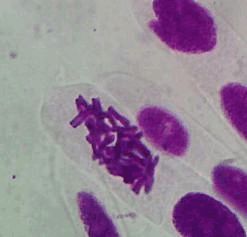
(10*40) (10*40) (10*40)
图1 A组 图2 B1组 图3 B2组
未用秋水仙素处理 0.1%秋水仙素处理12h 0.1%秋水仙素处理24h
实验结果表明:实验组的染色体有加倍现象,在同一浓度即0.1%秋水仙素处理12h与处理24h的染色体都有加倍现象,据谢晓玲等人的研究认为在同一浓度下,秋水仙素处理时间越长,细胞有丝分裂指数越小,染色体加倍率提高
数目的变化仍需进一步研究。
[6],但随着处理时间的延长,细胞染色体
2.2大蒜的萌发和出芽情况
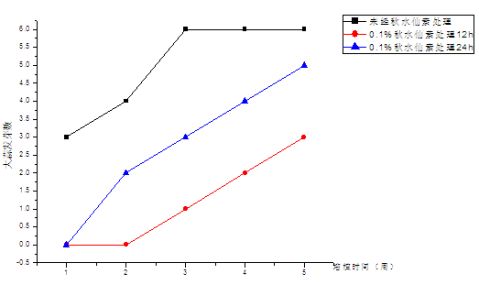
图4 各组大蒜发芽情况

图5 各组大蒜出芽情况
实验结果表明:空白组A组无论是发芽率还是生长情况均较B1和B2组好,生长一段时间后,与对照A组比较,实验B组的叶片颜色深浅不一,植株矮小。这是由于大部分植株形成的是四倍体细胞和二倍体细胞共存的嵌合体,叶绿体分布不均匀所致
[6]。
2.3大蒜的形态学指标
大蒜的植株高度 叶长(cm)
抽样1 抽样2
56.30 17.30 22.95
抽样3 平均
42.75 8.40 3.00
A(空白组) 49.35 B1(处理12h) 12.30 B2(处理24h) 28.25
大蒜的植株根长
49.47 12.67 18.07
根长(cm)
A(空白组)
抽样1
22.80
抽样2
24.85 15.25 15.15
抽样3 平均
22.75 13.95 14.70
B1(处理12h) 15.70
B2(处理24h) 22.50
大蒜的植株叶宽 叶宽(cm) A(空白组)
23.47 14.97 17.45
抽样1
0.90
抽样2
0.95 0.80 0.65
抽样3 平均
0.80 0.60 0.70
B1(处理12h) 0.80 B2(处理24h) 0.80
0.88 0.73
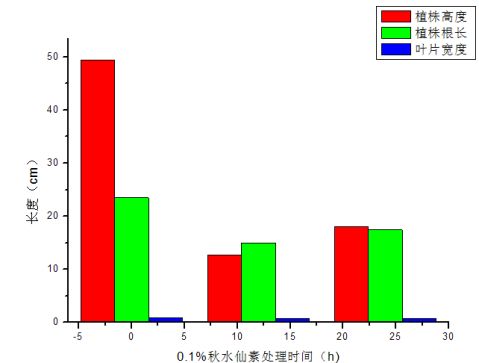
图6 各组大蒜形态学指标
从上图可以看出,处理时间越长,大蒜的根长和植株高度呈下降趋势,表明一定浓度的秋水仙素会对植株生长产生毒副作用,且随作用时间的延长抑制作用越明显。
2.3大蒜的生理生化指标
大蒜的叶片气孔数 气孔数(个) A(空白组)
视野1 117
视野2 112 33 20
视野3 131 20 18
平均
B1(处理12h) 32 B2(处理24h) 19
大蒜含水量
120.00 28.33 19.00
干湿比重(%) 鲜重(g) 干重(g)
2.13g 0.645g 0.515g
含水量
90.6% 95.8% 96.9%
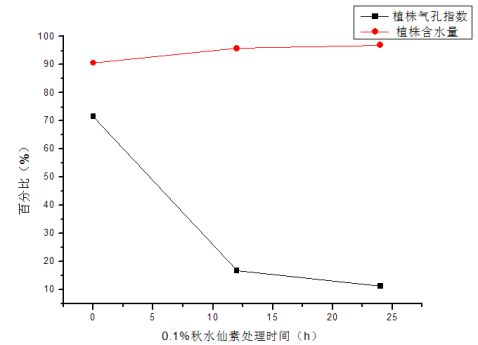
A(空白组) 22.768 B1(处理12h) 15.306 B2(处理24h) 16.573
图7 各组大蒜生理生化指标



(10*40) (10*40) (10*40)
图8 A组气孔 图9 B1组气孔 图10 B2组气孔 未用秋水仙素处理 0.1%秋水仙素处理12h 0.1%秋水仙素处理24h 从图中可见,气孔数的变化是和植株含水量变化具有一定的负相关,因为随着处理时间的延长,气孔数逐渐减少,单个气孔面积变大,植株保水能力相应增强,这对植株的抗逆能力具有重要意义
3.分析讨论
经过5周的实验,我们得到了各组大蒜的形态学和生理生化数据,为了更科学的说明各组数据之间关系,我们将对各组数据进行差异显著性检验。当各样本数据为正态分布时,Bartlett方差齐性检验具有良好的把握度[4][7]。 ,考虑到自然界绝大数生物性状为正态分布,故本实验将先采用Bartlett方差齐性检验,再根据两组数据标准差之间的关系,进行两个样本平均数间差异显著性的检验
3.1植株气孔数
气孔数(个)
A组
B1组
B2组
n[5]。 视野1 117 32 19 视野2 112 33 20 视野3 131 20 18 平均 120.00 28.33 19.00 sA?2?(xi?1i?x)2n?1
n
2?1943?1?97
sB1?2?(xi?1i?x)n?1?104.67
3?1?69.97
n
sB2?2?(xi?1i?x)2n?1?2
3?1?1
2.6.1 空白组A与0.1%秋水仙素处理12h组对比
A组与B1组方差齐性检验:
H0 : σ1 = σ2 , H1 σ1 ≠ σ2 ,显著性水平α=0.05
F2,2?SASB122?9769.97?1.39
查F检验的临界值表F2,2,0.025?39
F2,2?F2,2,0,025,结论是SA和SB的差异不显著,所以结论接受σ1 = σ2 122
A组和B1组之间差异的显著性检验:
H0:u1?u2 HA:u1?u2 ,显著性水平α=0.05
因为σ1 = σ2,
所以 t?x1?x2
(n1?1)S1?(n2?1)S2
(n1?1)?(n2?1)22?(1n1?1n2)120?28.33(120?28.33)?26?23?15.97
查t值分布表t2,0.025?4.303
t?t2,0.025 即P<0.05,所以拒绝H0,接受H1.
结论:空白组气孔数与0.1%秋水仙素处理12h组有显著性差异。同理,空白组气孔数与0.1%秋水仙素处理24h组也有显著性差异
2.5.2 0.1%秋水仙素处理24h与处理24h组对比
B1组与B2组之间方差齐性检验:
H0 : σ1 = σ2 , H1 σ1 ≠ σ2 ,显著性水平α=0.05
F2,2?SB1
SB222?69.971?69.97
查F检验的临界值表F2,2,0.025?39
F2,2?F2,2,0,025,结论是SA和SB的差异显著,所以结论拒绝σ1 = σ2,接受σ1 ≠ σ2 2
12
这说明植株气孔密度数据不严格服从t分布,为了检验平均数之间的差异显著性,下面将对B1组和B2组之间的差异进行Aspin-Welch检验。
H0:u1?u2 HA:u1?u2 ,显著性水平α=0.05
sB1
k?n1
sB1
n122228.33sB2n2222??228.33322?1932?0.0728 2
1?k?0.9272
已知dfB?dfB?n?1?2 12
所以df?1
k2
df1
t?x1?x2
s12?(1?k)df2?2?10.072822?0.927222?2.312 28.33?1969.97
32n1?s22n2?12?0.4785 3
df?2.312时的t临界值需要用线性内插
t3,0.025?3.182法求出,先分别查出t2,0.025?4.303,
则t2,2,0.025?t2?(t3?t2)?(2.312?2)?4.303?(3.182?4.303)?0.312?3.953
t?t2,2,0.025 即P>0.05,所以接受H0,接受H1.
结论:0.1%秋水仙素处理12h的气孔数与处理24h组没有显著性差异。
对于各组大蒜叶长、根长、叶宽等数据采用上述数理统计分析方法,得出各组显著性差异表:
组合
A与B1
A与B2
B1与B2
表1 两个样本的差异显著性检验表
秋水仙素可以与细胞内微管蛋白亚基结合,当结合有秋水仙素的微管蛋白亚基组装到纺锤丝微管末端后,其他的微观蛋白亚基就很难再在该处进行组装,由于微管的踏车行为,末端带有秋水仙素的微管对其去组装并没有影响,从而使细胞内微管系统完全解体,最终影响到细胞染色体向两极的迁移运动,但染色体的复杂不受影响,这样细胞不能继续分裂,从而产生染色体加倍的细胞,细胞继续分裂,产生多倍体植株。
通过染色体染色鉴定,秋水仙素诱导产生了多倍体植株。此外,两个样本的差异显著性检验表明,0.1%秋水仙素的作用能导致大蒜植株高度、根长、气孔数产生显著性差异,表型特征与遗传特征关系密切,表型变异特征可作为多倍体鉴定的形态学指标[9]植株高度 具有显著性差异 具有显著性差异 不具有显著性差异 植株根长 具有显著性差异 具有显著性差异 植株叶宽 不具有显著性差异 不具有显著性差异 植株气孔数 具有显著性差异 具有显著性差异 不具有显著性差异 不具有显著性差异 不具有显著性差异 ,因此可以用植株高度、根长、气孔数来表征出现多倍体的形态学特征,而植株叶宽则不适用。 另外,有趣的是0.1%秋水仙素处理12h和处理24h所引起的植株形态学变化都不存在显著性差异,,据Khosravi P等人的研究表明,在不对细胞造成功能性损伤的前提下多倍体诱导试剂存在剂量效应和时间效应[8]那么利用秋水仙素诱导大蒜多倍体是否存在一个最佳剂量和时间呢?我们知道在一个生长周期内,处于分裂中期的细胞较少,而秋水仙素只对正在分裂的细胞起作用,因而导致加倍的细胞数很少,大部分植株形成的是四倍体细胞和二倍体细胞共存的嵌合体,但随着处理时间延长,间歇的二倍体细胞到了中期,秋水仙素仍然存在,导致了四倍体细胞比例迅速增加到一个峰值,然后处理时间虽然继续延长,但四倍体细胞比例并没有上升,形态学上也没有继续产生变化,因此有必要结合细胞分裂周期和秋水
仙素作用时间进一步探讨大蒜多倍体诱导中诱导时间和加倍率的关系。
参考文献
[1] 赵 阳,黄 韬.秋水仙素在园艺植物多倍体育种中的应用研究进展[J], 上海蔬菜,2010
(2):29-31.
[2] 李晓艳,张志东,李亚东等.秋水仙素诱导离体培养越橘多倍体研究[J],东北农业大学
学报,2010,41(1):38-42.
[3] 郭善利,刘林德等.遗传学实验教程[M].科学出版社,2004:3-4.
[4] 程琮 范华 .Levene方差齐性检验[J],中国卫生统计,2005,22(6):408-420.
[5] 杜荣骞 .生物统计学[M],高等教育出版社,2003,34-82.
[6] 谢晓玲 邓自发 .秋水仙素对大蒜生长的影响及多倍体诱导效应分析[J],安徽农业科
学,2009,37(9):4191-4194.
[7] 王晓桐 张金凤 .大蒜多倍体诱导的探究性实验[J],青海农林科技,2010(2):4-7.
[8] Khosravi P,Kermani M J,Nematzadeh G A, et al.Role of mitotic irrhibitors and
genatype on chromosome doubling of Rosa[J].2008,160:267-275.
[9] Stanys V,Weckman A,Staniene G et al.In vitro induction of polyploidy in Jananese
quince (Chaenomeles japonica)[J].Plant Cell,Tissue and Organ Culture,2006,84:263-268.
