附件1: 国家食品药品监督管理局制 可疑医疗器械不良事件报告表
报告日期: 年 月 日 编 码:? ? ? ? ? ? ? ? ? ? ? 报告来源:? 生产企业 ? 经营企业 ? 使用单位 单位名称:
联系地址: 邮 编: 联系电话:
报告人: 医师? 技师? 护士? 其他? 报告人签名:

例子:
附件1: 国家食品药品监督管理局制
可疑医疗器械不良事件报告表
报告日期:20xx年10月25日 编 码:? ? ? ? ? ? ? ? ? ? ? 报告来源:? 生产企业 ? 经营企业 ? √使用单位 单位名称:按实际填写 联系地址: 按实际填写 邮 编: 联系电话:
报告人: 医师?√ 技师? 护士? 其他? 报告人签名:
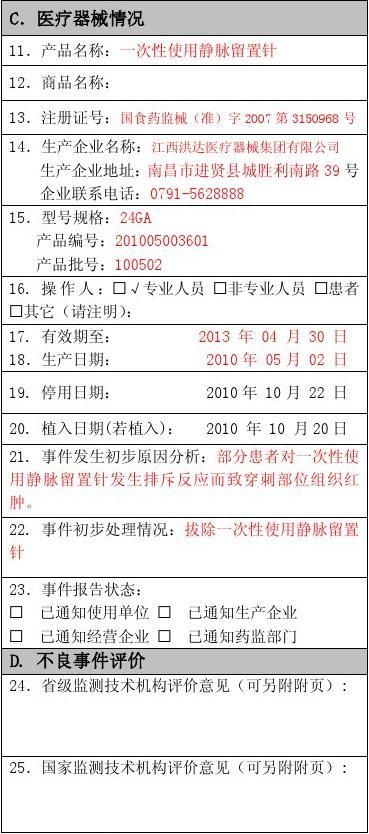

例子2
附件1: 国家食品药品监督管理局制
可疑医疗器械不良事件报告表
报告日期: 2010 年 10 月 8日 编 码:? ? ? ? ? ? ? ? ? ? ? 报告来源:? 生产企业 ? 经营企业 ?√ 使用单位 单位名称: 联系地址: 邮 编: 联系电话:
报告人: 医师? 技师? 护士?√ 其他?
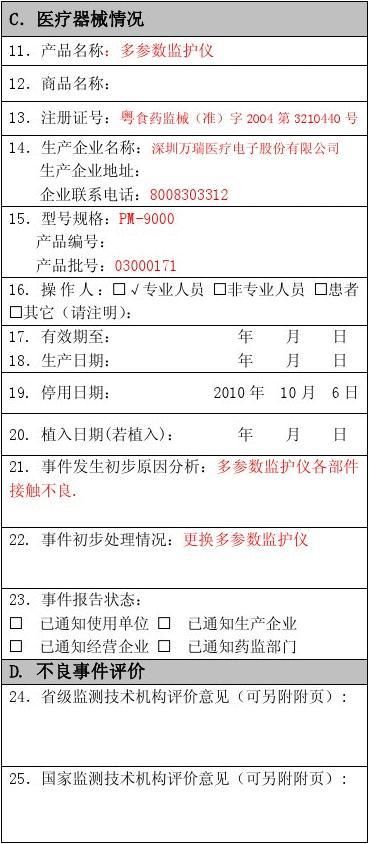
报告人签名:

第二篇:怎样正确填写可疑医疗器械不良事件报告表
怎样正确填写《可疑医疗器械不良事件报告表》
按照国家药品不良反应监测中心的统一部署和要求,在省局领导的高度重视及医疗器械处的大力支持下,在甘肃省医疗器械安全监测与评价中心主任的正确领导及各市(州)局的积极努力下,甘肃省医疗器械不良事件监测及上报工作取得了一定的成绩,但是通过20xx年至今收到的报表情况分析,依然存在很多问题,其中报告质量不高是普遍存在的情况,虽然有客观原因,但是,基层监测人员的专业知识水平需要进一步提高。也间接地反映出我省医疗器械生产、经营、使用单位监测人员及公众对医疗器械不良事件监测及上报知识的认识还不透彻、不全面。为了更好的推进全省医疗器械不良事件监测工作的发展,使基层监测人员正确填写《可疑医疗器械不良事件报告表》,现将如何填报报表详细介绍如下:
《可疑医疗器械不良事件报告表》由患者资料、不良事件情况、医疗器械情况、不良事件评价四部分21条及报告来源信息组成。
1、患者资料
第1条至第4条为患者一般情况,包括:患者姓名、性别、年龄、预期治疗疾病或作用,资料请填写清楚,有利于资料的分析处理。其中:
第4条 预期治疗疾病或作用 是指涉及不良事件的医疗器械用于治疗的疾病或者预计使用该医疗器械所发挥的作用。例如,心瓣膜用于治疗二尖瓣狭窄;血管内支架用于治疗急性心肌梗死;角膜塑形镜用于矫正屈光不正。
有关患者隐私的资料,如患者姓名在数据处理、反馈中将得到保密,不予公开。
2、不良事件情况
第5条至第9条为医疗器械不良情况,说明事件的性质和发生状况,其中死亡事件应注明死亡时间。
第5条 事件主要表现 是指使用医疗器械后引发的,可能与该医疗器械使用有关的有害事件(包括副反应和并发症)。例如,放置节育器后因月经过多,经治疗、随访观察3个月以上无效而取器者,则事件主要表现可填写“月经过多”;放置节育器后,因月经过多、导致中度以上贫血而取器者,则事件主要表现可填写“月经过多、贫血”;放置节育器后,出现意外脱落者,填写“节育器脱落”。
第6条 事件发生日期 指应用器械者发现,或经过检查发现可疑不良事件(症状)的时间。
第7条 医疗器械使用场所 指医疗器械是在医院使用、诊所使用、患者个人使用还是可以在上述一个以上场所使用。
第8条 事件后果 例如,因放置节育器后,出现盆腔炎,考虑可能与放置节育器有关而取器,并需要给予药物治疗者,可填写“需要内、外科治疗避免上述永久损伤”;放置节育器后,出现带器妊娠者,可填写“需要内、外科治疗避免上述永久损伤”;放置节育器后,出现意外脱落者,填写“其它”。
第9条 事件陈述 至少应包括使用医疗器械的目的、依据;医疗器械使用情况;预期效果应该怎样;出现了什么样的非预期结果;
对患者造成什么影响;采取了哪些相应治疗措施;对器械采取了哪些补救措施;结果如何;同类事件再次发生能够出现的最大危害是什么;同类事件再次发生最可能出现的危害是什么。可另附A4纸报告。
填写事件陈述项时,可以按照以下主要内容进行归纳填写: 1一般情况:○即患者或使用者在应用器械前的疾病或身体状况。如属适合放置节育器者,可描述“某年某月,因采取避孕措施使用节育器”。
2使用情况:例如,可疑节育器不良事件中,使用者已经应用○
节育器4个月者,可填写“使用节育器4个月”。可以陈述受术者在应用节育器期间,是否按照术后注意事项执行。出现副反应和并发症时,曾经接受了怎样的处理(治疗)措施。
3事件情况:陈述使用器械后出现的可疑医疗器械不良事件表○
现(症状)。例如,放置节育器后出现腹痛、月经量比放置前增加2倍、出血量测定为80ml,异位妊娠、节育器脱落等。
4造成影响:如放置节育器后,导致月经过多、贫血、经期延○
长、不规则出血、盆腔炎、严重腹痛、子宫穿孔、节育器异位、带器妊娠等。
5采取措施:因放置节育器导致可疑不良事件而采取出节育器○
措施者,填写“取器”。
3、医疗器械情况
第10条至第21条为可疑医疗器械不良事件涉及医疗器械情况。
其中:
第10条 医疗器械分类名称 按产品注册时医疗器分类名称填写,使用单位如不明确可不填写,企业和省级监测中心收到报告后医疗器械分类名称填写。
第11条 商品名称 指器械生产企业所生产的具体产品的商品名(品牌,通常标示有符号)。例如,曼月乐。
第12条 注册证号 是产品上市的准入证明,也是产品识别依据,是国家医疗器械管理部门核发的医疗器械注册证注册号。例如,国食药监械(准)字2004第3660603号。一般可通过医疗器械采购部门获得注册号。
第13条 生产企业联系方式中如果是进口产品,请填写国外生产企业在境内代表处或境内代理企业的联系方式。
第14条 有关产品跟踪的信息对于企业识别、跟踪问题产品非常重要,使用单位如有填写困难,应联系生产企业协助填写。
第15条 操作人 是指获得资格证书和执业证书的医生、护士、技士。
第16条 有效期至 是指器械生产企业在该器械出厂时列明的有效期限截止日期、失效期。
第17条 停用日期 是指停止使用相关可疑医疗器械的具体日期。例如,取出节育器的日期。
第18条 植入日期 是指将相关可疑医疗器械植入体内的具体日期。例如,放置宫内节育器的具体时间。
第19条 事件发生原因 分析可从医疗器械设计、使用、性能、其他干扰因素角度初步分析事件发生的可能原因。
第20条 事件处理情况 例如,放置宫内节育器导致可疑医疗器械不良事件而取器者,可填写“取器”。如果须同时采取其它治疗措施的,应具体注明。如果属节育器意外脱离事件,需重新放置宫内节育器的,可填写“放置节育器”。
第21条 事件报告状态 应说明使用单位在向省级监测中心报告后,是否已通知企业或药监分局;企业在报告医疗器械不良事件后,对其中需要采取措施的产品问题是否通知了使用单位或药监分局。
报告来源信息:包括选择报告主体、填写单位名称、联系方式、报告人身份及报告编码。
其中编码一栏,由省级药品不良反应监测中心和国家药品不良反应监测中心填写。
