酸碱中和滴定实验误差分析
上传: 何琼华 更新时间:2012-5-19 20:47:38
酸碱中和滴定是中学化学实验中的重要定量实验,特别是其实验误差分析是学生学习和掌握本实验的重点和难点。在教学中,学生遇到有关实验误差分析总会出现困惑,直接影响到学生对实验结果的准确判断和相关问题的解决。为了突破这一教学难点,在教学中,首先引导学生从酸碱中和滴定原理入手,理解中和滴定原理,即:酸提供的H的物质的量与碱提供的OH的物质的量相等。然后把原理公式化,即:C(待)=n·C(标)·V(标)/V(待)(n表示酸碱反应的物质的量之比)。其次在误差分析中,明确公式中的n、V(待)和C(标)均为确定量,只有V(标)是变量,C(待)和V(标)成正,实验中引起的各种误差,只要造成V(标)偏大的所得C(待)都偏高,反之偏低。把引起误差因素最终归结到V(标)的变化上,再进行实验误差分析。根据引起误差的原因,对常见的分类归纳分析如下:
一、仪器洗涤不当
酸碱中和滴定实验中,滴定管、移液管和锥形瓶都要用蒸馏水洗净,且滴定管、移液管还要用待装液润洗2∽3次,锥形瓶不润洗。若洗涤不当就会引起误差,如:
1、滴定管蒸馏水洗后未用标准液润洗,就直接装入标准液,造成标准液稀释,溶液浓度降低,滴定中消耗V(标)偏大,C(待)偏高。
2、盛待测液滴定管或移液管水洗后,未用待测液润洗就取液加入锥形瓶,造成待测液被稀释,V(标)偏小,C(待)偏低。
3、锥形瓶水洗后,又用待测液润洗,再取待测液,造成V(标)偏大,C(待)偏高。
4、滴定前,锥形瓶用水洗涤后,或锥形瓶中残留水未干燥,或取完待测液后再向锥形瓶中加点水便于观察,虽然V(待)增大,但C(待)变小,其物质的量不变, 无影响。
二、读数不当
在读数时,应将滴定管直立在水平面上,两眼平视,视线与液面凹面最低处水平相切。若读数不当就会引起误差,如:
1、盛标准液的滴定管,滴定前仰视滴定管读数,滴定后平视滴定管读数, 造成V(标)减小,C(待)偏低。
2、盛标准液的滴定管,滴定前平视滴定管刻度线,滴定终了仰视刻度线,读数偏大,造成V(标)偏大,C(待)偏高。 -+
3、盛标准液的滴定管,滴定前平视滴定管刻度线,滴定终了俯视刻度线,读数偏小,造成V(标)减小,C(待)偏低。
4、盛标准液的滴定管,滴定前仰视滴定管刻度线,读数偏大,滴定后俯视刻度线,读数偏小。造成V(标)减小,C(待)偏低。
三、操作不当
在实验的过程中,要按照酸碱中和滴定实验规定的具体要求,进行规范的操作,常见的由于操作不当引起的误差主要有:
1、用滴定管取待测液时,滴定管尖嘴处有气泡未排出就取液加入锥形瓶,由于气泡填充了部分待测液, 使得待测液体积减小,造成滴定时V(标)偏小,则C(待)偏低。
2、滴定前,液面在“0”刻度线之上,未调整液面,造成V(标)偏小,C(待)偏低。
3、移液管悬空给锥形瓶放待测液, 使待测液飞溅到锥形瓶外,或在瓶壁内上方附着,未被标准液中和,造成滴定时V(标)偏小, C(待)偏低。
4、移液管下端的残留液吹入锥形瓶内, 使待测液体积偏大,消耗的V(标)偏大, C(待)偏高。
5、滴定前滴定管尖嘴部分有气泡,滴定后气泡消失,部分标准液用来填充气泡所占体积,造成V(标)偏大,C(待)偏高。
6、滴定前滴定管尖嘴部分无气泡,滴定后产生气泡,消耗液体的体积被气泡占据,V(标)偏小,则C(待)偏低。
7、滴定过程中,标准液滴到锥形瓶外或盛标准液滴定管漏液,造成V(标)偏大,C(待)偏高。
8、滴定达终点后,滴定管尖嘴处悬一滴标准液,造成实际进入锥形瓶的标准液减小,使V(标)偏大,C(待)偏高。
9、溶液变色未保持30秒,即停止滴定,结果溶液又恢复原来的颜色,造成V(标)减小,C(待)偏低。
10、滴定过快成细流,立即读数,造V(标)偏大,C(待)偏高。
四、指示剂选择不当
指示剂的选择,一般强酸与强碱相互滴定时,既可选用甲基橙,也可选用酚酞;强酸与弱碱相互滴定时,应选用甲基橙;强碱与弱酸相互滴定时,应选用酚酞,一般不选用石蕊,指示剂用量为2∽3滴为宜。若选择不当就会引起误差,如:
1、用强酸滴定弱碱,指示剂选用酚酞。由于酚酞的变色范围在8.2∽10之间,造成消耗强酸V(标)偏小,C(待)偏低。
2、用强碱滴定弱酸,指示剂选用甲基橙。由于甲基橙的变色范围在3.1∽4.4之间,造成消耗强碱V(标)偏小,C(待)偏低。
五、来自配制标准液产生的误差
配制0.1mol/L的NaOH溶液500mL,需要NaOH质量 2.0g
(1)NaOH已部分潮解 偏高
(2)NaOH中含有杂质:
①杂质不与盐酸反应 偏高
②所含杂质消耗1mol盐酸需质量大于40g 偏高(例如:Na2CO3、NaHCO3) ③所需杂质消耗1mol盐酸需质量小于40g 偏低(例如:Na2O)
(3)砝码有油污 偏低
六、终点判断不准
酸碱中和滴定终点在实际操作中,通常是用酸碱指示剂的颜色变化来表示的,酸碱指示剂颜色变化半分钟不褪色的时刻,即为滴定终点。若判断不准就会引起误差,如:
1、强酸滴定弱碱时,甲基橙由黄色变为红色停止滴定。使测出的V(标)偏大,C(待)偏高。
2、强碱滴定弱酸时,酚酞由无色变为粉红色时立即读数。使测出的V(标)偏小,C(待)偏低。 总之,造成中和滴定实验误差的因素是多方面的,学生理解了误差产生原因,掌握了误差分析的正确思路,即:造成的因素→ 直接后果→ 对V(标)的影响→滴定误差。再通过适量的练习,就能顺利完成中和滴定实验误差分析。
第二篇:酸碱中和滴定实验误差分析
酸碱中和滴定实验误差分析
1.用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的方法叫做酸碱中和滴定。
2.酸碱中和反应的实质:H++OH-=H2O
公式:a. n(H+)=n(OH-) b. C(H+)V(H+)=C(OH-)V(OH-)
3.中和滴定过程中,容易产生误差的6个方面是:
①洗涤仪器(滴定管、移液管、锥形瓶);
②气泡;
③体积读数(仰视、俯视):俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大;
仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小;
④指示剂选择不当;
⑤杂质的影响;
⑥操作(如用力过猛引起待测液外溅等)。
具体分析如下:
(1)滴定前,在用蒸馏水洗涤滴定管后,未用标准液润洗。(偏高)
(2)滴定前,滴定管尖端有气泡,滴定后气泡消失。(偏高)
(3)滴定前,用待测液润洗锥形瓶。(偏高)
(4)取待测液时,移液管用蒸馏水洗涤后,未用待测液润洗。(偏低)
(5)取液时,移液管尖端的残留液吹入锥形瓶中。(偏高)
(6)读取标准液的刻度时,滴定前平视,滴定后俯视。(偏低)
(7)若用甲基橙作指示剂,最后一滴盐酸滴入使溶液由橙色变为红色。(偏高)
(8)滴定过程中,锥形瓶振荡太剧烈,有少量溶液溅出。(偏低)
(9)滴定后,滴定管尖端挂有液滴未滴入锥形瓶中。(偏高)
(10)滴定前仰视读数,滴定后平视刻度读数。(偏低)
(11)滴定过程中向锥形瓶内加入少量蒸馏水。(无影响)
(12)滴定过程中,滴定管漏液。(偏高)
(13)滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准溶液至锥形瓶中。(操作正确,无影响)
(14)过早估计滴定终点。(偏低)
(15)过晚估计滴定终点。(偏高)
(16)一滴标准溶液附在锥形瓶壁上未洗下。(偏高)
(以上所指偏高偏低抑或无影响是指待测酸碱浓度)
分析技巧:1.分析不当操作对公式中四个变量其中一个或多个的大小影响,
2.根据公式,分析对V标准液的影响,V标准液比理论偏大,则待测液浓度测量值比实际值偏大,反之亦然。故而V标准液是我们考察的重点。
3.对于(11),分析向已经准确量取好的待测液中滴加入水,虽然改变了待测液浓度和体积,但并不影响n待测液,所以V标准液不变化,对测量结果无影响。
酸碱中和滴定——专题训练
[例1]某学生做中和滴定实验的过程如下:(a)取一支碱式滴定管,(b)用蒸馏水洗净,(c)加入待测的NaOH溶液,(d)记录液面刻度读数,(e)用酸式滴定管精确放出一定量标准酸液,(f)置于未经标准酸液润洗的洁净锥形瓶中,(g)加入适量蒸馏水,(h)加入酚酞试液2滴,(i)滴定时,边滴边摇荡,(j)边注视滴定管内液面的变化,(k)当小心地滴到溶液由无色变成粉红色时,即停止滴定。(l)记录液面刻度读数。(m)根据滴定管的两次读数得出NaOH溶液体积为22 mL。指出上述实验过程中的错误之处(用编号表示) 。
[例2]用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞作为指示剂,造成测定结果偏高的原因可能是( )
A. 配制标准溶液的NaOH中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其他操作正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
D. 滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
[例3]用NaOH滴定pH相同、体积相同的H2SO4、HCl、CH3COOH三种溶液,恰好中和时,所用相同浓度NaOH溶液的体积依次为V1、V2、V3,则这三者的关系是( )
(A)V1>V2>V3 (B)V1<V2<V3 (C)V1=V2>V3 (D)V1=V2<V3
[例4]用0.01 mol/L H2SO4滴定0.01mol/L NaOH溶液,中和后加水至100ml,若滴定时终点判断有误差:①多加1滴H2SO4;②少加1滴H2SO4;(设1滴为0.05ml)则①和②[H+]的比值是( )
A. 10 B. 50 C. 5×103 D. 104
[例5]草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:称取Wg草酸晶体,配成100.00mL水溶液。称25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L-1的KMnO4溶液滴定到KMnO4不再褪色为止,所发生的反应: 2KMnO4+5H2C2O4+3H2SO4 = K2SO4+10CO2↑+2MnSO4+8H2O
试回答:
(1)实验中不需要的仪器有(填序号) ,还缺少的仪器有(填名称) 。
a.托盘天平(带砝码,镊子) b.滴定管 c.100mL量筒 d.100mL容量瓶 e.烧杯
f.漏斗 g.锥形瓶 h.玻璃棒球 i.药匙 j.烧瓶
(2)实验中,标准液KMnO4溶液应装在________式滴定管中,因为________。
(3)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得的x值会__________________________(偏大、偏小、无影响)
(4)在滴定过程中若用amol·L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为____________mol·L-1,由此可计算x的值是____________。
分析:该题涉及到氧化还原滴定,虽然基于反应原理与中和滴定不同,但实验原理及操作和所用仪器等类似。由于该反应有明显的颜色变化,故可不用指示剂。
(1)c,f,j;还缺少铁架台(带滴定管夹),胶头滴管(定容时用)
(2)用酸式滴定管,因KMnO4溶液有强氧化性,能腐蚀橡皮管。
(3)无影响。因当初所取的待测液的物质的量一定。
(4) H2C2O4·xH2O ~ H2C2O4 ~ xH2O
巩固练习:
1. 在下列叙述仪器“0”刻度位置正确的是( )
A. 在量筒的上端 B. 在滴定管上端
C. 在托盘天平刻度尺的正中 D. 在托盘天平刻度尺的右边
2. 准确量取25.00ml KMnO4溶液,可选用的仪器是( )
A. 25ml量筒 B. 25ml酸式滴定管
C. 25ml碱式滴定管 D. 有刻度的50ml烧杯
3. 下列实验中,由于错误操作导致所测出的数据一定偏低的是( )
A. 用量筒量取一定体积液体时,俯视读出的读数
B. 用标准盐酸滴定氢氧化钠溶液测碱液浓度时,酸式滴定管洗净后,没有用标准盐酸润洗,直接装标准盐酸滴定碱液,所测出的碱液的浓度值
C. 测定硫酸铜晶体结晶水含量时,加热温度太高使一部分硫酸铜发生分解,所测出的结晶水的含量
D. 做中和热测定时,在大小烧杯之间没有垫碎泡沫塑料(或纸条)所测出的中和热数值
4. 酸碱中和反应属于放热反应,酸碱中和生成1mol水时所放出的热量称为中和热。放下列浓度均为0.1mol/L的溶液混合时,相关说法中正确的是( )
A. 与NaOH反应时,HCL的中和热小于CH3COOH的中和热
B. 与NaOH反应时,HCL的中和热大于CH3COOH的中和热
C. 与NaOH反应时,H2SO4的中和热大于HCL的中和热
D. 与H2SO4反应时,Ba(OH)2的中和热等于NaOH的中和热的2倍
5. 下列关于等体积、等pH的NaOH和氨溶液的说法正确的是( )
A. 两种溶液中OH-的浓度相同
B. 需要等浓度、等体积的盐酸中和
C. 温度升高10℃,两溶液的pH仍相等
D. 两种溶液中溶质的物质的量浓度相同
6. 下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。正确的操作顺序是( )
A. ⑥③①②⑤④ B. ⑤①②⑥④③
C. ⑤④③②①⑥ D. ③①②④⑤⑥
7. 某学生用碱式滴定管量取0.1mol·L-1的NaOH溶液,开始时仰视液面读数为1.0mL,取出部分溶液后,俯视液面,读数为11.0mL,该同学在操作中实际取出的液体体积为( )
A. 大于10.0mL B. 小于10.0mL C. 等于10.0mL D. 等于11.0mL
8. 已知次碘酸(HIO)既能和酸又能和碱发生中和反应。它与盐酸发生反应将生成( )
A. HI B. IOCl C. HClO D. ICl
9. 有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
A. V3>V2>V1 B. V3=V2=V1
C. V3>V2=V1 D. V1=V2>V3
10. 用标准的盐酸滴定未知浓度的NaOH溶液时,下列各操作中,无误差的是( )
A. 用蒸馏水洗净酸式滴定管后,注入标准溶液盐酸进行滴定
B. 用蒸馏水洗涤锥形瓶后,再用NaOH溶液润洗,而后装入一定体积的NaOH溶液进行滴定
C. 用碱式滴定管量取10.00mLNaOH溶液放入用蒸馏水洗涤后的锥形瓶中,再加入适量蒸馏水和2滴甲基橙试液后进行滴定
D. 若改用移液管取待测液10.00mLNaOH溶液放入锥形瓶后,把留在移液管尖嘴处的液体吹入锥形瓶内,再加入1mL甲基橙指示剂后进行滴定
11. 用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考右图,从表中选出正确选项( )

12. 用已知浓度的酸滴定未知浓度的碱时,会导致待测碱液的浓度偏低的操作是
①酸式滴定管用蒸馏水洗后,未用标准液润洗
②碱式滴定管用蒸馏水洗后,未用待测液润洗
③配制碱液时,称量的固体吸潮
④滴定前酸式滴定管尖嘴部分未充满溶液
⑤滴定中不慎将锥形瓶内液体摇出少量于瓶外
A. ①③④ B. ②⑤ C. ②③⑤ D. ①③
13. 某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)上述(B)操作的目的是___________________________________。
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)_________________________。
(4)实验中用左手控制_________(填仪器及部位),眼睛注视_______,直至滴定终点。判断到达终点的现象是___________。
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是___________________________________。
(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是______。
14. 某一种胃药片的制酸剂为碳酸钙,其中所含的制酸剂质量的测定如下:①需配制0.1mol/L的HCl的溶液和0.1mol/L的NaOH溶液②每次取一粒(药片质量均相同)0.2g的此胃药片,磨碎后加入20mL蒸馏水③以酚酞为指示剂,用0.1mol/L的NaOH溶液滴定,需用VxmL达滴定终点,④加入25mL0.1mol/L的HCl溶液
(1)写出全部实验过程的步骤_____(写编号顺序)
(2)下图所示的仪器中配制0.1mol/L的HCl溶液和0.1mol/L的NaOH溶液肯定不需要的仪器是
(填序号),配制上述溶液还需用到的玻璃仪器是______(填仪器名称)
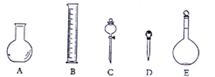
(3)配制上述溶液应选用的容量瓶规格分别为(填字母)
A. 50mL 50mL B. 100 mL 100 mL
C. 100 mL 150 mL D. 250 mL 250 mL
(4)写出相关的化学反应方程式:__________________________-
[参考答案]
1. B 2. B 3. D 4. B 5. A 6. A、B 7. A 8. D 9. C 10. C
11. C、D 12. C
13. (1)BDCEAF
(2)防止将标准液稀释
(3)偏大
(4)滴定管活塞;锥形瓶中溶液的颜色变化;锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色。
(5)偏小
(6)偏大
14. (1)①②④③②④③或②①④③②④③
(2)A C 烧杯 玻璃棒
(3)B
(4)CaCO3+2HCl=CaCl2+CO2↑+H2O HCl+NaOH=NaCl+H2O
