一、扩增
1、LB培养基5ml;
2、抗生素:1000X,即1:1000比例。种类根据细菌抗性决定;
3、菌体:看浑浊度,1%-5%,取500ul于其中;
4、37℃摇床220转,过夜,12-16h。
二、纯化质粒DNA
1、1.5ml离心管,编号一定要写清楚;
2、加满离心管,离心12000xg. 1min,弃上清。取三次;
3、加Buffer S1 200ul,溶解沉淀,5min;
4、加S2(用完立刻盖紧瓶盖,以免CO2中和Buffer中的NaOH) 200ul,不能剧烈(以免基因组DNA的污染),上下翻转4-6次,直至形成透亮的溶液,时间少于5min。目的是使蛋白包裹基因组DNA,游离质粒;
5、加S3 280ul,温和充分翻转混合6-8次,12000xg,10min(此步呈白色絮状);
*备注:S1:S2:S3=5:5:7
6、取上清加入制备管(置于2ml离心管),12000xg,1min,去滤液;
7、加Buffer W1 500ul,12000xg,1min,弃滤液;
8、加Buffer W2 700ul,12000xg,1min,弃滤液。重复一遍;
9、空管离心12000xg,1min;
10、制备管移入新的1.5ml离心管,管膜中加60-80ul去离子水,静置1min,12000xg,1min。(将去离子水加热至65度,将提高洗脱效率)
三、酶切体系
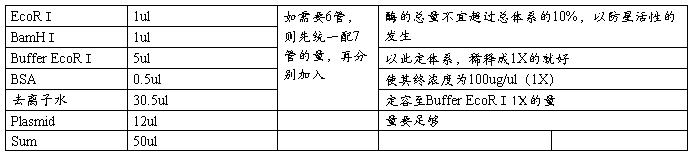
37°两小时以上即可
四、跑胶回收:sost回收失败
1、2%浓度胶,Loading Buffer如是6X,则加10ul到样品,全部加样到胶孔中。
插入:配胶方法
大块胶60ml;小块胶25ml;
需要配置大块胶、大孔胶;
Agarose 0.6g,TAE60ml,微波中火2min;
趁热但不烫手时加入gold view 0.5ul/25ml;
倒入槽里。
2、跑胶:单位厘米/5-10v。所以大槽25cm,150v即可。小槽100v即可。
3、紫外灯下切胶,纸巾吸进液体,计算凝胶重量(1mg=1ul);
4、加3个凝胶体积的凝胶结合液DB(0.1ul视为100ul;如凝胶浓度大于2%,则加入6倍体积溶胶液;凝胶块最大不能超过400ul,超过可多个离心柱);
5、56℃水浴放置10分钟,至完全溶解;
6、每100mg最初的凝胶重量加入150ul的异丙醇,震荡混匀,回收大于4Kb的片段可不加异丙醇,加入反而降低回收效率;
7、将上一步所得溶液加入吸附柱AC中(吸附柱放入收集管中),12000rpm,30-60s,弃液体;
8、加700ul漂洗液WB,12000rpm,1min,弃废液;
9、加500ul漂洗液WB,12000rpm,1min,弃废液;
10、空离心2min,弃废液;
11、晾干乙醇,以免抑制下游反应;
12、将吸附柱放入新的1.5ml离心管,加入50ul(最少30ul)洗脱缓冲液EB或者去离子水(65-70水浴加热效果更好,或将得到的溶液重新加入离心柱可增加洗脱量);
五、连接体系:
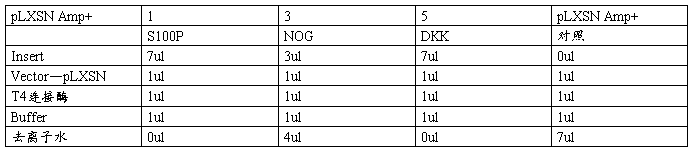
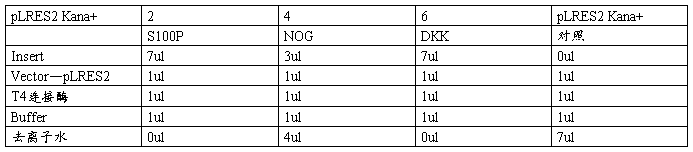
16℃ 过夜
六、转化
1、加感受肽:连接产物=10:1,冰浴30min;
2、激活:42℃,90s,不能震动;
3、加500ul LB培养基;
4、37℃,150转摇床,45min;
5、铺板子
七、检测
1、细菌长势良好,对照组不长;
2、酶切检测:
(1)1ml LB体系:1ml LB培养基+1ul抗生素于1.5mlEP管中;
(2)15ul Pcr体系:7.5ul Mix(2X)
5.5ul water
1ul上游引物
1ul下游引物
(3)用枪头挑培养皿中的菌体,吹打于1ml LB体系中,再吹打于15ul Pcr体系中;
(4)1ml LB体系放入37℃摇床,150rpm;
(5)15ul Pcr调节:
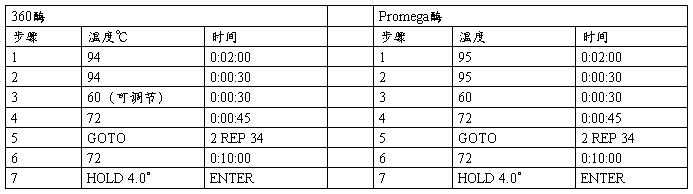
显示4°/4°时,结束。
(6)Pcr显示有结果,则将相对应的1ml LB体系扩增,见步骤一、扩增;
(7)重复步骤二、纯化质粒DNA;三、酶切体系;四、跑胶但不回收;
(8)有结果则证明之前的酶切、连接、转化成功。
第二篇:分子克隆操作流程
分子克隆操作流程
——From CXY
各Marker条带大小:
Marker DL2000: 100,250,500,750,1000.2000.3000.5000bp
Marker 1KB: 1,2,3,4,5,6,8,10kbp
Marker DL15000: 250.1000.2500.5000.7500.10000.15000
Day 1
一、 准备
1、 合成含适当酶切位点并带有保护碱基CCC的引物
2、 分别挑含目的片段质粒和载体质粒的宿主菌单克隆,37℃摇过夜
Day 2
二、 提质粒
1、 提含目的片段质粒和载体质粒
2、 nano定量
3、 1%琼脂糖凝胶电泳,鉴定质粒纯度,看是否混入基因组DNA(两条带),并粗略估计质
粒浓度
上样情况:
Marker 含目的片段质粒 载体质粒
三、 PCR扩增目的片段
1、 体系:
LA taq 0.5ul
10*LA taq buffer II 5ul
dNTP 4ul
含目的片段质粒 0.5ul (0.1ng~10ng)
primer1 and primer2(20uM) 各1ul
ddH2O up to 50ul (38ul)
条件:
94℃ 5min
94℃ 30s
55℃(根据引物Tm值确定) 30s
72℃ 50s(根据目的片段长度确定,1min扩1kb) 72℃ 1min
25cycles
2、 1%琼脂糖凝胶电泳,切胶回收目的片段
3、 1%琼脂糖凝胶电泳,看切胶回收目的片段纯度如何
(三)、overlapping PCR扩增目的片段(以真核表达2P2F全抗为例)
1、 从pET32a_scAb_2P2F质粒中扩增VK_CK片段
体系:
pyrobest taq 0.5ul
10* pyrobest taq buffer II 5ul
dNTP 4ul
pET32a_scAb_2P2F质粒 0.5ul (0.1ng~10ng)
primer1:VK5_2_120207 1ul
primer2: CK3_120207 1ul
ddH2O up to 50ul (38ul)
条件:
94℃ 5min
94℃ 30s
65℃(根据引物Tm值确定,可拉梯度) 30s
72℃ 50s(691bp,1min扩1kb)
72℃ 1min
25cycles
电泳鉴定片段大小(691bp),切胶回收(柱子吸附70bp~20kbp),可DNA定量并再次电泳鉴定回收质量
2、 从pET32a_scAb_2P2F质粒中扩增VH片段
体系:
pyrobest taq 0.5ul
10* pyrobest taq buffer II 5ul
dNTP 4ul
pET32a_scAb_2P2F质粒 0.5ul (0.1ng~10ng)
primer1:VH5_2_120207 1ul
primer2: VH3L_120207 1ul
ddH2O up to 50ul (38ul)
条件:
94℃ 5min
94℃ 30s
65℃(根据引物Tm值确定,可拉梯度) 30s
72℃ 50s(394bp,1min扩1kb)
72℃ 1min
25cycles
电泳鉴定片段大小(394bp),切胶回收(柱子吸附70bp~20kbp),可DNA定量并再次电泳鉴定回收质量
3、 从pMD18T-IgG质粒中扩增CH(IgG)片段
体系:
pyrobest taq 0.5ul
10* pyrobest taq buffer II 5ul
dNTP 4ul
pET32a_scAb_2P2F质粒 0.5ul (0.1ng~10ng)
primer1:CH5L_120207 1ul
primer2: CH3_120207 1ul
ddH2O up to 50ul (38ul)
条件:
94℃ 5min
94℃ 30s
65℃(根据引物Tm值确定,可拉梯度) 30s
72℃ 50s(1001bp,1min扩1kb)
72℃ 1min
25cycles
电泳鉴定片段大小(1001bp),切胶回收(柱子吸附70bp~20kbp),可DNA定量并再次电泳鉴定回收质量
4、 再次扩增VK_CK片段
体系:
pyrobest taq 0.5ul
10* pyrobest taq buffer II 5ul
dNTP 4ul
VK_CK第一轮扩增片段 0.5ul (~50ng)
primer1:VK5_1_120207 1ul
primer2: CK3_120207 1ul
ddH2O up to 50ul (38ul)
条件:
94℃ 5min
94℃ 30s
65℃(根据引物Tm值确定,可拉梯度) 30s
72℃ 50s(730bp,1min扩1kb)
72℃ 1min
25cycles
电泳鉴定片段大小(730bp),切胶回收(柱子吸附70bp~20kbp),可DNA定量并再次电泳鉴定回收质量
5、 overlapping连接VH片段和CH片段
体系:
pyrobest taq 0.5ul
10* pyrobest taq buffer II 5ul
dNTP 4ul
VH第一轮扩增片段 0.5ul (50ng)
CH第一轮扩增片段 0.5ul (50ng)
primer1:VH5_1_120207 1ul
primer2: CH3_120207 1ul
ddH2O up to 50ul (38ul)
条件:
94℃ 5min
94℃ 30s
65℃(根据引物Tm值确定,可拉梯度) 30s
72℃ 50s(1420bp,1min扩1kb)
72℃ 1min
25cycles
电泳鉴定片段大小(1420bp),切胶回收(柱子吸附70bp~20kbp),可DNA定量并再次电泳鉴定回收质量
6、 加A尾(pybest 外切酶)
体系
A-Tailing enzyme 0.5ul
10*A-Tailing Buffer 5ul
dNTP Mixture 4ul
末端平滑DNA片段 补齐至50ul(0.5~5ug)
ddH2O
条件
72℃反应20min,冰上静置1~2min
7、 连接T载体
pMD18-T vector 1ul
上述A-Tailing DNA溶液 4ul(0.1~0.3pmol)
ddH2O 0
Solution I 5ul(等体积)
条件
16℃反应30min
8、 转化
10ul上述产物转化100ul DH5a,涂板37℃生长过夜
四、 分别酶切载体质粒和目的片段
1、 体系:
酶1 and 酶2 各1ul
10* Buffer N(参照说明书选择合适buffer) 5ul
100*BSA 0.5ul
载体质粒20ul(<1ug,少好防止载体自连或者载体转入感受态降低克隆阳性率) 或者scFv_2P2F片段 补齐(越多越好)
to 50ul ddH2O up
条件:
37℃ 2~4hr
2、 1%琼脂糖凝胶电泳,先小样鉴定酶切情况,再大样切胶回收载体质粒(酶切片段无需切
胶回收只需过柱纯化,柱子吸附70bp~20kbp)。小样时未酶切载体质粒应比酶切载体质粒跑得快(环状比线性快,偶尔反之),酶切载体质粒应当看到切下的小片段(与染料结合能力与片段大小有关,因此条带可能较弱,且<50bp条带看不清,如果看不清在大样回收时应密切关注是否有切下的小片段)。如果以上两点不符合,有可能酶切失败,需重新配制酶切体系加酶量且拉长酶切时间(如果载体质粒未切开,目的片段一般也未切开,也需重新配)。
上样情况:
小样:Marker 未酶切载体质粒 酶切载体质粒 酶切片段
大样:Marker 酶切载体质粒
五、 连接
1、 体系:
T4 DNA Liganse 1ul
10* T4 Buffer 2ul
质粒酶切产物 2ul
目的片段酶切产物 15ul
条件:
16℃ 1hr(或过夜)
或者室温30min(或2~3hr)
六、 转化
1、 取10ul连接产物转化相应感受态(通常为DH5a)
Day 3
七、 菌落PCR鉴定阳性克隆,并划板存菌37℃生长过夜
1、 体系:
LA taq 0.5ul
10*LA taq buffer II 5ul
dNTP 4ul
primer3 and primer4(20uM,载体上引物,或载体加目的片段引物) 各1ul
单克隆菌落
ddH2O up to 50ul (38ul)
条件:
94℃ 5min
94℃ 30s
55℃(根据引物Tm值确定) 30s
72℃ 50s(根据目的片段长度确定,1min扩1kb) 72℃ 1min
25cycles
2、 1%琼脂糖凝胶电泳,鉴定阳性克隆
Day 4
八、 酶切鉴定并测序
1、 挑阳性克隆37℃摇~8hr
2、 送至测序公司测序(载体两侧引物和目的片段上游反向引物)
3、 提阳性克隆质粒
4、 酶切鉴定阳性克隆质粒是否为假阳性(选做)
体系:
酶1 and 酶2 各0.5ul
10* Buffer N(参照说明书选择合适buffer) 2ul
100*BSA 0.2ul
阳性克隆质粒 5ul(1ug)
to 20ul ddH2O up
条件:
37℃ 2~4hr
1%琼脂糖凝胶电泳,鉴定酶切成功与否,同样看未酶切与酶切跑得快慢,以及切下片段大小。
上样情况:
Marker 未酶切质粒 酶切质粒
end
