氧化还原滴定法和配位滴定法自学总结
姓 名:
学员营队:
学 号:
日 期:
氧化还原滴定法和配位滴定法自学总结
近段时间我在原有的基础上自学了分析化学中四大滴定法之二,即氧化还原滴定法和配位滴定法,使我对四大滴定法的异同有了一定的了解,也对分析化学有了更深的了解。下面是我对这两种滴定法的所学和总结。
氧化还原滴定法
一、概述
氧化还原滴定法是以氧化还原反应为基础的容量分析方法。它以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质;或者间接滴定一些本身并没有氧化还原性,但能与某些氧化剂或还原剂起反应的物质。
氧化还原反应要注意选择合适的条件使反应能定量、迅速、完全进行:
1、滴定反应必须按一定的化学反应式定量反应,且反应完全,无副反应;
2、反应速度必须足够快;
3、必须有适当的方法确定化学计量点。
若氧化还原反应的速度极慢,该反应就不能直接用于滴定,那么通常我们会采用以下方法来提高氧化还原反应速度:
1、增大反应物的浓度或减小生成物的浓度;
2、升高温度;
3、加催化剂。
我查阅到氧化还原滴定法根据使用的标准溶液不同可分为高锰酸钾法、重铬酸钾法、碘量法、溴酸钾法等。最常用的也就是高锰酸钾法和碘量法,下面主要介绍这两种方法的原理及其应用。
二、高锰酸钾法
(一)原理和条件
高锰酸钾法是以高锰酸钾作标准溶液在强酸性溶液中直接或间接的测定还原性或氧化性物质的含量的滴定分析方法。在酸性条件下其化学反应式为: 。
。
测定方法有三种:直接滴定法、返滴定法和间接滴定法。一些具有还原性的物质如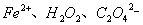 等可用直接滴定法,一些不能直接用高锰酸钾滴定的氧化性和还原性物质则可选用返滴定法,有些非氧化性或还原性物质不能用直接滴定法或返滴定法时可采用间接滴定法。
等可用直接滴定法,一些不能直接用高锰酸钾滴定的氧化性和还原性物质则可选用返滴定法,有些非氧化性或还原性物质不能用直接滴定法或返滴定法时可采用间接滴定法。
(二)高锰酸钾法的应用
高锰酸钾法的应用范围非常广,自学过程中我学到了用它测定市售过氧化氢中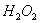 含量。
含量。
过氧化氢具有还原性,可用高锰酸钾标准溶液直接滴定,测量其含量。高锰酸钾自身作指示剂,进行滴定。在酸性溶液中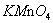 与
与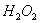 反应的方程式:
反应的方程式: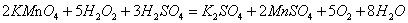 。
。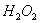 的含量可按下式计算:
的含量可按下式计算: 。
。
三、碘量法
(一)原理和条件
碘量法是利用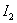 的氧化性的
的氧化性的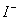 的还原性进行滴定的分析方法。其化学方程式是:
的还原性进行滴定的分析方法。其化学方程式是: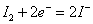 ,
,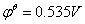 。从
。从 可知
可知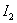 是较弱的氧化剂,
是较弱的氧化剂,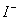 是中等强度的还原剂。
是中等强度的还原剂。
碘量法可分为直接碘量法和间接碘量法。
直接碘量法是利用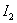 的氧化性直接测定(滴定)还原性较强的的物质,又叫碘滴定法。应在酸性、中性或弱碱性溶液中进行。
的氧化性直接测定(滴定)还原性较强的的物质,又叫碘滴定法。应在酸性、中性或弱碱性溶液中进行。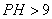 时则会发生如下发反应:
时则会发生如下发反应: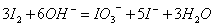 。直接碘量法可用淀粉指示剂指示终点,终点时溶液呈蓝色。由于
。直接碘量法可用淀粉指示剂指示终点,终点时溶液呈蓝色。由于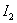 的氧化能力不强,所以只能滴定较强的还原剂,因此用于直接滴定的物质不多,有
的氧化能力不强,所以只能滴定较强的还原剂,因此用于直接滴定的物质不多,有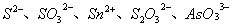 等。如可用
等。如可用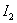 标准溶液滴定
标准溶液滴定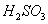 ,
,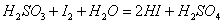 。
。
间接碘量法是利用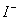 的还原性间接测定氧化物质含量的方法。测定时先将氧化物质,与过量的
的还原性间接测定氧化物质含量的方法。测定时先将氧化物质,与过量的 反应析出定量的
反应析出定量的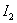 ,然后可用
,然后可用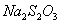 标准溶液滴定析出的
标准溶液滴定析出的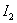 ,通过
,通过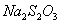 消耗量,计算氧化剂的含量这种方法称为间接碘量法。间接碘量法也有滴定条件:1、增加溶液的酸度;2、加入过量的
消耗量,计算氧化剂的含量这种方法称为间接碘量法。间接碘量法也有滴定条件:1、增加溶液的酸度;2、加入过量的 ;3、近终点时加入淀粉;4、室温及避光条件下滴定。间接碘量法也可用淀粉指示剂指示终点,根据蓝色消失确定滴定终点。
;3、近终点时加入淀粉;4、室温及避光条件下滴定。间接碘量法也可用淀粉指示剂指示终点,根据蓝色消失确定滴定终点。
(二)碘量法应用(维生素C含量测定)
维生素C分子中含有烯二醇基,易被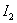 氧化成二酮基,反应式如下:
氧化成二酮基,反应式如下: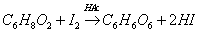 。测定时加入
。测定时加入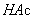 使溶液成弱酸性,减少维生素C的副反应,且不影响滴定速度。
使溶液成弱酸性,减少维生素C的副反应,且不影响滴定速度。
第一步是配置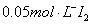 标准溶液;第二步是标定
标准溶液;第二步是标定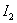 溶液浓度,可用已标定好的
溶液浓度,可用已标定好的 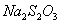 标准溶液来标定
标准溶液来标定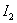 溶液浓度:
溶液浓度: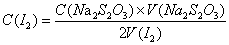 ;第三步是维生素C含量的测定并计算出维C含量。
;第三步是维生素C含量的测定并计算出维C含量。
配位滴定法
一、概述
利用形成配合物的反应进行滴定分析的方法称为配位滴定法,也称络合法。能够用于配位滴定的反应,必须具备以下条件:1、形成的配合物要相当稳定,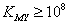 ,否则不易得到明显的滴定终点;2、在一定条件下,配位数必须固定(也只形成一种配位数的配合物);3、反应速度要快;4、要有适当的方法确定滴定的计量点。目前应用最为广泛的有机配位剂是乙二胺四乙酸,简称EDTA.
,否则不易得到明显的滴定终点;2、在一定条件下,配位数必须固定(也只形成一种配位数的配合物);3、反应速度要快;4、要有适当的方法确定滴定的计量点。目前应用最为广泛的有机配位剂是乙二胺四乙酸,简称EDTA.
二、EDTA配位滴定法的基本原理
(一)EDTA配合物的稳定性
水溶液中EDTA分子中互为对角线的两个羧基上的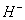 会转移到氮原子上,形成双偶极离子结构。EDTA与金属离子形成配位化合物的反应式:
会转移到氮原子上,形成双偶极离子结构。EDTA与金属离子形成配位化合物的反应式: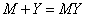 ,
,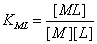 ,
,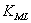 越大,配合物越稳定。
越大,配合物越稳定。
EDTA与金属离子形成的配合物具有下列特点:1、配位比较简单绝大多数为1:1,没有逐级配位现象;2、配位能力强,配合物稳定,滴定反应进行的完全程度高;3、配合物大多带电荷水溶性较好;4、配位反应的速度快,除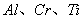 等金属外一般都能迅速地完成;5、配合物的颜色主要取决于金属离子的颜色。
等金属外一般都能迅速地完成;5、配合物的颜色主要取决于金属离子的颜色。
酸度会影响该反应,滴定时需满足条件: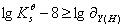 ,
,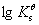 查表可得,它反应EDTA配合物的稳定性,
查表可得,它反应EDTA配合物的稳定性,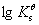 越大配合物越稳定,不同PH下EDTA的
越大配合物越稳定,不同PH下EDTA的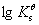 也可以查表得到。
也可以查表得到。
我们还应考虑其他配位剂的影响,其他络合剂同时存在的溶液中时会与金属离子反应,降低金属离子的浓度,配位滴定中常利用这个原理消除干扰离子。这种消除干扰的作用叫作掩蔽作用,起掩蔽作用的配位剂叫作掩蔽剂。
(二)金属指示剂
配位滴定中指示终点的方法有很多,其中最重要应用最多的是金属指示剂。它常常是一种配位剂,能与金属离子形成可溶于水的有色配合物。常见的金属指示剂有铬黑T、钙试剂等。铬黑T是一个具有弱酸性酚羟基的有色配位剂,在不同的酸度下显不同的颜色,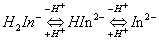 ,
,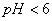 呈紫红色,
呈紫红色,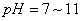 呈蓝色,
呈蓝色,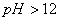 呈橙色。只有在
呈橙色。只有在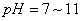 时进行滴定,颜色变化才显著。
时进行滴定,颜色变化才显著。
三、EDTA配位滴定应用(水的总硬度)
水的总硬度是指水中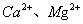 的总含量,水中钙镁酸式盐形成的硬度称为暂时硬度,钙镁的其他盐类如硫酸盐、氯化物等形成的硬度称为永久硬度,暂时硬度和永久硬度的总和称为总硬度,其单位用每升水中
的总含量,水中钙镁酸式盐形成的硬度称为暂时硬度,钙镁的其他盐类如硫酸盐、氯化物等形成的硬度称为永久硬度,暂时硬度和永久硬度的总和称为总硬度,其单位用每升水中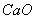 或
或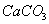 的含量来表示。
的含量来表示。
第一步需要配置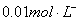 的EDTA标准溶液;第二步用
的EDTA标准溶液;第二步用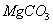 作基准物质标定其浓度,计算公式如下:
作基准物质标定其浓度,计算公式如下: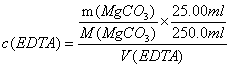 ;第三步是水的总硬度的测定,
;第三步是水的总硬度的测定,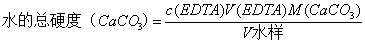 。
。
第二篇:氧化还原知识总结
氧化还原
一.基本概念:
1.氧化还原反应:
定义: 实质:电子转移(微观)。 特征:化合价升降(宏观)。
2. 化合价升降与电子得失的关系:

概念判断: 升 → 失 → 氧 → 还 → 氧
例题:2Na2S+Na2SO3+3H2SO4==3S↓+3Na2SO4+3H2O Cl2+H2O == HCl+HClO
二.常见的氧化剂和还原剂:
1.氧化剂: ①非金属性较强的单质:F2、C12、Br2、I2、02、O3、N2、P、S等
②非氧化性酸:稀H2S04、稀HCl、NaHSO4等
③氧化性酸:浓H2S04、浓、稀 HNO3、 HClO
④氧化性盐:KCl03、KMn04、固体硝酸盐、铁盐,次氯酸盐
⑤其他:、Mn02、Na202、N02、H202、银氨溶液、新制Cu(OH)2浊液
2.还原剂: ①金属性较强的单质:K、Na、Mg、A1、Zn、 Fe等
②某些非金属单质:H2、C、Si、P、S、N2等;
③还原性酸:H2S、 HI、HBr、亚硫酸、浓盐酸
④还原性盐:硫化物、、碘化物、溴化物、亚铁盐、亚硫酸盐、亚Sn盐
⑤其他:S02、CO、Fe(0H)2、H2O2、NH3等
三.氧化还原反应的基本规律:
1.守恒规律:
①得失电子守恒。(化合价升降守恒)
氧化剂获得电子总数必等于还原剂失去电子总数,
氧化剂中元素化合价降低总数等于还原剂中元素化合价升高总数,(化合价升降总数也等于电子转移总数)。
②质量守恒。反应前后各元素种类不变,各元素的原子数目,
在有离子参加的氧化还原反应中还有※③电荷守恒。反应前后离子所带电荷总数相等,
2.强者优先规律:
(1)同一种氧化剂与不同的还原剂反应时,还原性强的优先反应。
(2)同一种还原剂与不同的氧化剂反应时,氧化性强的优先反应。
如向含有Fe3+、Cu2+、Ag+的溶液中加入Fe粉,如何反应?_________
3.同一元素的价态变化规律:
高价氧,低价还,中间价两边转。相邻价不氧还。
①歧化反应(中间变两头)
同种元素的同种价态间发生氧化还原反应时,变成跟该元素价态相邻的两端的价态
②归中反应(两头变中间,只靠拢,不交叉)
同种元素的不同价态间发生氧化还原反应时,高价态和低价态相互反应变成它们相邻的中间价态
如二氧化硫氧化硫化氢 过氧化钠和二氧化碳反应
4.强弱传递规律:
同一氧化还原反应中,
氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物
四.掌握氧化性、还原性强弱的判断方法:
氧化剂具有氧化性 还原剂具有还原性
(1)根据方程式判断:同一氧化还原反应中
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
(2)根据物质活动性顺序比较判断:
①金属活动性顺序,
原子还原性逐渐减弱,对应阳离子氧化性逐渐增强
②非金属活动性顺序,
原子(或单质)氧化性逐渐减弱,对应阴离子还原性逐渐增强
Cl2> Br2> I2> S
(3)根据反应条件判断:
当不同的氧化剂作用于同一还原剂时根据反应条件的高、低来进行判断。
例如:制氯气的三个反应,由反应条件可以得出,
氧化性: KMn04>Mn02>02
(4)根据氧化产物的价态高低判断:
如;铁和铜分别与氯气和硫的反应
(5)根据元素周期表判断:
①同主族元素(从上到下),非金属原子(或单质)氧化性逐渐减弱,
对应阴离子还原性逐渐增强
②同周期主族元素(从左到右),
单质还原性逐渐减弱,氧化性逐渐增强,
阳离子氧化性逐渐增强,阴离子还原性逐渐减弱
(6)根据原电池、电解他的电极反应比较判断:
得失电子的强弱
(7)根据物质的浓度大小比较判断:
具有氧化性(或还原性)的物质的浓度越大,其氧化性(或还原性)越强,
反之,其氧化性(或还原性)越弱。
如氧化性: HNO3(浓)>HN03(稀)。
五.氧化还原反应方程式的配平:
(1)简单类型:写→标→列→配→观
___K2Cr2O7 +__HCl(浓) →__KCl+__CrCl3 +__Cl2↑ +__H2O
(2) 缺项配平(缺项,即化学方程式中尚有某些分子式空缺):
缺项一般常见为酸、碱或水。
例如:配平:__Ag3AsO4+__Zn__( )==__Ag↓+__ZnSO4+__AsH3↑+__H2O
不难看出,生成物中有 “SO4”,其它反应物不含硫,缺项可估计是H2SO4.
六.化还原反应的有关计算:
例:高锰酸钾和氢溴酸溶液发生如下反应:
KMnO4+HBr→Br2+MnBr2+KBr+H2O(未配平)其中,还原剂是____,若消耗0.1mol氧化剂,则被氧化的还原剂的物质的量是____mol,被氧化的Br-与未被氧化的Br-的个数比为____。(HBr,0.5 mol,5∶3)
七.置换反应一定是氧化还原反应 复分解反应一定不是氧化还原反应 化合,分解可能是氧化还原反应
八.双线桥法,单线桥法标电子转移
