第五单元 化学方程式
课题1 质量守恒定律
一、质量守恒定律
1、含义:
说明:①质量守恒定律只适用于化学变化,不适用于物理变化; ........
②没有参加反应的物质质量及不是反应生成的物质质量不能计入“总和”中; ..
③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏。
2、微观解释:在化学反应前后,原子的种类、数目、质量均保持不变(原子的“三不变”)。
3、化学反应前后
(1)一定不变宏观:反应物、生成物的总质量不变;元素种类、质量不变
微观:原子的种类、数目、质量不变
(2)一定改变宏观:物质的种类一定变
微观:分子种类一定变
(3)可能改变:分子总数可能变
二、化学方程式
1、含义:用化学式表示化学反应的式子。能直接反映质量守恒定律。
2、表示的意义:⑴表示反应物、生成物和反应条件
⑵表示各物质间的质量比(质量比=各物质的相对分子质量×各化学式前面的系数的积的
比)
⑶表示各物质的微粒个数比(即各化学式前面的系数比)
点燃 例如:以2H2+O22O为例
①表示氢气与氧气在点燃条件下生成水
②表示氢气、氧气与水的质量比为4:32:36
③表示氢分子、氧分子与水分子的个数比为2:1:2
点燃 3、化学方程式的读法 以2H2+O22O为例
①从反应物、生成物和反应条件角度:氢气与氧气在点燃条件下生成水
②从各物质的质量比角度:每4份质量的氢气与32份质量的氧气在点燃条件下生成36份质
量的水
③从各物质的微粒个数比角度:每2个氢分子与1个氧分子在点燃条件下生成2个水分子。
1
课题2 如何正确书写化学方程式
一、书写原则:
1、以客观事实为基础 2、遵守质量守恒定律(标准:两边原子的种类和数目相等)
二、方程式的配平
1、标准:方程式两边原子种类和数目相等即配平了
2、配平的原则:在化学式前面加上适当的系数来保证方程式两边原子种类和数目相等。
3、方法:最小公倍数法
最小公倍数法配平化学方程式的步骤
⑴、确定配平的起点元素:横线两边出现次数最少,且原子个数的最小公倍数最大的元素作为起点元素。
⑵、确定起点元素原子个数的最小公倍数。
⑶、确定含有起点元素的化学式的系数:用最小公倍数除以化学式中起点元素原子的个数的商作为该化学式前面的系数。
⑷、确定其它化学式前面的系数的顺序:依次确定含有除起点元素以外,横线两边出现次数由少到多的元素的化学式前面的系数。
⑸、最后将各系数调整为最简整数比。
举例:配平化学方程式: FeS2 + O2 点燃 Fe2O3 + SO2
⑴确定起点元素:由于Fe、S 元素在横线两边只出现了一次,且最小公倍数都为2,因此
Fe、S元素都可作为起点元素。
⑵若选择Fe作为起点元素,则原子个数的最小公倍数为2。
⑶确定FeS2 、SO2前面的系数:用最小公倍数2除以FeS2中Fe元素的原子个数1的商2作为的FeS2系数;用最小公倍数2除以Fe2O3中Fe元素的原子个数2的商1作为Fe2O3的系数;
2FeS2 + O2 点燃 1Fe2O3 + SO2
⑷确定O2 、SO2的系数:
①由于O2 、SO2中只含有O、S两种元素,S元素在方程式两边只出现了一次,因此先确定SO2 的系数,再确定O2的系数。由于方程式左边S原子的个数已确定为4,所以右边S原子的个数也为4。因此SO2的系数为4除以SO2中S元素的原子个数1的商4作为SO2。的系数。
2FeS2 + O2 点燃 1Fe2O3 + 4SO2
②由于方程式右边O原子的个数已确定为11,因此左边O原子的个数也为11。所以O2的系数为11除以O2中O元素的原子个数2的商11/2作为SO2。的系数。
2FeS2 + 11/2O2 点燃 1Fe2O3 + 4SO2
2
⑸再将各系数调整为最简整数比:即在方程式两边同时乘以2就可以。
点燃
4FeS2 + 11O2 2Fe2O3 + 8SO2
一、书写的步骤
1、写 写出反应物、生成物的化学式 2、配 配平方程式 3、注 注明反应条件和生成物的状态 4、等 将横线改为等号
课题3 利用化学方程式的简单计算
一、依据:利用化学方程式能反映物质间的质量比,且质量比呈正比例关系。
二、步骤:①设未知数;②根据题意写出方程式;③根据化学方程式找出已知量与未知量的质量比;④列出比例式,并求出未知数;⑤答 注意:
①由于方程式只能反应物质间的质量比,因此代入方程式中的各个量必须是质量。 ②由于方程式中各物质是纯净物,因此代入方程式中的量必须是纯净物的质量。 ③单位必须统一。
附:前面一至五单元要求掌握的化学方程式:
C + O2 点燃
CO2 S + O2
点燃
SO2
点燃
4P + 5O2 点燃
2P2O5 4Al + 3O2 Fe3O4 2Mg + O2
2Al2O3 2MgO
3Fe + 2O2 2H2O2 O2↑ 2KClO3
点燃
点燃
2O + O2↑ 2KMnO4 △
K2MnO4 + MnO2 +
MnO △ 点燃
2KCl+3O2↑ 2H2O
通电
2H2↑+ O2↑
2H22O
3
第二篇:人教版初三化学第二章知识点总结学生版
第二单元 我们周围的空气
课题1 空 气
一、空气成分的研究史
1、18世纪70年代,瑞典科学家舍勒和英国的科学家化学家普利斯特里,分别发现并制得了氧气。
2、法国科学家 最早运用天平作为研究工具,用定量的方法研究了空气的成分,第一次明确提出了“空气是由氧气和氮气组成的”。其中氧气约占空气总体积的1/5的结论。
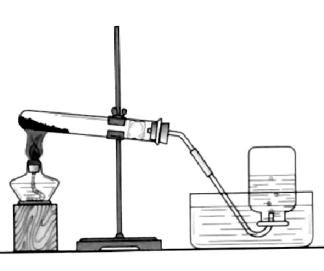
二、空气中氧气成分的测定:
1、装置图(见书P27)
2、实验现象:A、
B、
3、实验结论:说明空气不是单一的物质;氧气约占空气总体积的1/5。
4、原理:表达式:
5、注意事项:A、所用的红磷必须过量,过少则氧气没有全部消耗完
B、要等集气瓶(装置)冷却后才能打开弹簧夹,
C、装置的气密性要好,(否则测量结果偏小),
D、要先夹住橡皮管,然后再点红磷(否则测量结果偏大)。
思考:可否换用木炭、硫磺等物质?如能,应怎样操作?
答:不能用木炭或蜡烛(燃烧产生了气体,瓶内体积变化小),不能用铁(铁在空气中不能燃烧)
6、实际在实验中测得的结果比真实值小,其原因可能是
三、空气的主要成分(按体积分数):
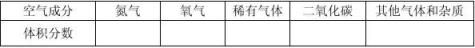
1、纯净物:由一种物质组成的叫纯净物
2、混合物:两种或多种物质组成的叫混合物
五、空气是一种宝贵的资源
1、氮气:无色、无味的气体,不溶于水,不燃烧也不支持燃烧,不能供给呼吸,化学性质
不活泼。
2、稀有气体:无色、无味的气体,通电时能发出不同颜色的光,化学性质很不活泼。
六、空气的污染及防治。
1、 造成空气污染的物质:有害气体(一氧化碳(CO)、二氧化氮(NO2)、二氧化硫(SO2))和烟尘。
2、污染来源:空气中的有害物质来自化石燃料的燃烧,石油化工厂排放的废气及汽车排放的尾气。
3、存在的环境问题:温室效应(二氧化碳含量过多引起)、臭氧空洞(飞机的尾气、氟里昂的排放)、酸雨(由二氧化硫、二氧化氮引起)。
4、防止空气污染的措施:加强大气质量监测,改善环境状态、植树造林、使用清洁能源。
5、目前空气污染指数包括:
课题2 氧气
一、氧气的物理性质
通常情况下,是无色无味的气体;密度 空气; 溶于水;降温后,氧气可以变为 液体,甚至 雪花状固体。
二、氧气的化学性质
(一)与(碳、硫、磷、铁)的反应
1、木炭(黑色固体)燃烧
实验现象:在氧气中:剧烈燃烧,发出 ,放出热量,生成一种无色无味气体,该气体能使澄清石灰水变浑浊。
能使澄清石灰水变浑浊。
文字表达式:
2、硫粉(淡黄色)燃烧:
实验现象:在空气中:发出微弱的 ,放出热量、生成一种带有刺激性气味的气体。
在氧气中:发出明亮的 , 放出热量、生成一种带有刺激性气味的气体。 文字表达式
实验时,要在瓶底装少量水( )。
3、红磷(暗红色固体)的燃烧
实验现象:
文字表达式:
注意:五氧化二磷(P2O5)是固体,不是气体
4、铁丝(银白色固体)在氧气中燃烧
实验现象:在空气中:剧烈燃烧, ,放出热量,生成一种 。
在氧气中: 红热,不燃烧
文字表达式:
注意:集气瓶底部铺 或加 ,防止 。
(二)其他物质与氧气的反应
某些物质在一些条件下,与氧气发生缓慢的氧化反应,成为缓慢氧化。缓慢氧化也放热。 如:动植物新陈代谢,金属的锈蚀,食物的腐烂、酒醋的酿造、农家肥的腐熟等等。
三、氧气的用途
(1)、供给呼吸:医疗上急救病人,登山、潜水、航空、宇航提供呼吸;
(2)、支持燃烧:炼钢、气焊与气接、液氧炸弹、火箭助燃剂
四、反应类型:
①:化合反应:由两种或两种以上的物质生成另一种物质的反应。
可表示为:A+B+?? → E (简称“多变一”)
②:分解反应:由一种反应物生成两种或两种以上其他物质的反应。
可表示为:AB→A+B+??。(简称:“一变多”)
③:氧化反应:物质与氧发生的化学反应。有氧气参加的反应一定属于氧化反应。氧化反应不一定是化合反应(石蜡燃烧),化合反应不一定是氧化反应。
课题3 实验室制取氧气
一、工业制法(分离液态空气法)
原理:利用液态氧和液态氮的沸点不同。—— 变化( 不同)
(1)具体过程
空 气
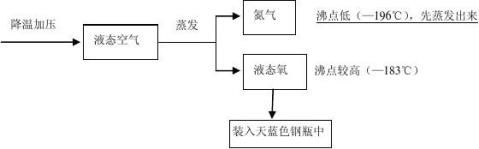
(2)注意:该过程是 变化
二、氧气的实验室制法(化学变化)
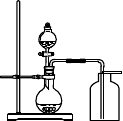
1、双氧水(过氧化氢)制取氧气
A、药品:过氧化氢(H2O2)和二氧化锰(黑色粉末 MnO2)
B实验原理:
表达式:
注:MnO2在该反应中是 ,起 作用
C、装置: 注意事项:
①、分液漏斗可以用长颈漏斗代替,但长颈漏斗的末端应该伸入液面以下,防止生成的气体从长颈漏斗中逸出; ②、该装置的优点:可以控制反应的速率。
2、用高锰酸钾、氯酸钾制取氧气
A、药品:
B、原理:
① 加热高锰酸钾:
表达式: ②加热氯酸钾(有少量的二氧化锰):
表达式:
注意:MnO2在该反应中是 ,起 作用
C
D、操作步骤:
① 连接装置:从下往上,从左往右
② 检查装置的气密性 :将导管的一端浸入水槽中,用手紧握试管外壁,若水中导管口有气泡冒出,证明装置不漏气。松开手后,导管口出现一段水柱。
③ 装入药品:按粉末状固体取用的方法(药匙或纸槽)
④固定装置 :固定试管时,试管口应略向下倾斜;铁夹应夹在试管的中上部
⑤加热药品:先预热,再集中加热
⑥收集气体:
a、刚排出的是空气;水排完后,应用玻璃片盖住瓶口,小心地移出水槽, 放在桌面上(密度比空气大)(防止气体逸出) b、用向上排空法。收集时导管应(为了排尽瓶内空气)
⑦先将导管移出水面
⑧再停止加热
E、易错事项:
a). 试管口要,使试管底部炸裂。药品应平铺在试管底部 b). 导气管只要出橡皮塞:有利于产生的气体排出。
c). 用高锰酸钾制取氧气时,试管口:防止高锰酸钾粉末进入导气管,污染制取的气体和水槽中的水。
d). 排气法收集气体时,导气管要伸入接近集气瓶底部:有利于集气瓶内空气排出,使收集的气体更纯。
e). 实验结束后,先将导气管移出水面,然后熄灭酒精灯: F、收集方法:
① 排水法(不易溶于水,且不与水反应)
② 向上排空法(密度比空气大,且不与空气中的成分反应)
G、检验、验满
检验:用带火星的木条 ,发现木条复燃,说明是氧气;
验满:用带火星的木条 ,若木条复燃,证明已满。
三、催化剂:
1、 概念:在化学反应中能改变其他物质的反应速率(加快或变慢),但本身的化学性质和
质量在反应前后没有发生变化的物质。
2、 特点:
注意:①催化剂不能改变生成物的质量,不能决定反应的进行
②催化剂不是反应物、又不是生成物
③催化剂仅针对某一反应,并不是所有反应的催化剂
④某一反应的催化剂可能不止一种
3、二氧化锰在一些反应中不只作催化剂,催化剂不一定就只有二氧化锰。(在过氧化氢溶液制取氧气中,催化剂可以用硫酸铜溶液、氧化铁、氧化铜、红砖粉末)。在氯酸钾制取氧气中,二氧化锰的质量和化学性质不变,但质量分数变大。
四、分解反应:
1、概念:由一种物质反应生成两种及以上物质的反应
2、特点:一变多
