
快乐学习,尽在中小学教育网
常见官能团的性质
陈松华
官能团是决定有机化合物性质的原子或原子团。官能团不仅对有机化合物的化学性质有决定性作用,而且还决定了有机化合物的种类和有机化合物的同分异构体。
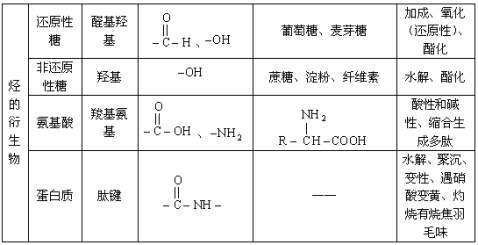
一. 中学有机化合物分类及常见官能团名称和主要性质

第1页(共8页)
正保远程教育 地址:北京市知春路1号学院国际大厦18层 24小时客服热线:010-82310666

快乐学习,尽在中小学教育网
注:烷烃中的烷基,芳香烃中的苯基都不是官能团。
二. 有机官能团的化学性质与有机基本反应
1. 氧化反应
(1)燃烧。凡是含碳氢的有机化合物燃烧都生成二氧化碳和水。
烃的燃烧通式:
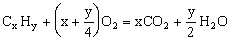
烃的含氧衍生物的燃烧通式:
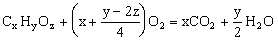
(2)被酸性高锰酸钾氧化。能使酸性高锰酸钾褪色的有机物有:
①不饱和烃、不饱和烃的衍生物(含碳碳双键、碳碳三键);
②苯的同系物(苯基上的烃基易被氧化);
③含醛基的有机物:醛、甲酸、甲酸酯、甲酸盐、葡萄糖;
④石油产品(裂解气、裂化气)。
(3)羟基的催化氧化。某些含羟基的有机物在催化剂的作用下,能被氧气氧化成醛或酮。 当与羟基相连的碳原子上有两个氢原子时,羟基能被氧化成醛基。如:
Cu2CH3CH2OH?O2????2CH3CHO?2H2O ?
当与羟基相连的碳原子上有一个氢原子时,羟基能被氧化成羰基(碳氧双键)。如:
第2页(共8页)
正保远程教育 地址:北京市知春路1号学院国际大厦18层 24小时客服热线:010-82310666

快乐学习,尽在中小学教育网
当与羟基相连的碳原子上没有氢原子时,羟基不能被氧化。
(4)醛基的氧化。有机物中的醛基,不仅可以被氧气氧化成羧基;而且还能被两种弱氧化剂(银氨离子和铜离子)氧化成羧基。
醛基被氧气氧化。如:
2CH3CHO?O2?催化剂???2CH3COOH ?
银镜反应,醛基被Ag?NH3?2氧化。如:
△CH3CHO?2?Ag(NH3)2??2OH????CH3COO??NH4??2Ag??3NH3?H2O ???
醛基被Cu(OH)2氧化。如:
?CH3CHO?2Cu(OH)2???CH3COOH?Cu2O??2H2O
2. 取代反应。
有机物分子中的某些原子或原子团被其他原子或原子团所代替的反应叫做取代反应。中学常见的取代反应有:
(1)烷烃与卤素单质在光照下的取代。如:
光CH4?Cl2???CH3Cl?HCl
(2)苯与苯的同系物与卤素单质、浓硝酸等的取代。如:

(3)酚与浓溴水的取代。如:
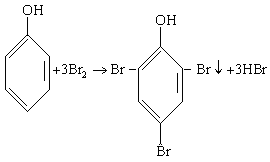
(4)酯化反应。酸和醇在浓硫酸作用下生成酯和水的反应,其实质是羧基与羟基生成酯基和水的反应。如:
第3页(共8页)
正保远程教育 地址:北京市知春路1号学院国际大厦18层 24小时客服热线:010-82310666
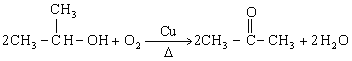

快乐学习,尽在中小学教育网
CH3CH2OH?CH3

COOHCH3COOCH2CH3?H2O
(5)水解反应。水分子中的?OH或?H取代有机化合物中的原子或原子团的反应叫水解反应。
①卤代烃水解生成醇。如:
CH3CH2Br?H2O?NaOH???CH3CH2OH?HBr
②酯水解生成羧酸(羧酸盐)和醇。如:
CH3COOC2H5?H2
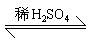
OCH3COOH?C2H5OH
CH3COOC2H5?NaOH?CH3COONa?C2H5OH
③二糖和多糖水解成单糖。如:
(C6H10O5)n?nH2O?nC6H12O6
④蛋白质水解生成氨基酸。
3. 加成反应。不饱和的碳原子跟其他原子或原子团结合生成别的有机物的反应。
(1)含碳碳双键的物质,如烯烃与氢气、卤素、卤化氢、水等加成。如:
CH2?CH2?Br2?CH2BrCH2Br
(2)含碳碳三键的物质,如炔烃与氢气、卤素、卤化氢等加成。如:
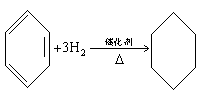
(3)苯环与氢气加成。如:
CH?CH?2Br2?CHBr2CHBr2
(4)某些含碳氧双键的物质,如醛和酮与氢气发生加成反应生成醇。如:
NiCH3CHO?H2???CH3CH2OH ?
CH3O|||NiCH3?C?CH3?H2???CH3?CH?OH ?
4. 消去反应。有机分子中脱去一个小分子(水、卤化氢等),而生成不饱和(含碳碳双键或碳碳三键)化合物的反应,叫消去反应。
第4页(共8页)
正保远程教育 地址:北京市知春路1号学院国际大厦18层 24小时客服热线:010-82310666

快乐学习,尽在中小学教育网
(1)卤代烃在氢氧化钠醇溶液中消去。如:
醇CH3CH2Br?NaOH???CH2?CH2??NaBr?H2O ?
(2)含羟基的物质在浓硫酸作用下消去。含羟基的物质发生消去在结构上满足如下条件:与羟基直接相连的碳原子的相邻碳原子上有氢原子。如:
CH3|浓H2SO4浓H2SO4CH3CH2OH??????CH2?CH2??H2O,CH3?CH?OH??????170℃170℃
CH3|
CH3?CH?CH2?H2O,CH3?C?CH3不能发生消去反应。 |
CH3

高中有机化学中各种官能团的性质
悬赏分:0 - 解决时间:2008-11-5 20:35
提问者: 李闰星 - 魔法师 四级
最佳答案
1。卤化烃:官能团,卤原子 在碱的溶液中发生“水解反应”,生成醇 在碱的醇溶液中发生“消去反应”,得到不饱和烃
2。醇:官能团,醇羟基 能与钠反应,产生氢气 能发生消去得到不饱和烃(与羟基相连的碳直接相连的碳原子上如果没有氢原子,不能发生消去) 能与羧酸发生酯化反应 能被催化氧化成醛(伯醇氧化成醛,仲醇氧化成酮,叔醇不能被催化氧化)
3。醛:官能团,醛基 能与银氨溶液发生银镜反应 能与新制的氢氧化铜溶液反应生成红色沉淀 能被氧化成羧酸 能被加氢还原成醇
第5页(共8页)
正保远程教育 地址:北京市知春路1号学院国际大厦18层 24小时客服热线:010-82310666

快乐学习,尽在中小学教育网
4。酚,官能团,酚羟基 具有酸性 能钠反应得到氢气 酚羟基使苯环性质更活泼,苯环上易发生取代,酚羟基在苯环上是邻对位定位基 能与羧酸发生酯化
5。羧酸,官能团,羧基 具有酸性(一般酸性强于碳酸) 能与钠反应得到氢气 不能被还原成醛(注意是“不能”) 能与醇发生酯化反应
6。酯,官能团,酯基 能发生水解得到酸和醇
醇、酚:羟基(-OH);伯醇羟基可以消去生成碳碳双键,酚羟基可以和NaOH反应生成水,与Na2CO3反应生成NaHCO3,二者都可以和金属钠反应生成氢气
醛:醛基(-CHO); 可以发生银镜反应,可以和斐林试剂反应氧化成羧基。与氢气加成生成羟基。
酮:羰基(>C=O);可以与氢气加成生成羟基
羧酸:羧基(-COOH);酸性,与NaOH反应生成水,与NaHCO3、Na2CO3反应生成二氧化碳
硝基化合物:硝基(-NO2);
胺:氨基(-NH2). 弱碱性
烯烃:双键(>C=C<)加成反应。
炔烃:三键(-C≡C-) 加成反应
醚:醚键(-O-) 可以由醇羟基脱水形成
磺酸:磺基(-SO3H) 酸性,可由浓硫酸取代生成
腈:氰基(-CN)
酯: 酯 (-COO-) 水解生成羧基与羟基,醇、酚与羧酸反应生成
注: 苯环不是官能团,但在芳香烃中,苯基(C6H5-)具有官能团的性质。苯基是过去的提法,现在都不认为苯基是官能团
官能团:是指决定化合物化学特性的原子或原子团. 或称功能团。
卤素原子、羟基、醛基、羧基、硝基,以及不饱和烃中所含有碳碳双键和碳碳叁键等都是官能团,官能团在有机化学中具有以下5个方面的作用。
第6页(共8页)
正保远程教育 地址:北京市知春路1号学院国际大厦18层 24小时客服热线:010-82310666

快乐学习,尽在中小学教育网
1.决定有机物的种类
有机物的分类依据有组成、碳链、官能团和同系物等。烃及烃的衍生物的分类依据有所不同,可由下列两表看出来。
烃的分类法:
烃的衍生物的分类法:
2.产生官能团的位置异构和种类异构
中学化学中有机物的同分异构种类有碳链异构、官能团位置异构和官能团的种类异构三种。对于同类有机物,由于官能团的位置不同而引起的同分异构是官能团的位置异构,如下面一氯乙烯的8种异构体就反映了碳碳双键及氯原子的不同位置所引起的异构。
对于同一种原子组成,却形成了不同的官能团,从而形成了不同的有机物类别,这就是官能团的种类异构。如:相同碳原子数的醛和酮,相同碳原子数的羧酸和酯,都是由于形成不同的官能团所造成的有机物种类不同的异构。
3.决定一类或几类有机物的化学性质
官能团对有机物的性质起决定作用,-X、-OH、-CHO、-COOH、-NO2、-SO3H、-NH2、RCO-,这些官能团就决定了有机物中的卤代烃、醇或酚、醛、羧酸、硝基化合物或亚硝酸酯、磺酸类有机物、胺类、酰胺类的化学性质。因此,学习有机物的性质实际上是学习官能团的性质,含有什么官能团的有机物就应该具备这种官能团的化学性质,不含有这种官能团的有机物就不具备这种官能团的化学性质,这是学习有机化学特别要认识到的一点。例如,醛类能发生银镜反应,或被新制的氢氧化铜悬浊液所氧化,可以认为这是醛类较特征的反应;但这不是醛类物质所特有的,而是醛基所特有的,因此,凡是含有醛基的物质,如葡萄糖、甲酸及甲酸酯等都能发生银镜反应,或被新制的氢氧化铜悬浊液所氧化。
4.影响其它基团的性质
有机物分子中的基团之间存在着相互影响,这包括官能团对烃基的影响,烃基对官能团的影响,以及含有多官能团的物质中官能团之间的的相互影响。
① 醇、苯酚和羧酸的分子里都含有羟基,故皆可与钠作用放出氢气,但由于所连的基团不同,在酸性上存在差异。
R-OH 中性,不能与NaOH、Na2CO3反应;
C6H5-OH 极弱酸性,比碳酸弱,不能使指示剂变色,能与NaOH反应,不能与Na2CO3反应;
R-COOH 弱酸性,具有酸的通性,能与NaOH、Na2CO3反应。
显然,羧酸中,羧基中的羰基的影响使得羟基中的氢易于电离。
② 醛和酮都有羰基(>C=O),但醛中羰基碳原子连接一个氢原子,而酮中羰基碳原子上连接着烃基,故前者具有还原性,后者比较稳定,不为弱氧化剂所氧化。
③ 同一分子内的原子团也相互影响。如苯酚,-OH使苯环易于取代(致活),苯基使-OH显示酸性(即电离出H+)。果糖中,多羟基影响羰基,可发生银镜反应。
由上可知,我们不但可以由有机物中所含的官能团来决定有机物的化学性质,也可以由物质的化学性质来判断它所含有的官能团。如葡萄糖能发生银镜反应,加氢还原成六元醇,可知具有醛基;能跟酸发生酯化生成葡萄糖五乙酸酯,说明它有五个羟基,故为多羟基醛。
5.有机物的许多性质发生在官能团上
第7页(共8页)
正保远程教育 地址:北京市知春路1号学院国际大厦18层 24小时客服热线:010-82310666

快乐学习,尽在中小学教育网
有机化学反应主要发生在官能团上,因此,要注意反应发生在什么键上,以便正确地书写化学方程式。
如醛的加氢发生在醛基碳氧键上,氧化发生在醛基的碳氢键上;卤代烃的取代发生在碳卤键上,消去发生在碳卤键和相邻碳原子的碳氢键上;醇的酯化是羟基中的O—H键断裂,取代则是C—O键断裂;加聚反应是含碳碳双键(>C=C<)(并不一定是烯烃)的化合物的特有反应,聚合时,将双键碳上的基团上下甩,打开双键中的一键后手拉手地连起来。
作者:王宝俊来源:k12zy.com时间:2005-08-23 查看15
本文为网络收集的文档文件的文本样式预览,部分可能不能显示插图等其他格式文件,你也可以通过下载察看文档文件版本。
(四) 官能团的性质
首先简要回顾一下中学有机化学中的主要官能团:① C=C 加成、加聚; ②C≡C 加成 ③ 易取代难加成 ④-OH(醇) 置换、取代(卤代、分子间脱水、酯化)、消去(分子内脱水)、氧化 ⑤ 中和、取代、显色、缩聚 ⑥ -CHO 加成、氧化、还原 ⑦-COOH 中和、脱羧、酯化(取代) ⑧ -COO- 水解(取代)。
一些规律性的东西:① -OH、-CHO、-COOH是亲水基团,分子中数目越多、份量越大,则分子越易溶于水;②能发生加成反应的有:C=C、 C≡C、 、-CHO、-CO-,而羧基和酯基不能加成! ③能发生消去反应只有卤代烃和醇,但没有α-H则不能消去;④能发生加成反应的除(HCHO)外只有烯烃;⑤能发生缩聚反应的官能团:(酚、醛或酮),二元醇、二元羧酸、氨基酸等双官能团物质;⑥减少碳原子通过脱羧反应,增加碳原子则通过醛或酮的二聚反应或聚合反应。
第8页(共8页)
正保远程教育 地址:北京市知春路1号学院国际大厦18层 24小时客服热线:010-82310666
第二篇:高中化学常见物的性质
1.颜色的规律 (1)常见物质颜色 ..以红色为基色的物质 红色:难溶于水的Cu,Cu2O,Fe2O3,HgO等 碱液中的酚酞酸液中甲基橙石蕊及pH试纸遇到较强酸时及品红溶液 橙红色:浓溴水甲基橙溶液氧化汞等 棕红色:Fe(OH)3固体Fe(OH)3水溶胶体等 ..以黄色为基色的物质 黄色:难溶于水的金碘化银磷酸银硫磺黄铁矿黄铜矿(CuFeS2)等 溶于水的FeCl3甲基橙在碱液中钠离子焰色及TNT等 浅黄色:溴化银碳酦银硫沉淀硫在CS2中的溶液,还有黄磷Na2O2氟气 棕黄色:铜在氯气中燃烧生成CuCl2的烟 ..以棕或褐色为基色的物质 碘水浅棕色碘酒棕褐色铁在氯气中燃烧生成FeCl3的烟等 ..以蓝色为基色的物质 蓝色:新制Cu(OH)2固体胆矾硝酸铜溶液中淀粉与碘变蓝石蕊试液碱变蓝pH试纸与弱碱变蓝等 浅蓝色:臭氧液氧等 蓝色火焰:硫硫化氢一氧化碳的火焰甲烷氢气火焰(蓝色易受干扰) ..以绿色为色的物质 浅绿色:Cu2(OH)2CO3,FeCl2,FeSO4?7H2O 绿色:浓CuCl2溶液pH试纸在约pH=8时的颜色 深黑绿色:K2MnO4 黄绿色:Cl2及其CCl4的萃取液 ..以紫色为基色的物质 KMnO4为深紫色其溶液为红紫色碘在CCl4萃取液碘蒸气中性pH试纸的颜色K+离子的焰色等 ..以黑色为基色的物质 黑色:碳粉活性碳木碳烟怠氧化 铜四氧化三铁硫化亚铜(Cu2S)硫化铅硫化汞硫化银硫化亚铁氧化银(Ag2O) 浅黑色:铁粉 棕黑色:二氧化锰 ..白色物质 无色晶体的粉末或烟尘; 与水强烈反应的P2O5; 难溶于水和稀酸的:AgCl,BaSO3,PbSO4; 难溶于水的但易溶于稀酸:BaSO3,Ba3(PO4)2,BaCO3,CaCO3,Ca3(PO4)2,CaHPO4,Al(OH)3,Al2O3,ZnO,Zn(OH)2,ZnS,Fe(OH)2,Ag2SO3,CaSO3等; 微溶于水的:CaSO4,Ca(OH)2,PbCl2,MgCO3,Ag2SO4; 与水反应的氧化物:完全反应的:BaO,CaO,Na2O; 不完全反应的:MgO 灰色物质石墨灰色鳞片状砷硒(有时灰红色)锗等(2)离子在水溶液或水合晶体的颜色 水合离子带色的:Fe2+:浅绿色; Cu2+:蓝色; Fe3+:浅紫色呈黄色因有[FeCl4(H2O)2] 2-;MnO4-:紫色:血红色;:苯酚与FeCl3的反应开成的紫色主族元素在水溶液中的离子(包括含氧酸根)无色运用上述规律便于记忆溶液或结晶水合物的颜色(3)主族金属单质颜色的特殊性 A,A,A,A的金属大多数是银白色 铯:带微黄色钡:带微黄色 铅:带蓝白色铋:带微红色 (4)其他金属单质的颜色 铜呈紫红色(或红),金为黄色,其他金属多为银白色,少数为灰白色(如锗) (5)非金属单质的颜色 卤素均有色;氧族除氧外,均有色;氮族除氮外
,均有色;碳族除某些同素异形体(金钢石)外,均有色 2.物质气味的规律(常见气体挥发物气味) 没有气味的气体:H2,O2,N2,CO2,CO,稀有气体,甲烷,乙炔 有刺激性气味:HCl,HBr,HI,HF,SO2,NO2,NH3?HNO3(浓液)乙醛(液) 具有强烈刺激性气味气体和挥发物:Cl2,Br2,甲醛,冰醋酸 稀有气味:C2H2 臭鸡蛋味:H2S 特殊气味:苯(液)甲苯(液)苯酚(液)石油(液)煤焦油(液)白磷 特殊气味:乙醇(液)低级酯 芳香(果香)气味:低级酯(液) 特殊难闻气味:不纯的C2H2(混有H2S,PH3等) 3.熔点沸点的规律 晶体纯物质有固定熔点;不纯物质凝固点与成分有关(凝固点不固定) 非晶体物质,如玻璃水泥石蜡塑料等,受热变软,渐变流动性(软化过程)直至液体,没有熔点 沸点指液体饱和蒸气压与外界压强相同时的温度,外压力为标准压(1.01 105Pa)时,称正常沸点外界压强越低,沸点也越低,因此减压可降低沸点沸点时呈气液平衡状态 (1)由周期表看主族单质的熔沸点 同一主族单质的熔点基本上是越向下金属熔点渐低;而非金属单质熔点沸点渐高但碳族元素特殊,即C,Si,GeSn越向下,熔点越低,与金属族相似还有A族的镓熔点比铟铊低,A族的锡熔点比铅低 (2)同周期中的几个区域的熔点规律 高熔点单质 C,Si,B三角形小区域,因其为原子晶体,熔点高金刚石和石墨的熔点最高大于3550,金属元素的高熔点区在过渡元素的中部和中下部,其最高熔点为钨(3410) 低熔点单质 非金属低熔点单质集中于周期表的右和右上方,另有IA的氢气其中稀有气体熔沸点均为同周期的最低者,而氦是熔点(-272.2,26 105Pa)沸点(268.9)最低 金属的低熔点区有两处:IAB族Zn,Cd,Hg及A族中Al,Ge,Th;A族的Sn,Pb;A族的Sb,Bi,呈三角形分布最低熔点是Hg(-38.87),近常温呈液态的镓(29.78)铯(28.4),体温即能使其熔化 (3)从晶体类型看熔沸点规律 原子晶体的熔沸点高于离子晶体,又高于分子晶体金属单质和合金属于金属晶体,其中熔沸点高的比例数很大(但也有低的) 在原子晶体中成键元素之间共价键越短的键能越大,则熔点越高判断时可由原子半径推导出键长键能再比较如熔点: 金刚石>碳化硅>晶体硅 分子晶体由分子间作用力而定,其判断思路是: 结构性质相似的物质,相对分子质量大,范德华力大,则熔沸点也相应高如烃的同系物卤素单质稀有气体等 相对分子质量相同,化学式也相同的物质(同分异构体),一般烃中支链越多,熔沸点越低烃的衍生物中醇的沸点高于醚;羧酸沸点高于酯
;油脂中不饱和程度越大,则熔点越低如:油酸甘油酯常温时为液体,而硬脂酸甘油酯呈固态 上述情况的特殊性最主要的是相对分子质量小而沸点高的三种气态氢化物:NH3,H2O,HF比同族绝大多数气态氢化物的沸点高得多(主要因为有氢键) (4)某些物质熔沸点高低的规律性 同周期主族(短周期)金属熔点如 Li 碱土金属氧化物的熔点均在2000以上,比其他族氧化物显著高,所以氧化镁氧化铝是常用的耐火材料 卤化钠(离子型卤化物)熔点随卤素的非金属性渐弱而降低如:NaF>NaCl>NaBr>NaI 4.物质溶解性规律 (1)气体的溶解性 常温极易溶解的 NH3[1(水):700(气)] HCl(1:500) 还有HF,HBr,HI,甲醛(40%水溶液福尔马林) 常温溶于水的 CO2(1:1) Cl2(1:2) H2S(1:2.6) SO2(1:40) 微溶于水的 O2,O3,C2H2等 难溶于水的 H2,N2,CH4,C2H2,NO,CO等 (2)液体的溶解性 易溶于水或与水互溶的 如:酒精丙酮醋酸硝酸硫酸 微溶于水的 如:乙酸乙酯等用为香精的低级酯 难溶于水的 如:液态烃醚和卤代烃 (3)固体的水溶性(无机物略) 有机物中羟基和羧基具有亲水性,烃基具有憎水性,烃基越大,则水溶性越差,反而易I溶于有机溶剂中如:甲酸乙酸与水互溶,但硬脂酸油酸分子中因COOH比例过少反而不溶于水而溶于CCl4,汽油等有机溶剂苯酚三溴苯酚苯甲酸均溶于苯 (4)从碘溴氯的水溶液中萃取卤素的有机溶剂 如:苯汽油乙醚乙酸乙酯CCl4CS2等 (5)白磷硫易溶于CS2 (6)常见水溶性很大的无机物 如:KOH,NaOH,AgNO3溶解度在常温超过100g(AgNO3超过200g)KNO3在20溶解度为31.6g,在100溶解度为246g溶解度随温度变化甚少的物质常见的只有NaCl (7)难溶于水和一般溶剂的物质 原子晶体(与溶剂不相似)如:C,Si,SiO2,SiC等其中,少量碳溶于熔化的铁 有机高分子:纤维素仅溶于冷浓H2SO4铜氨溶液和CS2跟NaOH作用后的溶液中,已热固化的酚醛树脂不溶于水或一般溶剂 5.常见的有毒物质 (1)剧毒物质 白磷偏磷酸氰化氢(HCN)及氰化物(NaCN,KCN等)砒霜(As2O3)硝基苯等 CO(与血红蛋白结合),Cl2,Br2(气),F2(气),HF,氢氟酸等 (2)毒性物质 NO(与血红蛋白结合),NO2,CH3OH,H2S 苯酚甲醛二氧化硫重铬酸盐汞盐可溶性钡盐可溶性铅盐可溶性铜盐等 这些物质的毒性,主要是使蛋白质变性,其中常见的无机盐如:HgCl2,BaCl2,Pb(CHCOO)2;铜盐也使蛋白质凝固变性,但毒性较小,此外铍化合物也有相当的毒性钦酒过多也有一定毒性汞蒸气毒性严重有些塑料如聚氯乙烯制品(含增塑剂)不宜盛
放食品等
