有关烃燃烧的规律 巧解含烃的混合气体计算题
一、甲烷、乙烯、乙炔的燃烧对比:
1.燃烧时的火焰亮度、烟量对比

由烷、烯、炔的通式,知其W(C)依次增大,故燃烧时分别产生无黑烟、有黑烟、浓烟等现象,W(C)越大黑烟越多。此性质也可用于典型物质的鉴别。
2.等物质的量的三者完全燃烧时放出热量最多的是乙烯,但火焰温度最高的却是乙炔,氧炔焰的温度可高达3000℃以上。
二、烷烯炔各类烃含碳(或氢)质量分数的变化规律:
1.烷烃:CnH2n+2(n≥1)
W(C)=12n/(14n+2)×100% 随n的增大,烷烃W(C)逐渐增大,但永远小于85.7%。甲烷是烷烃中W(H)最高的。
2.烯烃(或环烷烃):CnH2n(n≥2)
W(C)=12n/14n×100%=85.7%即烯烃的W(C)是固定不变的。
3. 炔烃(或二烯烃):CnH2n-2(n≥2)
W(C)=12n/(14n-2)×100% 随n的增大,炔烃W(C)逐渐减小,但总比烯烃的W(C)高,即总大于85.7%。乙炔是炔烃中含碳量最高的。
三、烃的燃烧规律:
烃的可燃性是烃的一个基本性质,有关烃的燃烧计算和比较是中学化学中常见的习题,掌握烃的燃烧规律,对解决这类习题会起到事半功倍的效果。烃类燃烧可用通式表示:CxHy + (x+y/4)O2 点燃 xCO2 + y/2H2O
1. 等物质的量的不同烃燃烧时的耗氧规律:
(1)耗O2量取决于(x+y/4),(x+y/4)越大,消耗氧气越多。
(2)产生CO2的量取决于x,x越大,产生CO2的量越多。
(3)产生H2O的量取决于y,y越大,产生H2O的量越多。
例1:等物质的量的CH4 、C2H4 、C2H2,分别在足量氧气中完全燃烧,以下说法正确的是…………………………………………………………( )
A.C2H2含碳量最高,燃烧生成的CO2最多
B.C2H2燃烧时火焰最明亮
C.CH4含氢量最高,燃烧生成的水最多
D.CH4 、C2H4燃烧生成的水质量不同,消耗的氧气不同。
2.等质量的不同烃完全燃烧时的耗氧规律:
1molC(12g)消耗1mol O2,而4molH(4g)也消耗1molO2,故质量相等的不同烃完全燃烧时,氢元素的质量分数H%越大,消耗O2越多,产生的H2O越多;反之碳元素的质量分数C%越大,消耗O2越少,产生的CO2则越多。或者说等质量的烃完全燃烧时,消耗氧气的量取决于CxH中y/x的值,此值越大,耗氧量越多。
例2:等质量的以下四种烃完全燃烧,消耗氧气的量最多的是…………( )
A.CH4 B.C2H6 C.C3H6 D.C6H6
3.最简式相同,质量相等的两种烃完全燃烧时消耗氧气相等: 最简式相同的烃有:(1)烯烃和环烷烃;(2)含n个碳原子的炔烃与含3n个碳原子的苯的同系物;(3)乙炔与苯、苯乙烯等。
例3:下列各组烃的混合物,只要总质量一定,无论它们按什么比例混合,完全燃烧后生成二氧化碳和水都为恒量的是……………………………( )
A.C2H2 C2H6 B.C2H4 C3H8
C.C2H2 C6H6 D.C3H4 C3H6
3.同温同压下烃完全燃烧前后气体体积变化规律:
(1) 若所给条件下生成的水呈气态。
由通式得△V= V后—V前= (x+y/2)—(1+ x+y/4)= y/4—1
可知:a.燃烧前后体积变化只与y有关。
b.若y=4,即氢原子个数为4,则燃烧前后气体体积不变,如CH4
C2H4和C3H4的燃烧;若y>4,则反应后气体体积增加,如C2H6和C4H8等烃的燃烧;若y<4,则反应后气体体积减少,只有C2H2的燃烧。
c.可以根据体积差建立与烃、氧气、二氧化碳与水的量的计算关系。
(2)若所给条件下生成的水呈液态。
由通式得△V= V后—V前= x-(1+x+y/4)=—(1+ y/4)<0
可知:a.无论y取何值,V后<V前,既反应后气体体积减小。
b.燃烧前后体积变化只与y有关。
c.可以根据体积差建立与烃、氧气、二氧化碳与水的量的计算关系。
例4:120℃,1体积某烃和4体积氧气混合,完全燃烧后恢复到原来的温度和压强,体积不变。该烃分子式中所含碳原子数不可能是……………( )
A.1 B.2 C.3 D.4
巧解含烃的混合气体计算题
1. 守恒法:此法在化学计算中应用很广泛,用此法可求元素的相对原子质量、物质的相对分子质量、分子式、混合物的组成以及进行溶解度、溶液浓度等方面的计算。
例题:把mmol C2H4和nmol H2混合于密闭容器中,在适当的条件下,反应达到平衡时生成pmol C2H6,若将所得平衡混合气体完全燃烧生成二氧化碳和水,则需要氧气多少摩尔?
解析:若按化学平衡问题先求出平衡时混合气体各组分的物质的量以及它们分别燃烧各需要氧气多少摩尔,再求氧气总物质的量,则太繁琐。C2H4和H2在整个加成反应过程中C、H原子个数都不变,因而平衡时混合气体燃烧的耗氧量等于反应前C2H4和H2燃烧的耗氧量。
平衡时混合气体燃烧的耗氧量等于(3m+n/2)mol。
练习:一定量的甲烷CH4燃烧后得到的产物是一氧化碳、二氧化碳和水蒸气,此混合气的质量为49.6g,当其缓缓通过足量的无水氯化钙时气体质量减少25.2g,则混合气体中一氧化碳的质量是多少克?
解析:设产物中一氧化碳的物质的量为x,二氧化碳的物质的量为y。由碳原子守恒可得CH4的物质的量为x+y,又由氢原子守恒可得生成水的物质的量为2(x+y),则:
2(x+y)×18g/mol=25.2
28g/mol×x +44g/mol×y=49.6-25.2
解的x=0.4mol,y=0.3mol
一氧化碳的质量为0.4mol×28g/mol=11.2g
2.方程式叠加法:
例题:将x mol氧气,y mol甲烷和z mol过氧化钠放入密闭容器中,在150℃条件下用点火花引发,恰好完全反应后,容器内压强为0,通过计算确立x、y和z之间的关系式:
解析:根据反应后气体压强等于0,所以可将以下反应方程式:
2CH4+4O2→2CO2+4H2O 2CO2+ 2Na2O2 →2Na2CO3+O2 2H2O+ 2Na2O2→4 NaOH+O2相加消去气体,得:
2CH4+O2+ 6Na2O2→8NaOH+2Na2CO3 所以x:y:z=1:2:6
练习:若要使0.5mol CH4完全和氯气发生取代反应,并生成相同物质的量的四种取代物,则需要氯气的物质的量为多少摩尔?
4CH4+10Cl2→CH3Cl+ CH2Cl2+ CHCl3 +CCl 4+10HCl 则需氯气1.25mol
3.十字交叉法:十字交叉法一般只适用于两种已知成分组成的混合体系,解题关键往往在于求平均值。其广泛应用于有关同位素、相对原子质量、溶质质量、二组分混合物质量分数、化学反应中的物质的量、体积、电子转移数及反应热等方面的计算。
例题:CH4和C2H4混合气体,其密度是同温同压下乙烷的2/3,求混合气体中甲烷的质量分数。
解析:相同状况下气体密度之比等于相对分子质量之比:M=2/3×M(C2H6)=20,由十字交叉法得:
 CH4 16 8
CH4 16 8

 20 =2:1
20 =2:1
C2H4 28 4
 混合气体中甲烷的质量分数为2×16/(2×16+1×28)×100%=53.3%
混合气体中甲烷的质量分数为2×16/(2×16+1×28)×100%=53.3%
练习:一种气态烷烃和一种气态烯烃,它们分子里的碳原子数相同。将1.0体积这种混合气体在氧气中充分燃烧,生成2.0体积的二氧化碳和2.4体积的水蒸气(气体体积均在相同状况下测定)。则混合气中烷烃和烯烃的体积比为:
解析:由题意可知该混合烃的平均分子式可表示为C2H4.8,则烷烃是乙烷,烯烃是乙烯,由平均氢原子数,利用十字交叉法可以快捷的求出二者的体积比:

 C2H6 6 0.8
C2H6 6 0.8
4.8

C2H4 4 1.2
4.平均值法:此法是从求混合气体平均相对分子质量的公式推广而来的。它巧用了平均含义,即M1≠M2且均大于0时,存在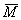 =
=
 ,只要求出平均值,就可判断出M1和M2的取值范围,该法省去复杂的数学计算过程,从而迅速解出答案。
,只要求出平均值,就可判断出M1和M2的取值范围,该法省去复杂的数学计算过程,从而迅速解出答案。
例题:一种气态烷烃和一种气态烯烃组成的混合物共10g,混合气体的密度是相同状况下氢气的12.5倍,该混合气体通过溴水时。溴水的质量增加8.4g,则该混合气体是由什么组成的?
解析:混合气体的平均相对分子质量是2×12.5=25。根据平均值法确定该烷烃是甲烷。平均相对分子质量等于25的烃有两种情况:两种气态烃的相对分子质量都是25,经分析没有这种气态烃,两气态烃中有一种烃的相对分子质量小于25,另一种的烃大于25,而相对分子质量小于25的烃只有甲烷,所以两种烃中其中一种必定是甲烷。再根据平均相对分子质量求另一种烃。设烯烃为:CnH2n
m烯烃=8.4g,m(CH4)=10g—8.4g=1.6g。
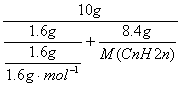 =25g/mol 解的n=2,即该烯烃是C2H4
=25g/mol 解的n=2,即该烯烃是C2H4
练习:某温度和压强下,将4g由三种炔烃(分子中只含有一个碳碳三键)组成的混合气体与足量的氢气反应,充分加成后,生成4.4g三种对应的烷烃,则所得烷烃中一定有:……………………………………………( )
A.异丁烷 B.乙烷 C.丙烷 D.丁烷
解析:炔烃转化成烷烃时,炔烃与氢气的物质的量之比为1:2,依据题意可知参加反应的氢气的物质的量为0.2mol ,则炔烃的物质的量为0.1mol,炔烃的平均相对分子质量为4/0.1=40。由平均值法,可知三种炔烃中必有相对分子质量小于40的炔烃,而相对分子质量小于40的炔烃只有乙炔,由此可知加成后所得烷烃中必含乙烷。
5.讨论法:此法一般适用于与其他计算方法一起使用,这种解法的关键是进行全面的分析和判断:
例题:1升乙炔和气态烯烃混合物与11升氧气混合后点燃,充分反应后,气体的体积为12升,求原1升混合气体中各成分及物质的量比(反应前后均为182℃、1.01×105Pa)
解析:设该混合烃的平均分子组成为CxHy
CxHy + (x+y/4)O2 点燃 xCO2 + y/2H2O △V
1 x+y/4 x y/2 y/4-1
由△V=0得y/4-1=0,则y=4
C2H2分子中氢原子个数为2,而混合烃的平均组成中氢原子个数为4,所以,烯烃中氢原子个数必大于4,又因为是气态烯烃,碳原子个数必小于或等于4,所以烯烃只能是C3H6或C4H8
若是C3H6 C2H2 2 2
 4 =1/1
4 =1/1

 C3H6 6 2
C3H6 6 2
若是C4H8 C2H2 2 2

 4 =2/1
4 =2/1

 C4H8 8 2
C4H8 8 2
6. 待定系数法:根据题意直接写出方程式,并在反应物及生成物前待以系数(化学计量数),最后找出系数间的关系。
待定系数法:根据题意直接写出方程式,并在反应物及生成物前待以系数(化学计量数),最后找出系数间的关系。
例题:丁烷催化裂化时,碳链按两种方式断裂生成两种烷烃和烯烃,若丁烷裂化率为90%,且裂化生成的两种烯烃的质量相等,求裂化后得到的相对分子质量最小的气体在混合气体中所占的体积分数。
解析:丁烷催化裂化有如下方程式:
C4H10→ CH4 + C3H6 ①
C4H10→ C2H6 + C2H4 ②
将①②合并,系数待配:aC4H10→ bCH4 + bC3H6 + cC2H6 + cC2H4
因为m(C3H6)= m(C2H4),所以b:c=2:3
令b=2,则c=3,a=5,方程式为:
5C4H10→ 2CH4 +2C3H6 +3C2H6 + 3C2H4
所以甲烷所占的体积分数为: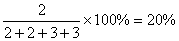
有关烃燃烧的规律 巧解含烃的混合气体计算题
一、甲烷、乙烯、乙炔的燃烧对比:
1.燃烧时的火焰亮度、烟量对比
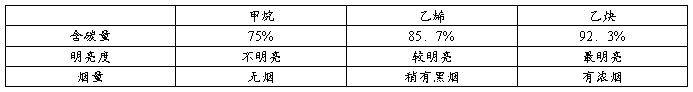
由烷、烯、炔的通式,知其W(C)依次增大,故燃烧时分别产生无黑烟、有黑烟、浓烟等现象,W(C)越大黑烟越多。此性质也可用于典型物质的鉴别。
2.等物质的量的三者完全燃烧时放出热量最多的是乙烯,但火焰温度最高的却是乙炔,氧炔焰的温度可高达3000℃以上。
二、烷烯炔各类烃含碳(或氢)质量分数的变化规律:
1.烷烃:CnH2n+2(n≥1)
W(C)=12n/(14n+2)×100% 随n的增大,烷烃W(C)逐渐增大,但永远小于85.7%。甲烷是烷烃中W(H)最高的。
2.烯烃(或环烷烃):CnH2n(n≥2)
W(C)=12n/14n×100%=85.7%即烯烃的W(C)是固定不变的。
4. 炔烃(或二烯烃):CnH2n-2(n≥2)
W(C)=12n/(14n-2)×100% 随n的增大,炔烃W(C)逐渐减小,但总比烯烃的W(C)高,即总大于85.7%。乙炔是炔烃中含碳量最高的。
三、烃的燃烧规律:
烃的可燃性是烃的一个基本性质,有关烃的燃烧计算和比较是中学化学中常见的习题,掌握烃的燃烧规律,对解决这类习题会起到事半功倍的效果。烃类燃烧可用通式表示:CxHy + (x+y/4)O2 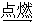 xCO2 + y/2H2O
xCO2 + y/2H2O
2. 等物质的量的不同烃燃烧时的耗氧规律:
(1)耗O2量取决于(x+y/4),(x+y/4)越大,消耗氧气越多。
(2)产生CO2的量取决于x,x越大,产生CO2的量越多。
(3)产生H2O的量取决于y,y越大,产生H2O的量越多。
例1:等物质的量的CH4 、C2H4 、C2H2,分别在足量氧气中完全燃烧,以下说法正确的是…………………………………………………………( )
A.C2H2含碳量最高,燃烧生成的CO2最多
B.C2H2燃烧时火焰最明亮
C.CH4含氢量最高,燃烧生成的水最多
D.CH4 、C2H4燃烧生成的水质量不同,消耗的氧气不同。
2.等质量的不同烃完全燃烧时的耗氧规律:
1molC(12g)消耗1mol O2,而4molH(4g)也消耗1molO2,故质量相等的不同烃完全燃烧时,氢元素的质量分数H%越大,消耗O2越多,产生的H2O越多;反之碳元素的质量分数C%越大,消耗O2越少,产生的CO2则越多。或者说等质量的烃完全燃烧时,消耗氧气的量取决于CxH中y/x的值,此值越大,耗氧量越多。
例2:等质量的以下四种烃完全燃烧,消耗氧气的量最多的是…………( )
A.CH4 B.C2H6 C.C3H6 D.C6H6
3.最简式相同,质量相等的两种烃完全燃烧时消耗氧气相等: 最简式相同的烃有:(1)烯烃和环烷烃;(2)含n个碳原子的炔烃与含3n个碳原子的苯的同系物;(3)乙炔与苯、苯乙烯等。
例3:下列各组烃的混合物,只要总质量一定,无论它们按什么比例混合,完全燃烧后生成二氧化碳和水都为恒量的是……………………………( )
A.C2H2 C2H6 B.C2H4 C3H8
C.C2H2 C6H6 D.C3H4 C3H6
3.同温同压下烃完全燃烧前后气体体积变化规律:
(2) 若所给条件下生成的水呈气态。
由通式得△V= V后—V前= (x+y/2)—(1+ x+y/4)= y/4—1
可知:a.燃烧前后体积变化只与y有关。
b.若y=4,即氢原子个数为4,则燃烧前后气体体积不变,如CH4
C2H4和C3H4的燃烧;若y>4,则反应后气体体积增加,如C2H6和C4H8等烃的燃烧;若y<4,则反应后气体体积减少,只有C2H2的燃烧。
c.可以根据体积差建立与烃、氧气、二氧化碳与水的量的计算关系。
(2)若所给条件下生成的水呈液态。
由通式得△V= V后—V前= x-(1+x+y/4)=—(1+ y/4)<0
可知:a.无论y取何值,V后<V前,既反应后气体体积减小。
b.燃烧前后体积变化只与y有关。
c.可以根据体积差建立与烃、氧气、二氧化碳与水的量的计算关系。
例4:120℃,1体积某烃和4体积氧气混合,完全燃烧后恢复到原来的温度和压强,体积不变。该烃分子式中所含碳原子数不可能是……………( )
A.1 B.2 C.3 D.4
巧解含烃的混合气体计算题
1.守恒法:此法在化学计算中应用很广泛,用此法可求元素的相对原子质量、物质的相对分子质量、分子式、混合物的组成以及进行溶解度、溶液浓度等方面的计算。
例题:把mmol C2H4和nmol H2混合于密闭容器中,在适当的条件下,反应达到平衡时生成pmol C2H6,若将所得平衡混合气体完全燃烧生成二氧化碳和水,则需要氧气多少摩尔?
练习:一定量的甲烷CH4燃烧后得到的产物是一氧化碳、二氧化碳和水蒸气,此混合气的质量为49.6g,当其缓缓通过足量的无水氯化钙时气体质量减少25.2g,则混合气体中一氧化碳的质量是多少克?
2.方程式叠加法:
例题:将x mol氧气,y mol甲烷和z mol过氧化钠放入密闭容器中,在150℃条件下用点火花引发,恰好完全反应后,容器内压强为0,通过计算确立x、y和z之间的关系式:
练习:若要使0.5mol CH4完全和氯气发生取代反应,并生成相同物质的量的四种取代物,则需要氯气的物质的量为多少摩尔?
3.十字交叉法:十字交叉法一般只适用于两种已知成分组成的混合体系,解题关键往往在于求平均值。其广泛应用于有关同位素、相对原子质量、溶质质量、二组分混合物质量分数、化学反应中的物质的量、体积、电子转移数及反应热等方面的计算。
例题:CH4和C2H4混合气体,其密度是同温同压下乙烷的2/3,求混合气体中甲烷的质量分数。
练习:一种气态烷烃和一种气态烯烃,它们分子里的碳原子数相同。将1.0体积这种混合气体在氧气中充分燃烧,生成2.0体积的二氧化碳和2.4体积的水蒸气(气体体积均在相同状况下测定)。则混合气中烷烃和烯烃的体积比为:
4.平均值法:此法是从求混合气体平均相对分子质量的公式推广而来的。它巧用了平均含义,即M1≠M2且均大于0时,存在 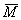 =
=  ,只要求出平均值,就可判断出M1和M2的取值范围,该法省去复杂的数学计算过程,从而迅速解出答案。
,只要求出平均值,就可判断出M1和M2的取值范围,该法省去复杂的数学计算过程,从而迅速解出答案。
例题:一种气态烷烃和一种气态烯烃组成的混合物共10g,混合气体的密度是相同状况下氢气的12.5倍,该混合气体通过溴水时。溴水的质量增加8.4g,则该混合气体是由什么组成的?
练习:某温度和压强下,将4g由三种炔烃(分子中只含有一个碳碳三键)组成的混合气体与足量的氢气反应,充分加成后,生成4.4g三种对应的烷烃,则所得烷烃中一定有:……………………………………………( )
A.异丁烷 B.乙烷 C.丙烷 D.丁烷
5.讨论法:此法一般适用于与其他计算方法一起使用,这种解法的关键是进行全面的分析和判断:
例题:1升乙炔和气态烯烃混合物与11升氧气混合后点燃,充分反应后,气体的体积为12升,求原1升混合气体中各成分及物质的量比(反应前后均为182℃、1.01×105Pa)
6. 待定系数法:根据题意直接写出方程式,并在反应物及生成物前待以系数(化学计量数),最后找出系数间的关系。
待定系数法:根据题意直接写出方程式,并在反应物及生成物前待以系数(化学计量数),最后找出系数间的关系。
例题:丁烷催化裂化时,碳链按两种方式断裂生成两种烷烃和烯烃,若丁烷裂化率为90%,且裂化生成的两种烯烃的质量相等,求裂化后得到的相对分子质量最小的气体在混合气体中所占的体积分数。
