有机物燃烧规律总结
燃烧通式为:CxHy + (x+
y4
) O2 = x CO2 +
y4
y2
H2O
y2
CxHyOz + (x+-
z2
) O2 = x CO2 + H2O
一、气态烃燃烧体积的变化
若水为液体,燃烧后体积缩小,减小值只与烃中氢原子数目有关 CxHy + (x+ y/4) O2 → x CO2+ y/2 H2O △V 1 (x+
y4
) x 0 V后-V前=-(1+
y4
)
当温度>100℃,水为气态,总体积变化也只与氢原子数目有关 CxHy + (x+
y4
) O2 → x CO2+
y4
y2
H2O △V
y2
1 (x+①当 △V>0,②当 △V=0,③当 △V<0,
y4y4y4
) x V后-V前=x+
y2
-1-(x+
y4
)=
y4
-1
>1,y>4。分子式中H大于4的气态烃都符合。 =1,y=4。CH4,C2H4,C3H4,C4H4符合。 <1,y<4。只有C2H2符合。
例1、体积为10mL的某气态烃,在50mL足量O2里完全燃烧,生成液态水和体积为35 mL气体(气体体积均在同温同压下测定),此烃的分子式是( )
A、C2H4 B、C2H2 C、C3H6 D、C3H8 解析:因为水为液体,由燃烧通式得出体积差为(1+y/4),由差量法有 1:(1+y/4)=10mL:(10mL+50mL-35mL),求得y=6,选D。
二、烃的物质的量与燃烧产物中CO2和H2O的物质的量的关系
根据烷烃通式CnH2n+2,n(烷烃)=n(H2O)-n(CO2); 根据烯烃通式CnH2n, n(H2O)=n(CO2);
根据炔烃通式CnH2n-2,n(炔烃)=n(CO2)- n(H2O)。
例2、由两种烃组成的混合物,已知其中之一为烯烃。燃烧1mol该混合物,测得产生CO2 4.0mol
及 H2O 4.4mol,试求混合烃的组成情况?
解析:由于烯烃:n(H2O)=n(CO2),所以得出n(H2O)-n(CO2)=4.4mol-0.4mol=n(烷烃)、n(烯烃)= 1mol- n(烷烃)= 0.6mol,设烷烃为CmH2m+2、烯烃为CnH2n,得出0.4m+0.6n=4 mol,在m、n的取值范围内讨论有3组符合题意,即:m=1和n=6;m=4和n=4;m=2和n=7。
三、等质量的不同烃完全燃烧消耗O2及生成CO2和H2O的情况
C/H个数比越大,生成CO2越多; H/C值越大,生成水越多,消耗O2也越多(12gC耗32gO2,等质量的12gH2耗3×32gO2);实验式相同的不同烃,上述三者对应都相等。
例3、完全燃烧某混合气体,所产生的CO2的质量一定大于燃烧相同质量丙烯所产生CO2的质量,该混合气体是( )
A、乙炔、乙烯 B、乙炔、丙烷 C、乙烷、环丙烷 D、丙烷、丁烯 解析:烯烃和环烷烃C/H=1/2;烷烃C/H<1/2;炔烃C/H>1/2,所以炔烃与炔烃或炔烃与烯烃的组合,C的质量分数大于烯烃,选A。
四、总质量一定的两种有机物以任意比混合,完全燃烧消耗O2及生成CO2和H2O为定值
CO2或H2O为定值,?(C)?
m(C)m(总)
为定值
,?(H)?
m(H)m(总)
为定值
,两种有机物满足C或H的
质量分数相等,包括实验式相同的情况;消耗O2不变,满足实验式相同。
例4、某种含三个碳原子以上的饱和一元醛A和某种一元醇B,无论以何种比例混合,只要总质量一定,完全燃烧生成CO2和H2O的质量不变。 (1)醇B应符合的组成通式? (2)醇B的分子结构满足的条件?
解析:饱和一元醛的通式为CnH2nO,与醇混合燃烧符合题干条件,二者实验式应相同,由此推出二者通式也相同;与饱和一元醇的通式相比,此醇分子中应含有一个碳碳双键或一个碳环。
五、等物质的量的不同有机物完全燃烧,消耗O2及生成CO2和H2O相等
CO2或H2O相等,分子式中碳原子或氢原子个数相等;消耗O2相等,燃烧通式中O2系数相等,或将分子式变形,提出 (CO2)m ( H2O)n后剩余部分相等。
例5、燃烧等物质的量的有机物A和乙醇用去等量的O2,此时乙醇反应后生成的水量是A的1.5倍,A反应后生成的CO2 是乙醇的1.5倍,A是 ( )
A、CH3CHO B、C2H5COOH C、CH2=CHCOOH D、CH3-CH(CH3)-OH
解析:由乙醇分子中C、H的个数,可确定A的分子式为C3H4Ox,再由消耗O2相等,可确定A中氧原子为2,选C。
六、总物质的量一定的不同有机物以任意比混合
1、消耗O2和生成水为定值:两分子式满足H相等,相差n个C,同时相差2n个O。 2、消耗O2和生成CO2为定值:两分子式满足C相等,相差n个O,同时相差2n个H。 例6、有机物A、B分子式不同,它们只可能含C、H、O中的两种或三种。如果将A、B不论以何种比例混合,只要物质的量之和不变,完全燃烧时,消耗的O2和生成的水的物质的量也不变。
(1)A、B组成必须满足的条件?
(2)若A是CH4,则符合上述条件的化合物B中相对分子质量最小的是?并写出含有-CH3的B的两种同分异构体?
解析:B比CH4多一个C,两个O,分子式为C2H4O2,结构为:CH3COOH和HCOOCH3。
七、根据有机物完全燃烧消耗O2与CO2的物质的量之比,推导有机物可能的通式
将CaHbOc提出若干个水后,有三种情况: V(O2)/V(CO2) =1,通式为Ca(H2O)n; V(O2)/V(CO2) >1,通式为(CaHx)m(H2O)n; V(O2)/V(CO2) <1,通式为(CaOx)m(H2O)n
例7、现有一类只含C、H、O的有机物,燃烧时所消耗O2和生成的CO2的体积比为5∶4(相同状况),按照上述要求,该化合物的通式可表示为?(最简化的通式) 并写出这类化合物相对分子质量最小的物质的结构简式?
解析:因为V(O2)/V(CO2) =5∶4>1,所以通式为(CaHx)m (H2O)n的形式,再由C和H消耗O2的关系可得出:通式为(CH)m(H2O)n;CH3CHO(由于H数为偶数,m=2,n=1)。
八、根据有机物完全燃烧生成水与CO2的量或比例,推导分子式或通式
根据CO2与H2O的物质的量多少或比值,可以知道C、H原子个数比,结合有无其他原子,可以写出有机物的分子式或通式。
例8、某有机物在O2中充分燃烧,生成物n(H2O) ∶n(CO2) =1∶1,由此可以得出的结论是( )
A、该有机物分子中C∶H∶O原子个数比为1∶2∶1 B、分子中C∶H原子个数比为1∶2 C、有机物必定含O D、无法判断有机物是否含O 解析:由H2O和CO2的物质的量比可以确定通式为:CnH2nOx,无法确定氧,选B、D。
九、有机物燃烧产物与Na2O2反应的规律
分子式能改写为(CO)m(H2)n形式的物质,完全燃烧后的产物与过量Na2O2反应,固体增加的质量与原物质的质量相等。
例9、某温度下mg仅含三种元素的有机物在足量O2 充分燃烧。其燃烧产物立即与过量Na2O2反应,固体质量增加了mg。
(1)下列物质中不能满足上述结果的是 ( )
A、C2H6O2 B、C6H12O6 C、C12H22O11 D、(C6H10O5)n (2)A是符合上述条件且相对分子质量最小的有机物,则A的结构简式为?
解析:(1)C D (2)HCHO
十、不完全燃烧问题
有机物不完全燃烧产物中会有CO生成,而CO不能被碱石灰等干燥剂吸收。
例10、1L丙烷与XLO2混合点燃,丙烷完全反应后,生成混合气体为aL(在120℃,1.01×105Pa时测定)。将aL混合气体通过足量碱石灰后,测得剩余气体体积为bL。若a-b=6,则X的值为( )
A、4 B、4.5 C、5.5 D、6
解析: 假设1L丙烷完全燃烧,应产生3 L CO2和4 L水蒸气,通过足量碱石灰后全被吸收,因此 a-b=7,由此a-b=6断定为不完全燃烧,再经原子守恒可确定X=4.5(先考虑H恒,水蒸气一定为4L,V(CO2)=6L-4L=2L,由C守恒:V(CO)=(3-2)L,由氧守恒:X=
42
+2+
12
)。
强 化 练 习
1.120℃时,1体积某链烃和4体积O2混合,完全燃烧后恢复到原温度和压强,体积不变,该烃分子式中所含碳原子数不可能的是( )
A.1 B.2 C.3 D.4
2.下列各组有机物不管它们以任何物质的量比混合,只要混合物的物质的量一定,在完全燃烧是,耗氧量恒定不变的是:( )
A.C3H4和C2H6 B.C3H6和C3H8 C.C5H10和C6H6 D.C3H8和C4H6 3.有机物A、B只可能是烃或烃的含氧衍生物,等物质的量的A和B完全燃烧时,消耗氧气的量相等,则A和B的分子量相差不可能为(n为正整数):( )
A.8n B.14n C.18n D.44n
4.两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L.下列各组混合烃中不符合此条件的是( )
A. CH4 C2H4 B. CH4 C3H6 C. C2H4 C3H4 D. C2H2 C3H6
5.有机物A、B的分子式不同,它们只可能含C、H、O元素中的2种或3种,若将A、B不论以何种比例混合,只要其物质的量之和不变,完全燃烧时,要求达到:
(1)消耗的O2和生成的H2O的物质的量也不变,则A、B组成满足的条件是 (2)消耗的O2和生成的CO2的物质的量也不变,则A、B组成满足的条件是 6.化合物CO、HCOOH和OHC-COOH(乙醛酸)分别燃烧时,消耗的O2和生成的CO2的体积比都是1:2。后两者的分子式可以分别看成是(CO)(H2O)和(CO)2(H2O)。也就是说:只要分子式符合(CO)m(H2O)n(n和m均为正整数)的各种有机物,它们燃烧时消耗的O2和生成的CO2的体积比总是1:2。现有一些只含C、H、O三种元素的有机物,它们燃烧时消耗的O2和生成的CO2的体积比是3:4。
〈1 〈2〉某两种碳原子相同的上述有机物,若它们的相对分子质量分别为a和b(a<b), 则b-a必定是 (填入一个数字)的整数倍。
〈3〉在这些有机物中有一种化合物,它含有两个羧基。取0.2625g该化合物恰好能跟25.00mL 0.1000mol/LNaOH溶液完全中和。由此可以计算得知该化合物的相对分子质量应是并可推导出它的分子式应是 。
答案:1.D 2.C 3.B 4.BD
5.(1)氢原子数相等,每增加1个碳原子,需同时增加2个氧原子。 (2)碳原子数相等,每增加2个氢原子,需同时增加1个氧原子。 6.(1)C2H2O2 (2)18 (3)210、C6H10O8
第二篇:高二化学有机物燃烧规律总结(2)
有机物燃烧规律总结
燃烧通式为:CxHy + (x+yy) O2 = x CO2 + H2O 42
yzyCxHyOz + (x+-) O2 = x CO2 + H2O 422
一、气态烃燃烧体积的变化
若水为液体,燃烧后体积缩小,减小值只与烃中氢原子数目有关
CxHy + (x+ y/4) O2 → x CO2+ y/2 H2O △V
1 (x+yy) x 0 V后-V前=-(1+) 44
当温度>100℃,水为气态,总体积变化也只与氢原子数目有关 yy) O2 → x CO2+ H2O △V 24
yyyyy 1 (x+) x V后-V前=x+-1-(x+)=-1 22444
y①当 △V>0,>1,y>4。分子式中H大于4的气态烃都符合。 4
y②当 △V=0,=1,y=4。CH4,C2H4,C3H4,C4H4符合。 4
y③当 △V<0,<1,y<4。只有C2H2符合。 4CxHy + (x+
例1、体积为10mL的某气态烃,在50mL足量O2里完全燃烧,生成液态水和体积为35 mL气体(气体体积均在同温同压下测定),此烃的分子式是( )
A、C2H4 B、C2H2 C、C3H6 D、C3H8
解析:因为水为液体,由燃烧通式得出体积差为(1+y/4),由差量法有
1:(1+y/4)=10mL:(10mL+50mL-35mL),求得y=6,选D。
二、烃的物质的量与燃烧产物中CO2和H2O的物质的量的关系
根据烷烃通式CnH2n+2,n(烷烃)=n(H2O)-n(CO2);
根据烯烃通式CnH2n, n(H2O)=n(CO2);
根据炔烃通式CnH2n-2,n(炔烃)=n(CO2)- n(H2O)。
例2、由两种烃组成的混合物,已知其中之一为烯烃。燃烧1mol该混合物,测得产生CO2 4.0mol
及 H2O 4.4mol,试求混合烃的组成情况?
解析:由于烯烃:n(H2O)=n(CO2),所以得出n(H2O)-n(CO2)=4.4mol-0.4mol=n(烷烃)、n(烯烃)= 1mol- n(烷烃)= 0.6mol,设烷烃为CmH2m+2、烯烃为CnH2n,得出0.4m+0.6n=4 mol,在m、n的取值范围内讨论有3组符合题意,即:m=1和n=6;m=4和n=4;m=2和n=7。
三、等质量的不同烃完全燃烧消耗O2及生成CO2和H2O的情况
C/H个数比越大,生成CO2越多; H/C值越大,生成水越多,消耗O2也越多(12gC耗32gO2,等质量的12gH2耗3×32gO2);实验式相同的不同烃,上述三者对应都相等。
例3、完全燃烧某混合气体,所产生的CO2的质量一定大于燃烧相同质量丙烯所产生CO2的质量,该混合气体是( )
A、乙炔、乙烯 B、乙炔、丙烷 C、乙烷、环丙烷 D、丙烷、丁烯 解析:烯烃和环烷烃C/H=1/2;烷烃C/H<1/2;炔烃C/H>1/2,所以炔烃与炔烃或炔烃与烯烃的组合,C的质量分数大于烯烃,选A。
四、总质量一定的两种有机物以任意比混合,完全燃烧消耗O2及生成CO2和H2O为定值
CO2或H2O为定值,?(C)?m(C)m(H)为定值,?(H)?为定值,两种有机物满足C或H的m(总)m(总)
质量分数相等,包括实验式相同的情况;消耗O2不变,满足实验式相同。
例4、某种含三个碳原子以上的饱和一元醛A和某种一元醇B,无论以何种比例混合,只要总质量一定,完全燃烧生成CO2和H2O的质量不变。
(1)醇B应符合的组成通式?
(2)醇B的分子结构满足的条件?
解析:饱和一元醛的通式为CnH2nO,与醇混合燃烧符合题干条件,二者实验式应相同,由此推出二者通式也相同;与饱和一元醇的通式相比,此醇分子中应含有一个碳碳双键或一个碳环。
五、等物质的量的不同有机物完全燃烧,消耗O2及生成CO2和H2O相等
CO2或H2O相等,分子式中碳原子或氢原子个数相等;消耗O2相等,燃烧通式中O2系数相等,或将分子式变形,提出 (CO2)m ( H2O)n后剩余部分相等。
例5、燃烧等物质的量的有机物A和乙醇用去等量的O2,此时乙醇反应后生成的水量是A的
1.5倍,A反应后生成的CO2 是乙醇的1.5倍,A是 ( )
A、CH3CHO B、C2H5COOH C、CH2=CHCOOH D、CH3-CH(CH3)-OH
解析:由乙醇分子中C、H的个数,可确定A的分子式为C3H4Ox,再由消耗O2相等,可确定A中氧原子为2,选C。
六、总物质的量一定的不同有机物以任意比混合
1、消耗O2和生成水为定值:两分子式满足H相等,相差n个C,同时相差2n个O。
2、消耗O2和生成CO2为定值:两分子式满足C相等,相差n个O,同时相差2n个H。 例6、有机物A、B分子式不同,它们只可能含C、H、O中的两种或三种。如果将A、B不论以何种比例混合,只要物质的量之和不变,完全燃烧时,消耗的O2和生成的水的物质的量也不变。
(1)A、B组成必须满足的条件?
(2)若A是CH4,则符合上述条件的化合物B中相对分子质量最小的是?并写出含有-CH3的B的两种同分异构体?
解析:B比CH4多一个C,两个O,分子式为C2H4O2,结构为:CH3COOH和HCOOCH3。
七、根据有机物完全燃烧消耗O2与CO2的物质的量之比,推导有机物可能的通式
将CaHbOc提出若干个水后,有三种情况:
V(O2)/V(CO2) =1,通式为Ca(H2O)n;
V(O2)/V(CO2) >1,通式为(CaHx)m(H2O)n;
V(O2)/V(CO2) <1,通式为(CaOx)m(H2O)n
例7、现有一类只含C、H、O的有机物,燃烧时所消耗O2和生成的CO2的体积比为5∶4(相同状况),按照上述要求,该化合物的通式可表示为?(最简化的通式) 并写出这类化合物相对分子质量最小的物质的结构简式?
解析:因为V(O2)/V(CO2) =5∶4>1,所以通式为(CaHx)m (H2O)n的形式,再由C和H消耗O2的关系可得出:通式为(CH)m(H2O)n;CH3CHO(由于H数为偶数,m=2,n=1)。
八、根据有机物完全燃烧生成水与CO2的量或比例,推导分子式或通式
根据CO2与H2O的物质的量多少或比值,可以知道C、H原子个数比,结合有无其他原子,可以写出有机物的分子式或通式。
例8、某有机物在O2中充分燃烧,生成物n(H2O) ∶n(CO2) =1∶1,由此可以得出的结论是( )
A、该有机物分子中C∶H∶O原子个数比为1∶2∶1 B、分子中C∶H原子个数比为1∶2
C、有机物必定含O D、无法判断有机物是否含O 解析:由H2O和CO2的物质的量比可以确定通式为:CnH2nOx,无法确定氧,选B、D。
九、有机物燃烧产物与Na2O2反应的规律
分子式能改写为(CO)m(H2)n形式的物质,完全燃烧后的产物与过量Na2O2反应,固体增加的质量与原物质的质量相等。
例9、某温度下mg仅含三种元素的有机物在足量O2 充分燃烧。其燃烧产物立即与过量Na2O2反应,固体质量增加了mg。
(1)下列物质中不能满足上述结果的是 ( )
A、C2H6O2 B、C6H12O6 C、C12H22O11 D、(C6H10O5)n
(2)A是符合上述条件且相对分子质量最小的有机物,则A的结构简式为?
解析:(1)C D (2)HCHO
十、不完全燃烧问题
有机物不完全燃烧产物中会有CO生成,而CO不能被碱石灰等干燥剂吸收。
例10、1L丙烷与XLO2混合点燃,丙烷完全反应后,生成混合气体为aL(在120℃,1.01×10Pa时测定)。将aL混合气体通过足量碱石灰后,测得剩余气体体积为bL。若a-b=6,则X的值为( )
A、4 B、4.5 C、5.5 D、6
解析: 假设1L丙烷完全燃烧,应产生3 L CO2和4 L水蒸气,通过足量碱石灰后全被吸收,因此 a-b=7,由此a-b=6断定为不完全燃烧,再经原子守恒可确定X=4.5(先考虑H恒,水蒸气一定为4L,V(CO2)=6L-4L=2L,由C守恒:V(CO)=(3-2)L,由氧守恒:X=41+2+)。 225
强 化 练 习
1.120℃时,1体积某链烃和4体积O2混合,完全燃烧后恢复到原温度和压强,体积不变,该烃分子式中所含碳原子数不可能的是( )
A.1 B.2 C.3 D.4
2.下列各组有机物不管它们以任何物质的量比混合,只要混合物的物质的量一定,在完全燃烧是,耗氧量恒定不变的是:( )
A.C3H4和C2H6 B.C3H6和C3H8 C.C5H10和C6H6 D.C3H8和C4H6
3.有机物A、B只可能是烃或烃的含氧衍生物,等物质的量的A和B完全燃烧时,消耗氧气的量相等,则A和B的分子量相差不可能为(n为正整数):( )
A.8n B.14n C.18n D.44n
4.两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L.下列各组混合烃中不符合此条件的是( )
A. CH4 C2H4 B. CH4 C3H6 C. C2H4 C3H4 D. C2H2 C3H6
5.有机物A、B的分子式不同,它们只可能含C、H、O元素中的2种或3种,若将A、B不论以何种比例混合,只要其物质的量之和不变,完全燃烧时,要求达到:
(1)消耗的O2和生成的H2O的物质的量也不变,则A、B组成满足的条件是
(2)消耗的O2和生成的CO2的物质的量也不变,则A、B组成满足的条件是
6.化合物CO、HCOOH和OHC-COOH(乙醛酸)分别燃烧时,消耗的O2和生成的CO2的体积比都是1:2。后两者的分子式可以分别看成是(CO)(H2O)和(CO)2(H2O)。也就是说:只要分子式符合(CO)m(H2O)n(n和m均为正整数)的各种有机物,它们燃烧时消耗的O2和生成的CO2的体积比总是1:2。现有一些只含C、H、O三种元素的有机物,它们燃烧时消耗的O2和生成的CO2的体积比是3:4。
〈1〉这些有机物中,相对分子质量最小的化合物的分子式是 〈2〉某两种碳原子相同的上述有机物,若它们的相对分子质量分别为a和b(a<b), 则b-a必定是 (填入一个数字)的整数倍。
〈3〉在这些有机物中有一种化合物,它含有两个羧基。取0.2625g该化合物恰好能跟25.00mL 0.1000mol/LNaOH溶液完全中和。由此可以计算得知该化合物的相对分子质量应是并可推导出它的分子式应是 。
答案:1.D 2.C 3.B 4.BD
5.(1)氢原子数相等,每增加1个碳原子,需同时增加2个氧原子。
(2)碳原子数相等,每增加2个氢原子,需同时增加1个氧原子。
6.(1)C2H2O2 (2)18 (3)210、C6H10O8
第三篇:高中化学有机物总结
高中有机化学总结
1.能与Na反应的有机物: 醇、酚、羧酸等——凡含羟基的化合物。
2、能与NaOH溶液发生反应的有机物:1.羧酸,如:CH3COOH+NaOH--->CH3COONa+H2O(中和反应)
说明:氨基酸也有类似反应
2.酯,如:CH3COOC2H5+NaOH--->CH3COONa+C2H5OH(水解反应)
说明:油脂也有类似反应
3.酚,如:C6H5OH+NAOH--->C6H5ONa+H2O(类似于酸碱中和反应)
说明:上面方程中的C6H5表示苯基
4.卤代烃,如:
CH3Cl+NaOH--->CH3OH+NaCl(碱性水解,反应条件:与NaOH水溶液共热)
CH3CH2Cl+NaOH--->CH2=CH2+NaCl+H2O(消去反应,反应条件:与NaOH醇溶液共热)
说明:另外,某些醛也可以跟NaOH发生歧化反应,但中学不学习。
3.能与Na2CO3溶液发生反应的有机物:酚、羧酸
能与NaHCO3溶液发生反应的有机物:羧酸
4.能发生银镜反应的物质有: 醛、甲酸、甲酸盐、甲酸酯——凡含醛基的物质。
5.能使高锰酸钾酸性溶液褪色的物质有:
(1)含有碳碳双键、碳碳叁键的有机物
(2)含有羟基的化合物如醇和酚类物质
(3)含有醛基的化合物
(4)具有还原性的无机物(如SO2、FeSO4、KI、HCl、H2O2等)
6.能使溴水褪色的物质有:
(1)含有碳碳双键和碳碳叁键的烃和烃的衍生物(加成)
(2)苯酚等酚类物质(取代)
(3)含醛基物质(氧化)
(4)有机溶剂(如苯和苯的同系物、四氯甲烷、汽油、已烷等,属于萃取,使水层褪色而有机层呈橙红色。)
7、能与液溴反应的物质:
烷烃与纯卤素在光照条件下取代反应
苯及其同系物在FeBr3催化条件下取代反应
8、能与氢气反应:含碳碳双键,碳碳三键,苯环,醛基,羰基的有机物与氢气加成
9、能与新制氢氧化铜反应:
与醛、甲酸、甲酸盐、甲酸酯——凡含醛基的物质发生氧化反应,生成砖红色沉淀
与含—COOH的物质发生酸碱中和,沉淀溶解
10.浓硫酸、加热条件下发生的反应有:
苯及苯的同系物的硝化、磺化、醇的脱水反应、酯化反应
稀硫酸、加热条件下发生的反应有:酯的酸性水解
13.能被氧化的物质有:
含有碳碳双键或碳碳叁键的不饱和化合物(KMnO4)、苯的同系物、醇、醛、酚。
大多数有机物都可以燃烧,燃烧都是被氧气氧化。
物理通性总结:
1.密度比水大的液体有机物有:溴乙烷、溴苯、硝基苯、四氯化碳等。
2、密度比水小的液体有机物有:烃、大多数酯、一氯烷烃。
3.不溶于水的有机物有: 烃、卤代烃、酯、高级脂肪酸
4.常温下为气体的有机物有:
分子中含有碳原子数小于或等于4的烃(含新戊烷)、一氯甲烷、甲醛。
二、有机化学反应类型
1、取代反应
⑴烃(主要是烷烃和芳香烃)的卤代反应;⑵芳香烃的硝化反应;⑶醇与氢卤酸的反应、醇的分子间脱水的反应;⑷酯类的水解反应;⑸羧酸与醇的纸花反应。
2、加成反应
⑴烯烃、炔烃与氢气,卤素,卤化氢,水的加成反应
⑵芳香族化合物、醛、酮等物质都能与氢气发生加成反应(也叫加氢反应、氢化或还原反应)
4、氧化和还原反应
(1)氧化反应:有机物分子中加氧或去氢的反应均为氧化反应。
①有机物使酸性高锰酸钾溶液褪色的反应。
②醇的催化氧化(脱氢)反应
醛的氧化反应:醛的银镜反应、与新制氢氧化铜,醛的催化氧化,醛被溴水氧化
(2)还原反应:有机物分子中去氧或加氢的反应均为还原反应。
高中化学有机物除杂问题
溴苯中混有苯
共同点:都不溶于水。不同点:溴苯密度大于水,苯的密度小于水
除杂方法:加入水,充分混合后,用分液漏斗将水层以下的溴苯分离处即可。
1.乙烷中混有乙烯.
共同点:气体,密度大于空气,都不溶于水,都可燃
不同点:烷烃:不能使高锰酸钾褪色,不能与溴水反应,烯烃:能使 高锰酸钾褪色,能与溴水反应
除杂方法:用溴水洗气即可除去乙烯
2.乙烷中混有硫化氢.
共同点:气体,密度大于空气,乙烯稍微溶于水,硫化氢以1:2.6溶于水
不同点:乙烷是烷烃,烷烃具有较稳定的结构,化学性质较稳定,不予强酸强碱反应,也不与强氧化剂反应。硫化氢是弱酸性气体,弱酸可与碱反应。同时,硫化氢中的硫显最低价,具有还原性,可与氧化剂反应。
除杂方法:1.用碱洗气;2.用强氧化剂洗气
3.乙烷中混入二氧化硫
方法和原理和第2题是一样的。(二氧化硫以1:40溶于水)
4.氯化亚铁中混有硫酸根离子离子
已知钡离子与硫酸根离子反应生成沉淀
除杂方法:加少量氯化钡(不引入新的杂质)
苯(溴) ...加入NaOH水溶液,然后蒸馏
甲烷(乙烯) Br2/H2O 或酸性高锰酸钾溶液,洗气
 使用溴水法(甲烷与乙烯的鉴别)
使用溴水法(甲烷与乙烯的鉴别)
酸性KMnO2(H+)法(苯与其同系物的鉴别)
新制Cu(OH)2及银氨溶液法(鉴别-CHO)
显色法(鉴别酚-OH)如:碘遇淀粉显蓝色;三价铁离子与硫氰根离子反应,使溶液显红色,三价铁离子遇苯酚显紫色;等.
混合物 杂质 试剂 分离方法 主要仪器
苯(苯甲酸) NaOH溶液 分液 分液漏斗
苯(苯酚) NaOH溶液 分液 分液漏斗
乙酸乙酯(乙酸) 饱和Na2CO3溶液 分液 分液漏斗
溴苯(溴) NaOH溶液 分液 分液漏斗
硝基苯(混酸) H2O、NaOH溶液 分液 分液漏斗
苯(乙苯) 酸性KMnO4、NaOH 分液 分液漏斗
乙醇(水) CaO 蒸馏 蒸馏烧瓶、 冷凝管
乙醛(乙酸) NaOH溶液 蒸馏 蒸馏烧瓶、冷凝管
苯酚(苯甲酸) NaHCO3溶液 过滤 漏斗、烧杯
肥皂(甘油) NaCl溶液 盐析 漏斗、烧杯
淀粉(纯碱) H2O溶液 渗析 半透膜、烧杯
乙烷(乙烯) 溴水 洗气 洗气瓶
1、 乙酸和乙醇 加足量NaOH后蒸馏得蒸出物乙醇,再加足量难挥发的酸如硫酸,再蒸馏得到乙酸
2、乙酸乙酯和乙酸 加足量饱和碳酸钠,充分震荡,静置分液,倒出上层液体,得到乙酸乙酯,放出下层液体,再加足量硫酸,蒸馏得乙酸(同实验室制取乙酸乙酯)
除掉括号内的杂质:
1、乙酸(乙醇) 加足量NaOH后充分蒸馏,再加足量硫酸,再蒸馏得到乙酸
2、 二氧化硫和乙烯 分别通过品红溶液,二氧化硫可使品红退色乙烯不行。
5、乙烷(乙烯) 将混合气体通过溴水即可
6、乙醇(水) 加入CaO进行蒸馏蒸出物为乙醇(可用无水硫酸铜检验是否除尽)
鉴别下列物质
1、苯和甲苯 加酸性KMnO4溶液,褪色的为甲苯
2、乙烷和乙烯 通入酸性KMnO4或溴水,褪色的为乙烯
3、植物油和矿物油 原理:植物油是酯类,矿物油是烃 加热碱液,变澄清的为植物油
4、蚕丝和人造丝 燃烧,有烧焦羽毛气味的为蚕丝
5、淀粉和葡萄糖 加I2(碘)液,变蓝的为淀粉
6、二氧化硫和乙烯 扇闻,有刺激性气味的为SO2,或者通入品红溶液,褪色的为SO2
7、苯和四氯化碳 加Br2水震荡分层,有机层在上的为苯
8、乙酸和乙醇 加紫色石蕊试液,变红的为乙酸
9、蔗糖和麦芽糖 新制Cu(OH)2共热煮沸,生成砖红色沉淀的为麦芽糖
10、溴苯(溴) 如果杂质是溴单质,加入铁,苯,分液。-产生溴化铁不溶于溴苯且与苯反应又有部分生成溴苯的呀为反应的不溶于溴苯用分液
乙酸乙酯的制取:
先加乙醇,再加浓硫酸,最后加乙酸。 顺序是密度先小后大,然后加热
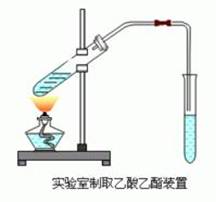 2:制备乙酸乙酯时反应温度不宜过高。液体加热至沸腾后,应改用小火加热。事先可在试管中加入几片碎瓷片,以防止液体暴沸。
2:制备乙酸乙酯时反应温度不宜过高。液体加热至沸腾后,应改用小火加热。事先可在试管中加入几片碎瓷片,以防止液体暴沸。
3导气管不要伸到Na2CO3溶液中去,防止由于加热不均匀,造成Na2CO3溶液倒吸入加热反应物的试管中。
3.1:浓硫酸既作催化剂,又做吸水剂。
3.2:Na2CO3溶液的作用是:
(1)饱和碳酸钠溶液的作用是冷凝酯蒸气,减小酯在水中的溶解度(利于分层),除出混合在乙酸乙酯中的乙酸,溶解混合在乙酸乙酯中的乙醇。
(2)Na2CO3能跟挥发出的乙酸反应,生成没有气味的乙酸钠,便于闻到乙酸乙酯的香味。
银镜反应
首先在洁净的试管里加入1mL2%的硝酸银溶液,然后一边摇动试管,一边逐滴滴入2%的稀氨水,直到最初产生的沉淀恰好溶解为止(这时得到的溶液叫银氨溶液).
再滴入3滴乙醛,振荡后把试管放在热水中温热。不久可以看到,试管内壁上附着一层光亮如镜的金属银。(在此过程中,不要晃动试管,否则只会看到黑色沉淀而无银镜。)
反应实质:这个反应里,硝酸银与氨水生成的银氨溶液中含有氢氧化二氨合银,这是一种弱氧化剂,它能把乙醛氧化成乙酸,乙酸又与生成的氨气反应生成乙酸铵,而银离子被还原成金属银。
用硝酸来清洗试管内的银镜,硝酸可以氧化银,生成硝酸银,一氧化氮和水
