第七章 应用广泛的酸碱盐
1、固体NaCl、KNO3、NaOH、Mg(NO3)2等不能导电,其水溶液能导电,所以酸碱盐溶液能导电,但有机物溶液大多不导电(如酒精、蔗糖)。
2、氯酸钾溶液中是否含有自由移动的氯离子?(没有,只含有自由移动的氯酸根离子)
3、导电的溶液中,所有阳离子带的正电荷总数等于所有阴离子带的负电荷总数,所以整个溶液不显电性。
例如某溶液中共含四种离子,其中Na+︰Mg2+︰Cl-=3︰2︰5,如Na+为3n个,求SO42-的个数。
(此类题要会)解:3n+2×2n=5n+2x,则x=
4、盐中一定含有金属离子或金属元素(×)
碱中一定含有金属元素(×)
化合物中一定含有非金属元素(√)
碱中一定含有氢氧元素(√)
酸中一定含有氢元素(√)
有机物中一定含有碳元素(√)
酸中一定不含金属元素(×)
正盐中一定不含H元素(×)
碱放入酚酞试液中一定能使酚酞变红(×)
盐溶液一定呈中性(×)
5、①使紫色的石蕊试液变红的溶液不一定是酸溶液,但一定是酸性溶液;(如CuSO4溶液是盐溶液,但溶液显酸性)
②使紫色的石蕊试液变蓝的溶液不一定是碱溶液,但一定是碱性溶液。(如Na2CO3溶液是盐溶液,但溶液显碱性)
③苹果、橘子、食醋等有酸味的食物常呈酸性;肥皂、洗洁精等洗涤剂常呈碱性(因为碱性溶液能溶解油脂)。
6、酸溶液的通性:(如:X-和Cl-具有相似的化学性质,说出HX的化学性质)
i. 与酸碱指示剂作用,紫色石蕊遇HX变红色,无色酚酞不变色。
ii. 与金属反应生成盐和氢气(条件:①在活动性顺序表中,只有排在H前面的金属才能置换出酸中的氢;②酸除了HNO3和浓H2SO4,氧化性强,与金属反应时,不生成氢气而生成水,H2CO3酸性太弱)
iii. 与金属氧化物反应生成盐和水(一定反应)
iv. 与碱反应生成盐和水(一定反应)
v. 与某些盐反应生成另一种酸和另一种盐(条件:生成物有沉淀或气体)
7、溶液的酸碱度常用pH来表示,pH=7时溶液呈中性,pH<7时呈酸性,pH>7时呈碱性。
pH=0时呈酸性,pH越小,酸性越强,pH越大,碱性越强。
①蒸馏水的pH=7(正常雨水的pH<7显弱酸性因为空气中有CO2,pH<5.6的雨水才被称为酸雨),
②SO3溶于水,溶液pH<7,CO2溶于水,溶液pH<7;CaO溶于水,溶液pH>7,Na2O溶于水,溶液pH>7,NH3溶于水,溶液pH>7, Na2CO3溶于水,溶液pH>7;NaCl溶于水,溶液pH=7。
③要使溶液pH升高可加pH更高的溶液,要使溶液pH降低可加pH更低的溶液。
pH=3和pH=4混合溶液一般3<pH<4,
④往碱性溶液中加水可使溶液pH降低,往酸性溶液中加水可使溶液pH升高,往中性溶液中加水溶液pH不变。
⑤测定pH的最简单的方法是使用pH试纸(本色常为黄色),测定时,用玻璃棒把待测溶液滴在pH试纸上,然后把试纸显示的颜色跟标准比色卡对照,便可知溶液的pH。
用pH试纸测出的pH数值是整数。
8、碱的通性 (由于碱在水溶液里都能电离而生成OH-离子,所以它们有一些相似的化学性质。)
(1) 碱溶液能跟酸碱指示剂起反应。(条件:碱必须可溶)紫色的石蕊试液遇碱变蓝色,无色酚酞试液遇碱变红色。例如Fe(OH)3中滴入紫色的石蕊试液,石蕊不变色。
(2) 碱能跟多数非金属氧化物起反应,生成盐和水。条件:碱必须可溶,例如Cu(OH)2+CO2不反应
(3) 碱能跟酸起中和反应,生成盐和水。
酸和碱作用生成盐和水的反应叫做中和反应。中和反应是放热反应。
(4) 碱能跟某些盐起反应,生成另一种盐和另一种碱,条件:反应物均可溶,生成物有沉淀。
9、盐的性质
①跟某些金属反应生成另一种金属和另一种盐,条件:①盐可溶②在活动性顺序表中排在前面的金属才能把排在后面的金属从它的盐溶液中置换出来。(K、Ca、Na太活泼,不和盐置换)
②盐与酸反应 (与前面相同)
③盐与碱反应 (与前面相同)
④盐与盐反应 条件:反应物均溶,且生成物中有沉淀。
10、氧化物
① 定义:凡与酸反应生成盐和水的氧化物叫碱性氧化物,金属氧化物大多数是碱性氧化物。
(除A l2O3、ZnO外)
凡与碱反应生成盐和水的氧化物叫酸性氧化物,非金属氧化物大多数是酸性氧化物。
(除CO、H2O外)
② 性质:与水反应(碱可溶)
碱性氧化物大多数不溶于水中,除了Na2O、K2O、BaO、CaO外,所以Na2O+H2O=2NaOH,
而CuO+H2O=不反应。
酸性氧化物大多数溶于水(除了SiO2外)SO3+H2O=H2SO4,CO2+H2O=H2CO3,SiO2+H2O=不反应。
11、物质的检验
酸溶液(H+):常用紫色石蕊试液
碱溶液(OH-):紫色石蕊试液和无色酚酞均可。
盐酸和Cl-:用AgNO3溶液和稀HNO3
硫酸和SO42-:用Ba(NO3)2溶液和稀HNO3
区别Cl-和SO42-:只能用BaCl2、Ba(NO3)2溶液不能用AgNO3溶液
 某溶液中滴入BaCl2溶液,产生不溶于稀的白色沉淀,此溶液中可能有Ag+也可能有SO42-。
某溶液中滴入BaCl2溶液,产生不溶于稀的白色沉淀,此溶液中可能有Ag+也可能有SO42-。
碳酸盐和CO32-:用稀盐酸和石灰水
铵盐(NH4+):用浓NaOH溶液(微热)和湿润的红色石蕊试纸。
12、物质的俗名或主要成分、化学式:
氢氯酸(俗名为盐酸); HCl 氯酸HClO3 ; 氢硫酸H2S;硫酸H2SO4; 硝酸HNO3 ;磷酸H3PO4 氧化钙CaO (俗名生石灰); 氢氧化钙Ca(OH)2 (熟石灰 消石灰); Ca(OH)2水溶液(俗名石灰水); 石灰石的主要成分是:CaCO3 ;氢氧化钠 NaOH(火碱、烧碱、苛性钠);氯化钠NaCl(食盐) ;粗盐中含有MgCl2、CaCl2杂质而易潮解; 尿素CO(NH2)2
工业盐中含有亚硝酸钠NaNO2 ;亚硫酸钠Na2SO3 ;碳酸钠Na2CO3(纯碱)(水溶液呈碱性,但不是碱);纯碱晶体Na2CO3·10H2O ;波尔多液CuSO4和Ca(OH)2 ;硫酸铜CuSO4(白色);硫酸铜晶体CuSO4·5H2O (蓝矾、胆矾);碳酸氢钠NaHCO3 ;硫酸氢钠NaHSO4;氨水NH3·H2O(属于碱类);过磷酸钙是混合物 。
有关物质的颜色:
Fe(OH)3红褐色沉淀 Fe2O3红(棕)色 Fe2(SO4)3、FeCl3 、Fe(NO3)3溶液(即Fe3+的溶液)黄色;
FeSO4 、FeCl2 、Fe(NO3)2、(即Fe2+)浅绿色 Fe块状是白色的,粉末状是黑色,不纯的是黑色
Cu(OH)2蓝色沉淀 CuO黑色 CuCl2、 Cu(NO3)2、 CuSO4溶液(即Cu2+的溶液)蓝色、无水CuSO4是白色 CuSO4·5H2O是蓝色 Cu(紫)红色 Cu2O红色
BaSO4、AgCl是不溶于 HNO3的白色沉淀
CaCO3 BaCO3 Ag2CO3 Mg(OH)2是溶于HNO3 的白色沉淀
KClO3白色 KCl白色 KMnO4紫黑色 MnO2黑色 Cu2(OH)2CO3绿色
13、用途、性质
⑴浓HCl、浓HNO3具有挥发性,放在空气中质量减轻,溶质质量分数变小。
⑵浓H2SO4:吸水性,放在空气中质量增重,溶质质量分数变小。使纸张变黑(碳化)是硫酸的脱水性。
⑶粗盐(因含有CaCl2、MgCl2杂质而潮解),放在空气中质量增重。
⑷NaOH固体(白色)能吸水而潮解,又能与空气中的CO2反应而变质,所以NaOH必须密封保存。放在空气中质量增加且变质。NaOH中含有的杂质是Na2CO3。
⑸碳酸钠晶体Na2CO3·10H2O,由于在常温下失去结晶水(叫风化),放在空气中质量减轻且变质。
⑹无水CuSO4:能吸水(检验水的存在),遇水变蓝色。
⑺铁、白磷放在空气中质量增加。
⑻生石灰放在空气中变质:CaO+H2O=Ca(OH)2 Ca(OH)2+CO2=CaCO3↓+H2O
⑼需密封保存:浓HCl、浓HNO3、浓H2SO4、NaOH、CaO、Ca(OH)2、铁、白磷、纯碱晶体。
⑽稀HCl、H2SO4用于除锈。
⑾ NaOH不能用于治疗胃酸(HCl)过多,应用Al(OH)3、NaHCO3、CaCO3
⑿ 熟石灰用于改良酸性土壤,农业上农药波尔多液[CuSO4和Ca(OH)2]
⒀ 粗盐中含有杂质是CaCl2、MgCl2 工业用盐中含有杂质是NaNO2(亚硝酸钠)有毒
工业酒精中含有杂质是CH3OH有毒 久置的NaOH中含有杂质是Na2CO3
久置的CaO中含有杂质是CaCO3 生理盐水一般是0.9%的NaCl溶液
医用酒精中酒精的体积分数常为70%~75% 。
⒁制取NaOH用:Ca(OH)2+ Na2CO3—
制取Ca(OH)2用:CaO+H2O—
波尔多液不能使用铁制容器是因为:CuSO4+Fe—
不发生复分解反应的是:KNO3、NaCl
14、制碱
(1)可溶性碱 ①碱性氧化物溶于水 CaO+H2O= Ca(OH)2
②碱和盐反应 Ca(OH)2+ Na2CO3=CaCO3↓+2NaOH
(2)不溶性碱 碱和盐反应 2Cu+O2△2CuO,CuO+2HCl=CuCl2+H2O,
CuCl2+2NaOH= Cu(OH)2↓+2NaCl
不溶性碱可受热分解:Cu(OH)2△CuO+ H2O
制金属铜:两种方法①还原剂还原CuO ②金属与盐反应如:CuSO4+Fe
制盐例如MgCl2:①Mg+HCl ②MgO+HCl ③Mg(OH)2+HCl ④MgCO3+HCl ⑤MgSO4+BaCl2
15、化学肥料
⑴农作物生长需要多种元素,但土壤里常缺少氮、磷、钾元素,所以常施含N、P、K元素的盐作为化学肥料。
⑵氮肥能使植物的叶肉肥厚、叶色浓绿。
常用氮肥有:铵态氮肥(如NH4Cl、NH4HCO3、NH3·H2O)、硝态氮肥(如含NO3-的盐)、有机氮肥(如尿素CO(NH2)2)
①铵态氮肥不能与碱性物质(如草木灰)混合施用,否则会降低肥效(因为反应放出氨气)。
②“雷雨发庄稼”:因为雷雨时常使土壤里产生少量的硝态氮肥。
⑶磷肥能使植物根系发达、籽粒饱满。
常用磷肥有:过磷酸钙、磷酸二氢钙Ca(H2PO4)2、
⑷钾肥能使植物茎杆粗硬、抗早病虫害、抗倒伏。
常用钾肥有:草木灰(含K2CO3)和含K+的盐
⑸复合肥料:同时含有N、P、K元素中的两种或三种的肥料。(如KNO3等)
⑹农家肥 优点:营养元素种类多,不会破坏土壤结构,缺点:营养元素含量少,见效慢。
化学肥料 优点:营养元素含量高,见效快,缺点:营养元素种类单一,有些化肥会破坏土壤结构。
第二篇:中考知识点总结:物质构成的奥秘 沪教版
亿库教育网 http://www.eku.cc
第三章 物质构成的奥秘
1、分子是保持物质化学性质的最小粒子(原子、离子也能保持物质的化学性质)。原子是化学变化中的最小粒子。
例如:保持氯气化学性质的最小粒子是D(氯分子)(A、Cl B、Cl C、2Cl D、Cl2)。保持CO2化学性质的最小粒子是CO2分子;保持水银的化学性质的最小粒子是汞原子。在电解水这一变化中的最小粒子是氢原子和氧原子。
原子中:核电荷数(带正电)=质子数=核外电子数
相对原子质量=质子数+中子数
离子中:核电荷数(带正电)=质子数=核外电子数+离子所带电荷(分正负) 原子是由原子核和核外电子构成的,原子核是由质子和中子构成的,构成原子的三种粒子是:质子(正电)、中子(不带电)、电子(带负电)。一切原子都有质子、中子和电子吗?(错!一般的氢原子无中子)。
某原子的相对原子质量=某原子的质量÷C原子质量的1/12。相对原子质量的单位是“1”,它是一个比值。相对分子质量也可用“该分子的质量÷C原子质量的1/12”求出,其单位同样是“1”。
由于原子核所带电量和核外电子的电量相等,电性相反,因此整个原子不显电性(即电中性)。
2、①由同种元素组成的纯净物叫单质(由一种元素组成的物质不一定是单质,也可能是混合物,但一定不可能是化合物。) ②由一种分子构成的物质一定是纯净物,纯净物不一定是由一种分子构成的。 ③由不同种元素组成的纯净物一定是化合物;由不同种元素组成的物质不一定是化合物,但化合物一定是由不同种元素组成的。 纯净物与混合物的区别是物质的种类不同。 单质和化合物的区别是元素的种类不同。 ④由两种元素组成的,其中一种是氧元素的化合物叫氧化物。氧化物一定是含氧化合物,但含氧化合物不一定是氧化物。 ⑤元素符号的意义:表示一种元素,表示这种元素的一个原子。
⑥化学式的意义:表示一种物质,表示这种物质的元素组成,表示这种物质的一个分子,表示这种物质的一个分子的原子构成。 -
亿库教育网 http://www.eku.cc
亿库教育网 http://www.eku.cc
如:Fe 表示铁元素、表示一个铁原子、表示铁单质。 ⑦要表示几个粒子(不论是分子、原子还是离子),在粒子符号前加系数。
化学式中的下标表示每个分子中含几个这种原子或原子团。
离子带电量标在符号右上角,元素化合价标在符号正上方。 ⑧物质是由分子、原子、离子构成的。 由原子直接构成的:金属单质、稀有气体、硅和碳。
由分子直接构成的:非金属气体单质如H2、O2、N2、Cl2等、酸和多数氧化物[非金属
与非金属(或原子团)组成]如CO2、H2O、SO3、HCl、H2SO4、一些固态非金属单质如磷、
硫等。分子又是由原子构成的。
由离子直接构成的:碱与盐(金属与非金属或原子团组成)如NaOH、CaCl2、MgS、NaF、
ZnSO4。
构成高锰酸钾的微粒是K、MnO4。
3、决定元素的种类是核电荷数(或质子数),(即一种元素和另一种元素的本质区别是质
子数不同或者核电荷数不同);元素的分类由最外层电子数决定(分为金属、非金属、
稀有气体);决定元素的化学性质的是最外层电子数。元素的化合价由最外层电子数决
定;相对原子量由质子数+中子数决定。
同种元素具有相同的核电荷数,如Fe、Fe、Fe因核电荷数相同,都称为铁元素,但最
外层电子数不同,所以他们的化学性质也不同。
核电荷数相同的粒子不一定是同种元素,如Ne、HF、H2O、NH3、CH4。
已知RO3有32个电子,则:R+8×3+2=32 ∴R的质子数为:6
4、自然界中元素的存在(均按含量由高到低排列): 地壳中 氧、硅、铝、铁、钙; 海
洋中 氧、氢;人体中 氧、碳、氢、氮; 太阳上 氢、氦。
人体必需的微量元素:铁、铜、锰、锌、钴、碘等。缺钙会骨质疏松,易得佝偻病;缺锌会智力低下,易得侏儒症;缺钴、铁易得贫血症;缺碘会得甲状腺疾病。
5、试写1—18号元素的符号和名称:
符号: 名称:
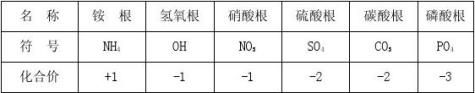
6、默写常见原子团的符号和化合价:
2-2+3++-
亿库教育网 http://www.eku.cc
亿库教育网 http://www.eku.cc
7、默写常见元素的化合价:
+1 K、Na、Ag、H ;+2 Ca、Mg、Ba、Zn、Hg ;+3 Al ;+4 Si ;+1、+2 Cu ;+2、+3 Fe ; +2、+4 C ;+4、+6 S ; -1 F、Cl ;-2 O、S ;-3 N、P 。
亿库教育网 http://www.eku.cc