专题一 化学家眼中的物质世界专题小结
整体设计
三维目标
1.知识与技能
(1)理解物质的量的概念和单位(mol),掌握物质的量、构成物质的微粒数目、物质的质量、气体的体积、溶液的物质的量浓度的相互联系,能够熟练进行简单的换算和计算;
(2)掌握物质分离提纯的实验方法和实验原理; (3)掌握用容量瓶配制一定物质的量浓度的溶液的实验技能,并能对错误的操作进行判别和误差分析。
2.过程与方法
通过理解各物理量的含义并通过适时的计算练习提高学生对物质的量与各个物理量之间相互换算和转化的能力。
3.情感态度与价值观
从理论到实验,增强学生熟练利用公式进行计算、比较的能力,提高学生实验分析的能力。 教学重点
物质的量的相关计算,配制一定物质的量浓度的溶液及物质分离提纯的实验。
教学难点
计算能力的综合应用及提高,实验方法的选择和分析。
教学过程
导入新课
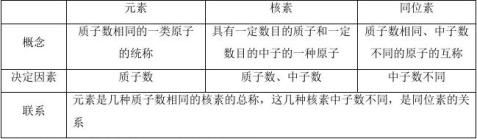
[思考] 元素、核素、同位素的概念是什么?这三个概念之间有什么联系和区别?
[展示]
推进新课
一、化学计算
[分析] 根据对核素的理解有ZX这样的表达式,Z表示原子的质子数,A表示原子的质量数,N表示原子的中子数。它表示了一种质子数为Z,中子数为A-Z,质量数为A的X原子。即:原子质子数=核电荷数=原子核外电子数=Z;质量数(A)=质子数(Z)+中子数(N)。
[提问] O、O、O、C、C、C这6种核素之间存在什么关系?
1 161718121314A
[回答] (1)O、O、O互为同位素,C、C、C互为同位素。
(2)O和C具有相同的中子数,都是8个中子。
[例1] 19xx年,世界重大科技成果之一是超铀元素的发现,它有力地支持了“稳定岛”假说,原子118X的中子数与电子数之差为( )
A.0 B.57 C.118 D.175
答案:B
[分析] 我们学习了物质的量这个物理量。物质的量是一个非常重要的物理量,在化学计算中,通过物质的量及利用阿伏加德罗常数我们可以计算得到构成物质的微粒的数目,利用摩尔质量计算物质的质量,利用气体摩尔体积计算气体物质的体积,利用溶液的体积计算溶液的浓度。
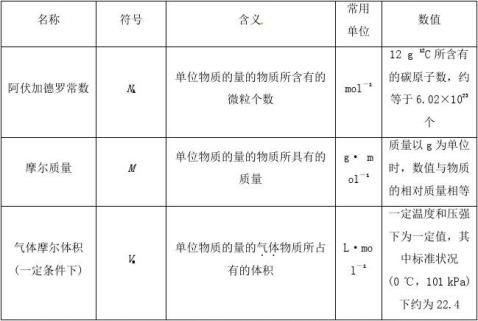
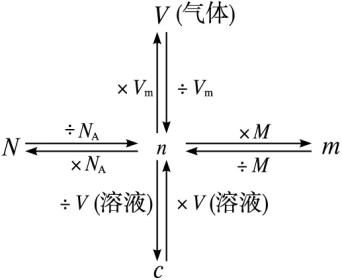
2931614161718121314
[例2] 设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.标准状况下,5.6 L氧气含有n1个O2,则NA为4n
B.常温常压下,1 mol氦气含有的原子数为2NA
C.常温下,22.4 L SO2所含的分子数为NA
D.18 g水中所含的原子数为8NA
2
解析:标准状况下5.6 L氧气的物质的量为n(O2)=
=V(O2)5.6 L1=-1==0.25 mol,NAVm22.4 L·mol4Nn1-1=4n1 mol;氦气是稀有气体,化学式为He,1个He分子只含1个原子;常温时的气体n10.25 mol
-1摩尔体积不是22.4 L·mol,故22.4 L SO2不是1 mol;18 g水的物质的量为1 mol,一个水分子(H2O)
含三个原子,故而18 g水含有原子的物质的量为3 mol,数目为3NA。
答案:A
[例3] 19 g某二价金属的氯化物ACl2中含有0.4 mol Cl,则ACl2的摩尔质量是______________,A的相对原子质量是______________。
解析:n(Cl)=0.4 mol,n(ACl2)=0.2 mol; --
m(ACl2)19 g-1M(ACl2)==95 g·mol; n(ACl2)0.2 mol
Ar(A)=M(ACl2)-2Ar(Cl)=95 g·mol-1 -2×35.5 g·mol-1 =24 g·mol-1;
A的相对原子质量为24。
答案:95 g·mol 24
[例4] 取50.0 mL Na2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51 g白色沉淀,用过量稀硝酸处理后沉淀量减小到4.66 g,并有气体放出。
试计算:(1)原混合液中Na2CO3和Na2SO4的物质的量浓度。
(2)产生的气体在标准状况下的体积。
解析:Na2SO4+BaCl2===2NaCl+BaSO4↓
Na2CO3+BaCl2===2NaCl+BaCO3↓
BaCO3+2HNO3===Ba(NO3)2+H2O+CO2↑ -1
m(BaSO4)4.66 gm(BaSO4)=4.66 g,n(BaSO4)=0.02 mol; M(BaSO4)223 g·mol-1
m(BaCO3)9.85 gm(BaCO3)=14.51 g-4.66 g=9.85 g,n(BaCO3)===0.05 mol; M(BaCO3)197 g·moln(BaSO4)0.02 mol-1c(BaSO4)==0.40 mol·L; V0.05 L
n(BaCO3)0.05 mol-1c(BaCO3)==1.00 mol·L; V0.05 L
n(CO2)=n(BaCO3)=0.05 mol;V(CO2)=n(CO2)×Vm=0.05 mol×22.4 L·mol-1=1.12 L。 答案:(1)原混合液中Na2CO3和Na2SO4的物质的量浓度分别为1.00 mol·L和0.40 mol·L;(2)产生的气体在标准状况下的体积为1.12 L。
[设问] 已知所需溶液的物质的量浓度,如需要一定体积的该溶液,如何精确配制该浓度的溶液呢?
二、化学实验
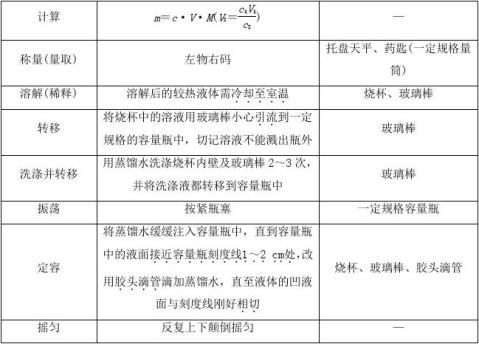
[分析] 利用容量瓶配制一定体积一定物质的量浓度的溶液的步骤和注意事项如下:

-1-13
[讨论] 根据c=对以下情况可能造成配制的溶液浓度产生误差进行分析:
①若称量固体溶质时,操作无误,但所用砝码生锈,结果__________。
②若没有洗涤烧杯内壁和玻璃棒,结果______________。
③溶解搅拌时有少量液体溅出烧杯外,结果__________。
④定容加水时有水流出容量瓶外,结果______________
⑤用滴管加水时不小心超过刻度线后,再用滴管吸出部分溶液,结果__________。
⑥若容量瓶中有少量蒸馏水或定容后反复摇匀发现液面低于刻度,则对结果______________。 ⑦俯视、仰视对结果的影响:________________。
[结论] ①称量的溶质质量偏大,溶液浓度偏大;
②溶液浓度偏小;③溶液浓度偏小;
④溶液浓度偏小;⑤溶液浓度偏小;
⑥无影响;
⑦俯视刻度线:溶液体积偏小,故浓度偏大。仰视刻度线:导致溶液体积偏大,浓度偏小。
[例5] 下面是配制500 mL 0.2 mol·L KCl溶液的操作,请按要求填空:
(1)所需KCl的质量为______________。
(2)称量过程中主要用到的仪器是__________________。
(3)将烧杯中的溶液沿__________引流到__________中,并用蒸馏水洗涤烧杯及玻璃棒2~3次,洗涤液要______________,并摇匀。
(4)加水至距刻度线______________处,改用______________加水,使液面的凹液面正好与刻度线 4
-1N
相切。
(5)在容量瓶中进行定容时,平视刻度线,所配的溶液浓度将________(偏高、偏低、无影响)。 答案:(1)7.45 g (2)托盘天平、药匙
(3)玻璃棒 烧杯 转移入500 mL容量瓶
(4)1~2 cm 胶头滴管 (5)无影响
[分析] 将溶质溶于水形成了混合物,有时我们却需要将混合物根据各自的性质分离或提纯。我们学过了5种物理分离提纯的方法,请大家一起阅读下表。
[投影展示]

5
A.食用油和酒精 B.碘和四氯化碳 C.淀粉液和泥沙 D.汽油和水 答案:D
[例7] 下图是蒸馏装置图,看图回答下列问题。
(1)写出上图序号所指的仪器名称:
①________________________,②________________________。
(2)温度计该如何放置:
_______________________________________________________。
(3)蒸馏烧瓶中装入沸石的作用:
6
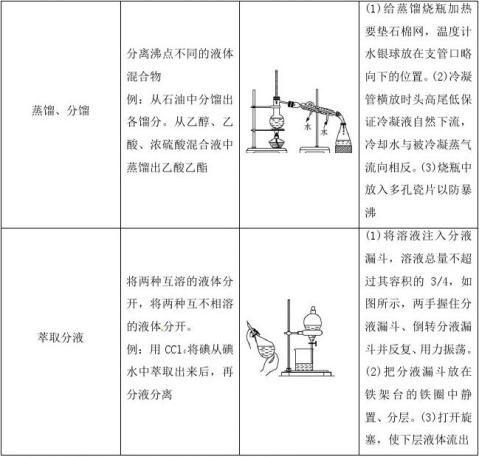
________________________________________________________。
答案:(1)①冷凝管 ②蒸馏烧瓶 (2)温度计的水银球与蒸馏烧瓶的支管口相齐
(3)防止液体暴沸。
课堂小结
本节课我们首先对物质的量的有关计算进行了复习和练习。然后在化学实验方面,我们复习了配制一定物质的量浓度的溶液的实验操作以及实验误差分析。另外再一次熟悉了物质提纯分离的原理和方法,粗盐的提纯、提纯KNO3和KCl的混合物中的KNO3是同学应该掌握的基本实例。
7
第二篇:20xx年高中化学 专题一 化学家眼中的物质世界 物质的聚集状态第1课时导学案 苏教版必修1
20xx年高中化学 专题一 化学家眼中的物质世界 物质的聚集状态第1课
时导学案 苏教版必修1
【学习目标】
1. 掌握固态物质、液态物质和气态物质的一些常见特性,学会分析影响物质体积的因素。 2. 掌握气体摩尔体积的概念及标准状况下气体的摩尔体积,熟练运用公式。 【重、难点】 有关气体摩尔体积的计算
【知识回忆】根据上节所学填空:n = = 。
预习自学案
1.固体分为 和 。晶体如 等,具有规则的几何外形,具有固定的 ;而非晶态物质如 等则没有 。
2.许许多多的分子等微观粒子聚集在一起形成的宏观物质,聚集状态主要有 、 、 三种。影响物质聚集状态的外界因素有 和 。 3.参照课本11页交流与讨论,完成表1—4
结论:①相同条件下, 1mol的固体、液体体积 。
②相同条件下, 1mol的气体体积要比固体、液体 。
③相同条件下, 1mol的不同气体体积 。
讨论:对于一定量的固体或液体而言,它们的组成微粒之间距离很 ,故它们的体积主要决定
于 ;而组成不同物质的 是不同的,因此1摩尔不同固体或液体的体积各不相同。 对于气态物质而言,其组成微粒之间的距离比微粒本身 很多,故气态物质的体积主要
决定于 ,而在同温同压下,任何气体分子之间的距离近似相等,所以,在同温同
压下,1摩尔任何气体的体积都相同。
4.固体有一定的形状,液体没有固定的形状、但有固定的体积,气体没有固定的形状和体积,为
什么?为什么气体容易被压缩?固体、液体、气体的某些性质差异与物质的微观结构有何联系?
结合课本表1-3,我们来探讨一些问题.【填空】
⑴影响物质体积大小的因素(先自己思考,再与同学讨论)
⑵影响固、液体物质体积大小的主要因素
⑶影响气体物质体积大小的主要因素
5.气体摩尔体积定义 ,用符号 表示,常用单位为 、 。6.标准状况是指温度为 压强为 。在标准状况下,气体摩尔体积约为 。
7.气体的物质的量(n)、体积(V)和气体摩尔体积(Vm)之间存在如下关系: 。课内探究案
1.运用对比的方法分析影响物质体积的因素
2.总结有关物质的量的计算的三个公式及其变式
气体分子数

气体物质的量标况下气体体积
气体质量
3.探究例3的解题过程。第二种解题方法为什么比第一种简单,还有没有更简单的第三种方法?
【目标练习】
1.下列说法中正确的是( )
A.所有物质在温度变化时都能表现出三态变化。B.逐渐加热升温,碳酸氢铵也可体现出三态变化 C.面包是固体,但在受压时体积缩小,故可以说固体易被压缩 D.在水蒸气、液态水和冰中,水分子都在不停的运动 2.下列判断中正确的是( ) A. 在标准状况下,1 mol单质溴的体积约为22.4 L(溴在常温下为液态)
B. 在标准状况下,氧气的气体摩尔体积约为22.4 L
C. 常温常压下,1 mol氢气的体积为22.4L D.常温常压下,1 mol氧气的质量为32克
3.NA表示阿伏加德罗常数,下列物质中物质的量为1摩尔的是( )
A.通常状况下22.4 L氯气 B.18 g水 C. NA 个H2分子 D.标准状况下22.4 L H2O
4. 等物质的量的氢气和氦气在同温同压下具有相等的( )
A.原子数 B.体积 C.质子数 D.质量
5.标准状况下,100mL某气体的质量为0.125g,则该气体可能是下列物质中的( ) A.氨气 B.氮气 C.二氧化碳 D.一氧化碳 6.标准状况下,下列物质体积最大的是( ) A. 2克氢气 B. 20克二氧化硫 C. 23克钠 D. 160克溴 7.在标准状况下,将1克氦气,11克二氧化碳和4克氧气混合,所得混合气的体积约为( ) A. 28L B. 11.2L C. 16.8L D. 14.0L
8.森林是大自然的清洁器,一亩森林一昼夜可吸收44千克二氧化碳气体,呼出32千克氧气,即在标准状况下吸收 L 二氧化碳,呼出 L的氧气。 9.把200 g 9.8%的稀硫酸与足量锌粒反应,求(1)能生成氢气多少克?(2)这些气体中所含分子个数为多少?(3)若欲用500mL集气瓶来收集这些氢气,则需准备几个集气瓶(设实验在标准状况下进行)?
1
