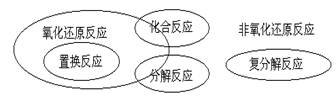
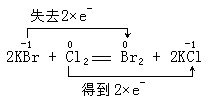(4)离子方程式正误判断(六看)
一、看反应是否符合事实:主要看反应能否进行或反应产物是否正确
二、看能否写出离子方程式:纯固体之间的反应不能写离子方程式
三、看化学用语是否正确:化学式、离子符号、沉淀、气体符号、等号等书写是否符合事实
四、看离子配比是否正确
五、看原子个数、电荷数是否守恒
六、看与量有关的反应表达式是否正确(过量、适量)
物质的量
1、 物质的量是一个物理量,符号为 n,单位为摩尔(mol)
2、 1 mol粒子的数目是0.012 kg 12C中所含的碳原子数目,约为6.02×1023个。
3、 1 mol粒子的数目又叫阿伏加德罗常数,符号为NA,单位mol-1。
4、 使用摩尔时,必须指明粒子的种类,可以是分子、原子、离子、电子等。
5.、数学表达式 :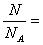 n
n
摩尔质量
1、定义:1mol任何物质的质量,称为该物质的摩尔质量。符号:M表示,常用单位为g/mol
2、数学表达式:n = m/M
3、数值:当物质的质量以g为单位时,其在数值上等于该物质的相对原子质量或相对分子质量.
物质的聚集状态
1、影响物质体积的因素:微粒的数目、微粒的大小和微粒间的距离。
固、液体影响体积因素主要为微粒的数目和微粒的大小;气体主要是微粒的数目和微粒间的距离。
2、气体摩尔体积
 单位物质的量的气体所占的体积。符号:Vm表达式:Vm= ;单位:L·mol-1
单位物质的量的气体所占的体积。符号:Vm表达式:Vm= ;单位:L·mol-1
在标准状况(0oC,101KPa)下,1 mol任何气体的体积都约是22.4 L,即标准状况下,气体摩尔体积为22.4L/mol。
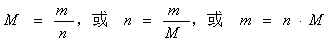
补充:①ρ标=M/22.4 → ρ1/ρ2= M1 / M2
②阿佛加德罗定律:V1/V2=n1/n2=N1/N2
…… …… 余下全文



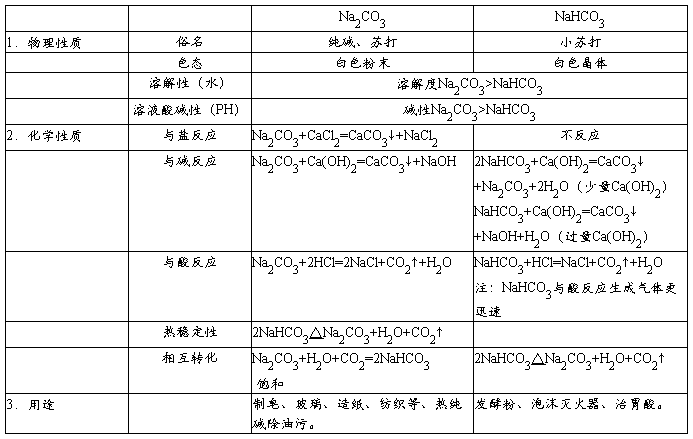


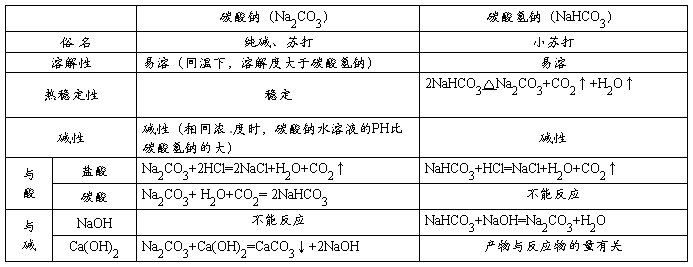

 Na2CO3+CO2↑+H2O↑
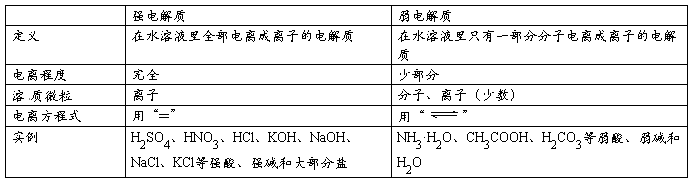
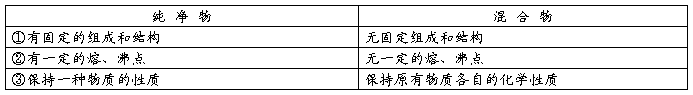
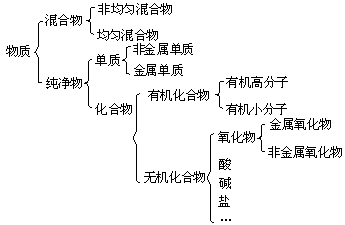
Na2CO3+CO2↑+H2O↑ 电解质
电解质