(4)离子方程式正误判断(六看)
一、看反应是否符合事实:主要看反应能否进行或反应产物是否正确
二、看能否写出离子方程式:纯固体之间的反应不能写离子方程式
三、看化学用语是否正确:化学式、离子符号、沉淀、气体符号、等号等书写是否符合事实
四、看离子配比是否正确
五、看原子个数、电荷数是否守恒
六、看与量有关的反应表达式是否正确(过量、适量)
物质的量
1、 物质的量是一个物理量,符号为 n,单位为摩尔(mol)
2、 1 mol粒子的数目是0.012 kg 12C中所含的碳原子数目,约为6.02×1023个。
3、 1 mol粒子的数目又叫阿伏加德罗常数,符号为NA,单位mol-1。
4、 使用摩尔时,必须指明粒子的种类,可以是分子、原子、离子、电子等。
5.、数学表达式 :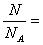 n
n
摩尔质量
1、定义:1mol任何物质的质量,称为该物质的摩尔质量。符号:M表示,常用单位为g/mol
2、数学表达式:n = m/M
3、数值:当物质的质量以g为单位时,其在数值上等于该物质的相对原子质量或相对分子质量.
物质的聚集状态
1、影响物质体积的因素:微粒的数目、微粒的大小和微粒间的距离。
固、液体影响体积因素主要为微粒的数目和微粒的大小;气体主要是微粒的数目和微粒间的距离。
2、气体摩尔体积
 单位物质的量的气体所占的体积。符号:Vm表达式:Vm= ;单位:L·mol-1
单位物质的量的气体所占的体积。符号:Vm表达式:Vm= ;单位:L·mol-1
在标准状况(0oC,101KPa)下,1 mol任何气体的体积都约是22.4 L,即标准状况下,气体摩尔体积为22.4L/mol。
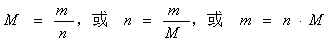
补充:①ρ标=M/22.4 → ρ1/ρ2= M1 / M2
②阿佛加德罗定律:V1/V2=n1/n2=N1/N2
物质的量在化学实验中的应用
1.物质的量浓度.
(1)定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的浓度。
(2)单位:mol/L
(3)物质的量浓度 = 溶质的物质的量/溶液的体积 CB = nB/V液
注意点:①溶液物质的量浓度与其溶液的体积没有任何关系
②溶液稀释:C(浓溶液)?V(浓溶液) =C(稀溶液)?V(稀溶液)
2.一定物质的量浓度的配制
(1)基本原理:根据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的方法,求出所需溶质的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,就得欲配制得溶液.
(2)主要操作
1、检验是否漏水.
2、配制溶液
○1计算.○2称量(或量取).○3溶解.○4转移.○5洗涤.○6定容.○7摇匀.○8贮存溶液.
所需仪器:托盘天平、烧杯、玻璃棒、胶头滴管、容量瓶
注意事项:A 选用与欲配制溶液体积相同的容量瓶. B 使用前必须检查是否漏水. C 不能在容量瓶内直接溶解. D 溶解完的溶液等冷却至室温时再转移. E 定容时,当液面离刻度线1―2cm时改用滴管,以平视法观察加水至液面最低处与刻度相切为止.
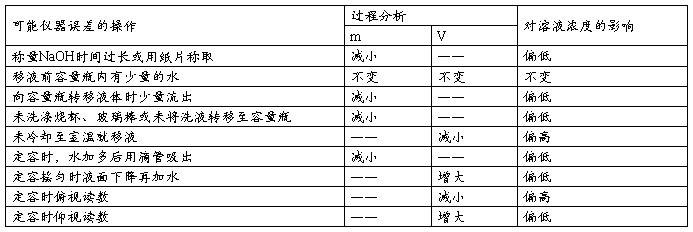
(3)误差分析:
物质的分散系
1.分散系:一种(或几种)物质的微粒分散到另一种物质里形成的混合物。
分类(根据分散质粒子直径大小):溶液(小于10-9m 〉、胶体(10-9~10-7m)
浊液(大于10-7m)
2.胶体:
(1)概念:分散质微粒直径大小在10-9~10-7m之间的分散系。
(2)性质:①丁达尔现象(用聚光手电筒照射胶体时,可以看到在胶体中出现一条光亮的“通路”,这是胶体的丁达尔现象。)
②凝聚作用(吸附水中的悬浮颗粒)
3、氢氧化铁胶体的制备
将饱和的FeCl3溶液逐滴滴入沸水中 FeCl3 + 3H2O =△= Fe(OH)3(胶体) + 3HCl
化学实验安全
1、(1)做有毒气体的实验时,应在通风厨中进行,并注意对尾气进行适当处理(吸收或点燃等)。进行易燃易爆气体的实验时应注意验纯,尾气应燃烧掉或作适当处理。
(2)烫伤宜找医生处理。
(3)浓酸撒在实验台上,先用Na2CO3 (或NaHCO3)中和,后用水冲擦干净。浓酸沾在皮肤上,宜先用干抹布拭去,再用水冲净。浓酸溅在眼中应先用稀NaHCO3溶液淋洗,然后请医生处理。
(4)浓碱撒在实验台上,先用稀醋酸中和,然后用水冲擦干净。浓碱沾在皮肤上,宜先用大量水冲洗,再涂上硼酸溶液。浓碱溅在眼中,用水洗净后再用硼酸溶液淋洗。
(5)钠、磷等失火宜用沙土扑盖。
(6)酒精及其他易燃有机物小面积失火,应迅速用湿抹布扑盖
物质的分离与提纯

常见物质的检验 略
原子的构成

 表示质量数为A、质子数为Z的具体的X原子。
表示质量数为A、质子数为Z的具体的X原子。

质量数(A)=质子数(Z)+中子数(N)
原子序数 = 核电荷数 = 质子数 = 核外电子数
要求掌握1——20号原子的结构示意图
同位素:质子数相同、质量数(中子数)不同的原子(核素)互为同位素——会判断
氯气的生产原理
(1)工业制法——氯碱工业
2NaCl + 2H2O ==== 2NaOH + H2↑ + Cl2↑
负极 正极
(2)实验室制法
反应原理:MnO2+4HCl (浓) =△= MnCl2+2H2O+Cl2↑
反应仪器:圆底烧瓶、分液漏斗
除杂:HCl气体(用饱和食盐水除)、水蒸气(用浓硫酸除)
收集方法:向上排空气法、排饱和食盐水法
尾气处理:NaOH溶液
氯气的性质
物理性质:黄绿色 刺激性气味 有毒 密度比空气大 可溶于水
化学性质:1. Cl2与金属反应(一般将金属氧化成高价态)
2. Cl2与非金属反应
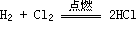 现象:发出苍白色火焰,生成大量白雾
现象:发出苍白色火焰,生成大量白雾
3. Cl2与碱的反应
Cl2+2NaOH=NaCl+NaClO+H2O 84消毒液成分为NaClO
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O CaCl2、Ca(ClO)2为漂白粉的成分,其中Ca(ClO)2为有效成分
氯水 Cl2+H2O == HCl+HClO
成分 分子:H2O、Cl2、HClO
离子:H+、Cl-、ClO-、OH-
氯水的性质
1. 酸性 2. 氧化性 3. 漂白性 4. 不稳定性
Cl-的检验:试剂:AgNO3溶液和稀硝酸 现象:产生白色沉淀(不溶于稀硝酸)
结论:溶液中有Cl
次氯酸的性质
1.酸性 2.氧化性 3.漂白性
 4.不稳定性:
4.不稳定性:
氯气的用途: 来水的消毒、农药的生产、药物的合成等
单质的物理性质
1.状态:气态(Cl2)→液态(Br2)→ 固态(I2)
2.颜色:黄绿色(Cl2)→深红棕色(Br2)→紫黑色(I2),颜色由浅到深
3.熔、沸点:液态溴易挥发,碘受热易升华
4.溶解性: Br2和I2难溶于水,易溶于汽油、酒精、苯、CCl4等有机溶剂。
溴水——橙色 在苯、CCl4为橙红色 碘水——黄色 在苯、CCl4为紫红色
I2的检验:试剂:淀粉溶液 现象:溶液变蓝色
溴和碘的化学性质 元素非金属性(氧化性)强弱顺序:Cl 2> Br 2> I2
2KBr+Cl2=2KCl+Br2 2KI +Cl2=2KCl+I2 2KI+Br2=2KBr+I2
Br- 、I- 的检验:
试剂:AgNO3溶液和稀硝酸
Ag+ + Br- = AgBr↓ 淡黄色 ——照相术
Ag+ + I- = AgI↓ 黄色——人工降雨
苯、CCl4等有机溶剂、氯水
溴、碘的提取:(请参照课本)
钠的性质
物理性质:银白色固体、有金属光泽、密度比煤油大比水小、质软、熔点低、能导电导热。保存于煤油中
化学性质 1、与O2、Cl2、S等非金属的反应
 4Na + O2 === 2Na2O (白色)
4Na + O2 === 2Na2O (白色)
 2Na + O2 === Na2O2 (淡黄色固体)
2Na + O2 === Na2O2 (淡黄色固体)
 2Na + Cl2 === 2NaCl (产生白烟)
2Na + Cl2 === 2NaCl (产生白烟)
2Na + S === Na2S (火星四射,甚至发生爆炸)
2、与水的反应
2Na + 2H2O === 2NaOH + H2↑ ( 浮、熔、游、响、红 )
实质:钠与溶液中的H+反应
与酸反应
2Na + 2H+ = 2Na+ + H2↑
与盐反应
先与水反应,生成的NaOH再与盐反应

制备:2NaCl(熔融) === 2Na + Cl2↑
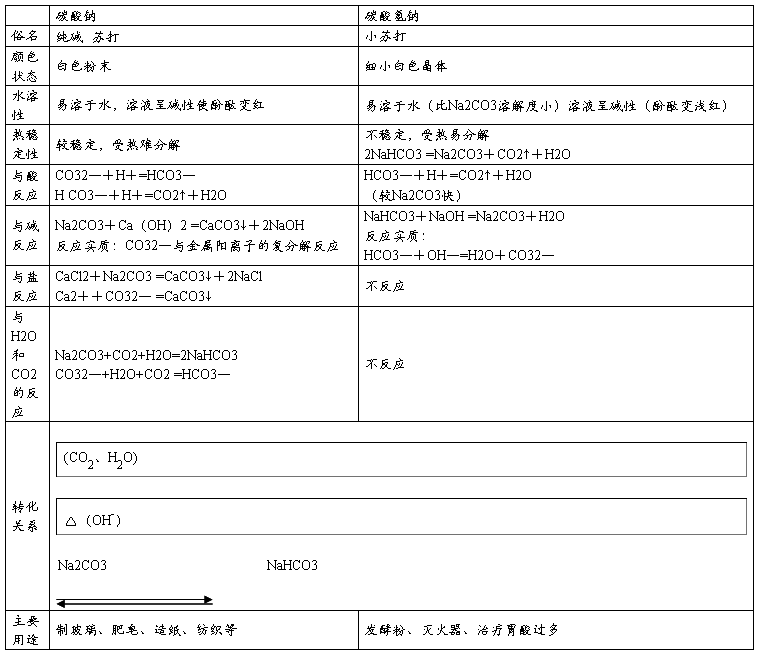
Na2CO3和NaHCO3比较
镁的提取及应用
镁的提取












 海水 母液 MgCl2
海水 母液 MgCl2

 a 溶液
a 溶液




 贝壳 石灰乳
贝壳 石灰乳
CaCO3 === CaO + CO2↑
CaO + H2O ===Ca(OH)2(石灰乳)
Ca(OH)2 + MgCl2 ===Mg (OH)2↓+ CaCl2
Mg(OH)2 + 2HCl === MgCl2 + 2H2O

 MgCl2·6H2O === MgCl2 + 6H2O
MgCl2·6H2O === MgCl2 + 6H2O

MgCl2 === Mg + Cl2↑
物理性质
镁是银白色金属,有金属光泽,密度较小,硬度较大,质地柔软,熔点较低,是热和电的良导体。
化学性质

 1、与空气的反应
1、与空气的反应
2Mg + O2 === 2MgO
 3Mg + N2 ===2Mg2N3
3Mg + N2 ===2Mg2N3
2Mg + CO2 === 2MgO + C
2、与水的反应
Mg+2H2O === Mg(OH)2+H2↑
3、与酸的反应
Mg + H2SO4 === MgSO4 + H2↑
用途
1)镁合金的密度较小,但硬度和强度都较大,因此被用于制造火箭.导弹和飞机的部件
2)镁燃烧发出耀眼的白光,因此常用来制造通信导弹和焰火;
3)氧化镁的熔点很高,是优质的耐高温材料
从铝土矿中提取铝
①溶解:Al2O3+2NaOH === 2NaAlO2+H2O
②过滤:除去杂质
③酸化:NaAlO2+CO2+2H2O === Al(OH)3↓+NaHCO3
④过滤:保留氢氧化铝
⑤灼烧:2Al(OH)3 =△=Al2O3 + H2O

⑥电解:2Al2O3(熔融) = 4Al+3O2↑
铝合金特点:1、密度小2、强度高3、塑性好4、制造工艺简单5、成本低6、抗腐蚀力强
铝的化学性质——两性
与非金属:4Al+3O2=2Al2O3
与酸的反应:2Al + 6HCl = 2AlCl3 + 3H2↑
与碱的反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
钝化:在常温下,铝与浓硝酸、浓硫酸时会在表面生成致密的氧化膜而发生钝化,不与浓硝酸、浓硫酸进一步发生反应。
 铝热反应:
铝热反应:
2Al + Fe2O3 === 2Fe + Al2O3
铝热剂:铝粉和某些金属氧化物(Fe2O3、FeO、Fe3O4、V2O5、Cr2O3、MnO2)组成的混合物。
铝的氧化物(两性)
与酸的反应:Al2O3 + 6HCl = 2AlCl3 + H2O
与碱的反应:Al2O3 + 2NaOH = 2NaAlO2 + H2O
铝的氢氧化物(两性)
与酸的反应:Al(OH)3 + 3HCl = AlCl3 + 3H2O
与碱的反应:Al(OH)3 + NaOH = NaAlO2 + 2H2O
Al(OH)3的制备:
Al3++3NH3·H2O=Al(OH)3↓+3NH4+
AlO2-+CO2(过量)+2H2O=Al(OH)3↓+HCO3-
3AlO2-+Al3++6H2O=4Al(OH)3↓
Al3+的性质:Al3+ + 3OH-=Al(OH)3↓ Al3+ + 4OH-=AlO2- + 2H2O
Al3++3NH3·H2O=Al(OH)3↓+3NH4+
AlO2-的性质:AlO2- + H+ + H2O=Al(OH)3↓ AlO2- + 4H+ =Al3+ + 2H2O
AlO2-+CO2(过量)+2H2O=Al(OH)3↓+HCO3-

 从自然界中获取铁和铜
从自然界中获取铁和铜
 高炉炼铁 (1)制取CO:C+O2 === CO2,CO2+C ===CO
高炉炼铁 (1)制取CO:C+O2 === CO2,CO2+C ===CO

 (2)还原(炼铁原理):Fe2O3 + 3CO === 2Fe + 3CO2
(2)还原(炼铁原理):Fe2O3 + 3CO === 2Fe + 3CO2
除SiO2:CaCO3===CaO+CO2↑,CaO+SiO2===CaSiO3
炼铜:1.高温冶炼黄铜矿→电解精制;2.湿法炼铜:Fe + CuSO4 = FeSO4 + Cu;3.生物炼铜
铁、铜及其化合物的应用
铁的化学性质:铁是较活泼的金属(或中等活泼金属)表现为还原性。

Fe2+与Fe3+的相互转化:
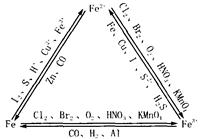
Fe3+的检验:(黄棕色)
实验①:向FeCl3 溶液中加入几滴KSCN溶液,溶液显血红色,
Fe3++3SCN- Fe(SCN)3
Fe(SCN)3
实验②:向FeCl3溶液加入NaOH溶液,有红褐色沉淀。
Fe3++3OH- Fe(OH)3↓
Fe(OH)3↓
Fe2+的检验:(浅绿色)
实验①:向FeCl2溶液加入NaOH溶液。
Fe2++2OH- Fe(OH)2↓(白色/浅绿色)4Fe(OH)2+O2+2H2O
Fe(OH)2↓(白色/浅绿色)4Fe(OH)2+O2+2H2O 4Fe(OH)3(红褐色)
4Fe(OH)3(红褐色)
实验②:加入KSCN溶液,无现象,再加入适量氯水,溶液显血红色
硅酸盐矿物、硅酸盐产品(传统材料)和信息材料的介绍
1.硅在自然界的存在:地壳中含量仅次于氧,居第二位。(约占地壳质量的四分之一);无游离态,化合态主要存在形式是硅酸盐和二氧化硅,
2.硅酸盐的结构:
(1)硅酸盐的结构复杂,常用氧化物的形式表示比较方便。硅酸盐结构稳定,在自然界中稳定存在。
(2)氧化物形式书写的规律:
①各元素写成相应的氧化物,元素的价态保持不变。
②顺序按先金属后非金属,金属元素中按金属活动顺序表依次排列,中间用“?”间隔。
③注意改写后应与原来化学式中的原子个数比不变。
3.Na2SiO3的性质:Na2SiO3易溶于水,水溶液俗称“水玻璃”,是建筑行业的黏合剂,也用于木材的防腐和防火。
化学性质主要表现如下:
(1)水溶液呈碱性(用PH试纸测),通CO2有白色沉淀:Na2SiO3 + CO2 + H2O == Na2CO3 + H2SiO3↓(白色胶状沉淀),离子方程式:SiO32- + CO2 + H2O == CO32- + H2SiO3↓。
硅酸受热分解:H2SiO3  H2O + SiO2 ,
H2O + SiO2 ,
原硅酸和硅酸都是难溶于水的弱酸,酸性:H2CO3强于H4SiO4或H2SiO3。
(2)硅酸钠溶液中滴加稀盐酸有白色沉淀:
Na2SiO3 + 2HCl == 2NaCl + H2SiO3↓,离子方程式:SiO32- + 2H+ == H2SiO3↓.
(3)硅酸和氢氧化钠反应:H2SiO3 + 2NaOH == Na2SiO3 + 2H2O.
离子方程式:H2SiO3 + 2OH- ==SiO32- +2H2O 。
4.硅酸盐产品(传统材料)

制玻璃的主要反应:SiO2 + Na2CO3  Na2SiO3 + CO2↑
Na2SiO3 + CO2↑
SiO2 + CaCO3  CaSiO3 + CO2↑.
CaSiO3 + CO2↑.
硅单质
1.性质:(1)物理性质:晶体硅是灰黑色有金属光泽,硬而脆的固体;导电性介于导体和绝缘体之间,是良好的半导体材料,熔沸点高,硬度大,难溶于溶剂。
(2)化学性质:①常温只与单质氟、氢氟酸和强碱溶液反应。性质稳定。
Si +2F2 == SiF4(气态), Si + 4HF == SiF4 +2 H2,
Si +2NaOH + H2O == Na2SiO3 +2H2↑
②高温下 Si + O2 SiO2 Si + 2H2
SiO2 Si + 2H2  SiH4 Si + 2Cl2
SiH4 Si + 2Cl2 SiCl4
SiCl4
3.硅的用途:(1)用于制造硅芯片、集成电路、晶体管、硅整流器等半导体器件;(2)制造太阳能;(3)制造合金,如含硅4%(质量分数)的钢导磁性好制造变压器的铁芯;含硅15%(质量分数)的钢有良好的耐酸性等。
4.工业生产硅:
制粗硅:SiO2 + 2C  Si + 2CO↑
Si + 2CO↑
制纯硅:Si + 2Cl2  SiCl4(液态)
SiCl4(液态)
SiCl4 + 2H2  Si + 4HCl
Si + 4HCl
二氧化硅的结构和性质:
1.SiO2在自然界中有较纯的水晶、含有少量杂质的石英和普遍存在的沙。自然界的二氧化硅又称硅石。
2.SiO2物理性质:硬度大,熔点高,难溶于溶剂(水)的固体。
3.SiO2化学性质:常温下,性质稳定,只与单质氟、氢氟酸和强碱溶液反应。
SiO2 + 4HF == SiF4 + 2H2O (雕刻玻璃的反应——实验室氢氟酸应保存在塑料瓶中)
SiO2 + 2NaOH == Na2SiO3 + H2O (实验室装碱试剂瓶不能用玻璃塞的原因).
加热高温:SiO2 + 2C  Si +2 CO, SiO2 + Na2CO3
Si +2 CO, SiO2 + Na2CO3  Na2SiO3 + CO2↑
Na2SiO3 + CO2↑
SiO2 + CaCO3  CaSiO3 + CO2↑,SiO2 + CaO
CaSiO3 + CO2↑,SiO2 + CaO  CaSiO3 .
CaSiO3 .
4.SiO2的用途:制石英玻璃,是光导纤维的主要原料;制钟表部件;可制耐磨材料;用于玻璃的生产;在光学仪器、电子工业等方面广泛应用。
硫酸型酸雨的成因和防治 :
1.含硫燃料(化石燃料)的大量燃烧
涉及到的反应有:
 ①2SO2 + O2 2SO3 SO3 + H2O = H2SO4
①2SO2 + O2 2SO3 SO3 + H2O = H2SO4
②SO2 + H2O  H2SO3 2H2SO3 + O2 = 2H2SO4
H2SO3 2H2SO3 + O2 = 2H2SO4
2.防治措施:
①从根本上防治酸雨—开发、使用能代替化石燃料的绿色能源(氢能、核能、太阳能)
②对含硫燃料进行脱硫处理(如煤的液化和煤的气化)
③提高环保意识,加强国际合作
SO2的性质及其应用
1.物理性质:无色、有刺激性气味、有毒的气体,易溶于水
* 大气污染物通常包括:SO2、CO、氮的氧化物、烃、固体颗粒物(飘尘)等
2.SO2的化学性质及其应用
⑴SO2是酸性氧化物
SO2 + H2O  H2SO3
H2SO3
SO2 + Ca(OH)2 = CaSO3↓+ H2O;CaSO3 + SO2 + H2O = Ca(HSO3)2
SO2 + 2NaOH = Na2SO3 + H2O(实验室用NaOH溶液来吸收SO2尾气)
SO2 (少量)+2NaHCO3=Na2SO3 + CO2 + H2O (常用饱和NaHCO3除去CO2中的SO2)
* 减少燃煤过程中SO2的排放(钙基固硫法)
 钙基固硫CaCO3 CaO + CO2↑;CaO + SO2 = CaSO3
钙基固硫CaCO3 CaO + CO2↑;CaO + SO2 = CaSO3
SO2 + Ca(OH)2 = CaSO3 + H2O 2CaSO3 + O2 = 2CaSO4
氨水脱硫:SO2 + 2NH3=(NH4)2SO3 2(NH4)2SO3 + O2 = 2(NH4)2SO4
⑵SO2具有漂白性:常用于实验室对SO2气体的检验
漂白原理类型
①吸附型:活性炭漂白——活性炭吸附色素(包括胶体)
②强氧化型:HClO、O3、H2、Na2O2等强氧化剂漂白——将有色物质氧化,不可逆
③化合型:SO2漂白——与有色物质化合,可逆
⑶SO2具有还原性
 2SO2 + O2 2SO3
2SO2 + O2 2SO3
SO2 + X2 + 2H2O = 2HX + H2SO4
接触法制硫酸
流程 设备 反应
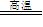
 生成二氧化硫 沸腾炉 S + O2 SO2 或4FeS2 + 11O2 2Fe2O3 + 8SO2
生成二氧化硫 沸腾炉 S + O2 SO2 或4FeS2 + 11O2 2Fe2O3 + 8SO2
 SO2接触氧化 接触室 2SO2 + O2 2SO3
SO2接触氧化 接触室 2SO2 + O2 2SO3
SO3的吸收 吸收塔 SO3 + H2O = H2SO4
* 为了防止形成酸雾,提高SO3的吸收率,常用浓硫酸来吸收SO3得到发烟硫酸
硫酸的性质及其应用
1.硫酸的酸性:硫酸是二元强酸 H2SO4 = 2H+ + SO42- (具有酸的5点通性)
如:Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O 硫酸用于酸洗除锈
2.浓硫酸的吸水性:浓硫酸具有吸水性,通常可用作干燥剂(不可干燥碱性和还原性气体)
3.浓硫酸的脱水性:浓硫酸将H、O按照2∶1的比例从物质中夺取出来,浓硫酸用作许多有机反应的脱水剂和催化剂。
4.浓硫酸的强氧化性:
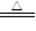 Cu + 2H2SO4(浓) CuSO4 + SO2↑+ 2H2O
Cu + 2H2SO4(浓) CuSO4 + SO2↑+ 2H2O
浓硫酸可以将许多金属氧化:金属 + 浓硫酸 → 硫酸盐 + SO2↑+ H2O
浓硫酸的氧化性比稀硫酸强:浓硫酸的强氧化性由+6价的S引起,而稀硫酸的氧化性由H+引起(只能氧化金属活动顺序表中H前面的金属)。
 C + 2H2SO4(浓) CO2↑+ 2SO2↑+ 2H2O
C + 2H2SO4(浓) CO2↑+ 2SO2↑+ 2H2O
硫及其化合物的相互转化
1.不同价态的硫的化合物
-2价:H2S、Na2S、FeS;+4价:SO2、H2SO3、Na2SO3
+6价:SO3、H2SO4、Na2SO4、BaSO4、CaSO4 、FeSO4
2.通过氧化还原反应实现含不同价态硫元素的物质之间的转化

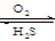
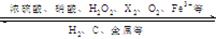 -2 0 +4 +6
-2 0 +4 +6
S S S S
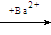 SO42-离子的检验:SO42- + Ba2+ = BaSO4↓
SO42-离子的检验:SO42- + Ba2+ = BaSO4↓
 取少量待测液 无明显现象 产生白色沉淀
取少量待测液 无明显现象 产生白色沉淀
氮氧化物的产生及转化
 途径一:雷雨发庄稼
途径一:雷雨发庄稼
N2+O2===2NO
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
 途径二:生物固氮
途径二:生物固氮
 途径三:合成氨 N2+3H2=======2NH3
途径三:合成氨 N2+3H2=======2NH3
氮氧化物的性质:
NO;无色无味的有毒气体(中毒原理与CO相同),密度略小于空气,微溶于水
2NO+O2===2NO2
NO2:红棕色的具有刺激性气味的有毒气体,密度比空气大,能溶于水
3NO2+H2O===2HNO3+NO
4NO + 3O2 + 2H2O=4HNO3 4NO2 + O2 + 2H2O=4HNO3
 氮肥的生产和使用
氮肥的生产和使用
 1.工业上合成氨 N2+3H2 ======= 2NH3
1.工业上合成氨 N2+3H2 ======= 2NH3
2.实验室制取氨气
① 2NH4Cl+Ca(OH)2====CaCl2+2NH3↑+2H2O
② 加热浓氨水
③ 浓氨水和碱石灰
3.氨气的性质
 :氨气易溶于水,溶于水显碱性,能使湿润的红色石蕊试纸变蓝。氨水易挥发,不易运输,但成本低。氨水应在阴凉处保存。雨天、烈日下不宜施用氨态氮肥。
:氨气易溶于水,溶于水显碱性,能使湿润的红色石蕊试纸变蓝。氨水易挥发,不易运输,但成本低。氨水应在阴凉处保存。雨天、烈日下不宜施用氨态氮肥。
喷泉实验:(1).实验装置的工作原理?(2).溶液变红色原因?(3).喷泉发生应具备什么条件?
 与酸的反应 NH3 +HCl===NH4Cl(产生白烟) 2NH3+H2SO4===(NH4)2SO4
与酸的反应 NH3 +HCl===NH4Cl(产生白烟) 2NH3+H2SO4===(NH4)2SO4
催化氧化:4NH3 + 5O2 =======4NO + 6H2O (制备硝酸)

 盐:固态,易分解,易溶于水,与碱反应,产生
盐:固态,易分解,易溶于水,与碱反应,产生
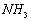 而挥发。比
而挥发。比
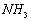 易于保存和运输,但成本更高。Cl-
易于保存和运输,但成本更高。Cl-
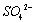 不被植物吸收,在土壤中积累,影响植物生长。不能在碱性土壤中使用,不能雨天使用。 NH4Cl===NH3↑+HCl↑(加热分解NH4Cl晶体)
不被植物吸收,在土壤中积累,影响植物生长。不能在碱性土壤中使用,不能雨天使用。 NH4Cl===NH3↑+HCl↑(加热分解NH4Cl晶体)
硝酸的性质
1.物理性质:无色,具有挥发性的液体
2.化学性质:
 (1)不稳定性
(1)不稳定性
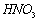 见光或加热会分解释放出
见光或加热会分解释放出
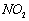 气体
气体
4HNO3 == 4NO2↑+ O2↑+2H2O
(2)强氧化性
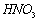 是一种强氧化性的酸,绝大多数金属及许多非金属单质能与硝酸反应.。
是一种强氧化性的酸,绝大多数金属及许多非金属单质能与硝酸反应.。
 浓
浓
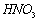 :
:
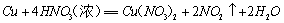
C+4HNO3==CO2↑+ 4NO2↑+2H2O 一般生成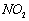 气体。
气体。
稀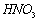 :
: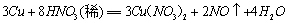 一般生成
一般生成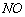 气体。
气体。
硝酸的制备:
设备 反应原理

转化器 4NH3 + 5O2 =======4NO + 6H2O
热交换器 2NO+O2===2NO2
吸收塔 3NO2+H2O===2HNO3+NO
