化学必修一专题一基础知识整理
一 物质的分类与转化 能与酸反应生成盐与水的氧化物称为碱性氧化物,例 CaO、CuO 能与碱反应生成盐与水的氧化物称为酸性氧化物,例 CO2 、SO2
例:①Na ②Cl2 ③FeCl3溶液 ④硫酸 ⑤碳酸钙 ⑥氧化钙 ⑦NaOH ⑧醋酸 ⑨空气 ⑩乙醇 对以上物质按组成分:属混合物③⑨ 属单质①② 属氧化物⑥ 属有机物⑧⑩ 属盐⑤
二 氧化还原反应
有元素化合价发生变化的反应称为氧化还原反应。
置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应,化合与分解反应有些是氧化还原反应有些不是氧化还原反应。
三 物质的量
1物质的量(符号 n )
单位: 摩尔( mol ) NA精确值为 12gC中所含原子数 近似为 6.02×10 mol 例:0.2molH2SO4中含H 0.4 mol、含SO4约 1.204×10 个、含原子总数 1.4 NA
2 摩尔质量是指: 单位物质的量的物质所具有的质量
符号: M 单位: g·mol 其在数值上应等于 该物质相对原子质量或相对分子质量 例:二氧化碳的相对分子质量为 44 摩尔质量为 44 g·mol 1摩尔CO2质量为 44g
1.8g水中约含 6.02×10 个水分子。
四 物质的聚集状态
1 决定物质的体积大小的因素有: 微粒的数目 微粒的大小 微粒间的距离 。液体、固体的体积大小主要由 微粒的数目 微粒的大小 决定。气体的体积大小主要由 微粒的数目 微粒间的距离 决定,在温度和压强一定时,相同物质的量的任何气体都具有相同的 体积 。
2 气体摩尔体积是指: 单位物质的量的气体所占的体积
符号 Vm 单位 L·mol 在标况下约为 22.4 L·mol
例 在标准状况下5600毫升的C02的质量为多少?(11g)
五 物质的分散系
1 各类分散系最本质的区别是: 分散质粒子的直径大小 。
2 浊液、溶液、胶体三者区别
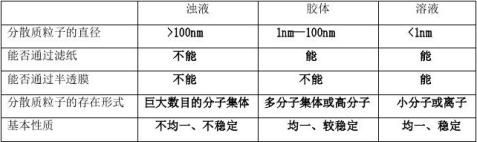
—1—122—1—12-231223—1
1) 丁达尔效应 可以此区别溶液和胶体,
2) 吸附性 可用于解释明矾净水的原理。
4 电解质和非电解质
在水溶液中或熔融状态下能导电的化合物叫做电解质,在上述两种条件下都不能导电的化合物叫做非电解质。
例1:NaCl CaCO3 NH3 Cu HNO3溶液 H2O C2H5OH Ba(OH)2 NH3·H2O CO2
以上属非电解质的是NH3 C2H5OH CO2 电解质是 NaCl CaCO3 H2O Ba(OH)2 NH3·H2O
例2:写出下列物质的电离方程式
NH4Cl = NH4 + Cl Ba(OH)2 = Ba + 2OH
H2SO4 = 2H + SO4 NaHCO3 = Na + HCO3
第二单元 研究物质的实验方法
一 物质的分离与提纯 人们可根据混合物各组分性质的差异,采取适当的方式将混合物中各物质分离开来。如 易溶固体与难溶固体的混合物,可通过溶解、过滤、蒸发三步实现分离; 两种可溶性固体,若它们的溶解度随温度变化有较大差异,可通过溶解、结晶的方法将其分离; 两种互不相溶的液体,可通过 分液 方法分离,所用主要仪器是 分液漏斗 。
两种互相溶解但在另一溶剂中溶解度不同的物质可通过 萃取 方法分离,但不能用 酒精 作萃取剂来萃取溴水中的溴,因为酒精与水互溶,不分层。
两种互相溶解但沸点不同的液体,可通过 蒸馏 方法分离,制无水乙醇可先加 生石灰 后蒸馏。 胶体与溶液的混合物,可利用 半透膜 ,用 渗析 的方法分离。
二 常见物质的检验
1、CO3的检验:取样,加入稀盐酸,放出无色无味的气体,该气体能使澄清石灰水变浑浊,则说明被检液中存在CO3。
2、SO4的检验:取样,先加入稀盐酸,然后加入氯化钡溶液,若此时出现白色沉淀,则说明被检液中存在SO4。
3、NH4的检验:取样,加入 氢氧化钠溶液 ,然后 加热 ,若产生 能使湿润的红色石蕊试纸变蓝 的气体,则说明存在NH4。
4、Cl的检验:取样,加入 硝酸酸化的硝酸银溶液 ,若产生 白色沉淀 ,则说明存在Cl。
5、焰色反应可检验某些 金属 元素,如:钠的火焰呈 黄 色,钾的火焰呈 紫 色(需透过 蓝色钴玻璃 观察),做焰色反应实验前先要将铂丝在 稀盐酸 中洗涤,然后在火焰上灼烧至与火焰颜色相近。焰色反应是 元素 的性质,是一个 物理 变化。
三 溶液的配制及分析
1.溶液中溶质的物质的量浓度是指 单位体积溶液内所含溶质B的物质的量 ,用符号 CB 表示, CB=nB/V 常用单位为 mol·L 。
2.容量瓶是用于配制 一定 体积、 一定 浓度的溶液的容器,在使用之前必须先 检查是否漏水 。其瓶
—1--++2-2-2-2-+2—+— +—2+—
颈上有一道 刻度线 ,瓶壁上标有 规格 和 温度 ,所以,在配制溶液过程中,热或冷的溶液一定要 恢复到室温 后才能转移到容量瓶中。
3.配制一定物质的量浓度的溶液的主要步骤为 计算、称量、溶解、转移、洗涤、定容、摇匀 。
4.误差分析:根据浓度公式推断
例:实验室欲配制100mL1.00mol/L的NaCl溶液,配制过程中的下列做法会使所配浓度偏高的是 C ,偏低的是 B D E ,无影响的是 A F 。
A.容量瓶使用前经蒸馏水清洗后没有干燥 B.在纸上称量NaOH且时间过长
C.俯视确定凹液面与刻度线相切 D.称量固体时,砝码与药品位置颠倒(用了游码)
E、移液时,忘记洗涤烧杯内壁和玻璃棒 F、摇匀后发现液面低于刻度线,但未加水
第三单元 人类对原子结构的认识
1、 画出Mg、Cl、Na的结构示意图。
A2、 原子表示方法:ZX +
原子中: 核电荷数 = 质子数 = 核外电子数
质量数(A)= 质子数(Z)+ 中子数(N)
3、 具有相同 核电荷数 的一类原子统称为元素,如质子数为1的原子都统称为 氢 元素,因此,同一元
素的原子之间 质子数 一定相同, 中子数 不一定相同。人们把具有一定 质子数 和 中子数 的一
23种原子称为一种核素。把 质子数 相同 中子数 不同的核素互称为同位素,如 1
1H 1H (D) 1H
(T) 。
第二篇:20xx年高中化学 专题一 化学家眼中的物质世界 物质的聚集状态第1课时导学案 苏教版必修1
20xx年高中化学 专题一 化学家眼中的物质世界 物质的聚集状态第1课
时导学案 苏教版必修1
【学习目标】
1. 掌握固态物质、液态物质和气态物质的一些常见特性,学会分析影响物质体积的因素。 2. 掌握气体摩尔体积的概念及标准状况下气体的摩尔体积,熟练运用公式。 【重、难点】 有关气体摩尔体积的计算
【知识回忆】根据上节所学填空:n = = 。
预习自学案
1.固体分为 和 。晶体如 等,具有规则的几何外形,具有固定的 ;而非晶态物质如 等则没有 。
2.许许多多的分子等微观粒子聚集在一起形成的宏观物质,聚集状态主要有 、 、 三种。影响物质聚集状态的外界因素有 和 。 3.参照课本11页交流与讨论,完成表1—4
结论:①相同条件下, 1mol的固体、液体体积 。
②相同条件下, 1mol的气体体积要比固体、液体 。
③相同条件下, 1mol的不同气体体积 。
讨论:对于一定量的固体或液体而言,它们的组成微粒之间距离很 ,故它们的体积主要决定
于 ;而组成不同物质的 是不同的,因此1摩尔不同固体或液体的体积各不相同。 对于气态物质而言,其组成微粒之间的距离比微粒本身 很多,故气态物质的体积主要
决定于 ,而在同温同压下,任何气体分子之间的距离近似相等,所以,在同温同
压下,1摩尔任何气体的体积都相同。
4.固体有一定的形状,液体没有固定的形状、但有固定的体积,气体没有固定的形状和体积,为
什么?为什么气体容易被压缩?固体、液体、气体的某些性质差异与物质的微观结构有何联系?
结合课本表1-3,我们来探讨一些问题.【填空】
⑴影响物质体积大小的因素(先自己思考,再与同学讨论)
⑵影响固、液体物质体积大小的主要因素
⑶影响气体物质体积大小的主要因素
5.气体摩尔体积定义 ,用符号 表示,常用单位为 、 。6.标准状况是指温度为 压强为 。在标准状况下,气体摩尔体积约为 。
7.气体的物质的量(n)、体积(V)和气体摩尔体积(Vm)之间存在如下关系: 。课内探究案
1.运用对比的方法分析影响物质体积的因素
2.总结有关物质的量的计算的三个公式及其变式
气体分子数

气体物质的量标况下气体体积
气体质量
3.探究例3的解题过程。第二种解题方法为什么比第一种简单,还有没有更简单的第三种方法?
【目标练习】
1.下列说法中正确的是( )
A.所有物质在温度变化时都能表现出三态变化。B.逐渐加热升温,碳酸氢铵也可体现出三态变化 C.面包是固体,但在受压时体积缩小,故可以说固体易被压缩 D.在水蒸气、液态水和冰中,水分子都在不停的运动 2.下列判断中正确的是( ) A. 在标准状况下,1 mol单质溴的体积约为22.4 L(溴在常温下为液态)
B. 在标准状况下,氧气的气体摩尔体积约为22.4 L
C. 常温常压下,1 mol氢气的体积为22.4L D.常温常压下,1 mol氧气的质量为32克
3.NA表示阿伏加德罗常数,下列物质中物质的量为1摩尔的是( )
A.通常状况下22.4 L氯气 B.18 g水 C. NA 个H2分子 D.标准状况下22.4 L H2O
4. 等物质的量的氢气和氦气在同温同压下具有相等的( )
A.原子数 B.体积 C.质子数 D.质量
5.标准状况下,100mL某气体的质量为0.125g,则该气体可能是下列物质中的( ) A.氨气 B.氮气 C.二氧化碳 D.一氧化碳 6.标准状况下,下列物质体积最大的是( ) A. 2克氢气 B. 20克二氧化硫 C. 23克钠 D. 160克溴 7.在标准状况下,将1克氦气,11克二氧化碳和4克氧气混合,所得混合气的体积约为( ) A. 28L B. 11.2L C. 16.8L D. 14.0L
8.森林是大自然的清洁器,一亩森林一昼夜可吸收44千克二氧化碳气体,呼出32千克氧气,即在标准状况下吸收 L 二氧化碳,呼出 L的氧气。 9.把200 g 9.8%的稀硫酸与足量锌粒反应,求(1)能生成氢气多少克?(2)这些气体中所含分子个数为多少?(3)若欲用500mL集气瓶来收集这些氢气,则需准备几个集气瓶(设实验在标准状况下进行)?
1
