溶液表面张力测定
1、 实验时,为什么毛细管口应处于刚好接触溶液表面的位置?如插入一定深度将对实验带来什么影响?
答案:减少测量P 误差,因为P 是气泡内外的压力差,在气泡形成的过程中,由于表面张力P r m ax = KP ,如果插入一定深度,P m ax 2 max 的作用,凹液面产生一个指向液面外的附加压力△P,γ= 外还要考虑插入这段深度的静压力使得?P max 的绝对值变大,表面张力也变大。
毛细管尖端为何必须调节得恰与液面相切?否则对实验有何影响?
提示:毛细管尖端若不与液面相切插入一定深度,会引起表面张力测定值偏小。
2、 最大气泡法测定表面张力时为什么要读最大压力差
答案:最大气泡法测定表面张力时要读最大压力差。因为随着气泡的形成,曲率半径逐渐由大变
小又变大,当曲率半径等于毛细管半径时,气泡呈半球形,气泡曲率半径最小,△P 最大。(若读中间某个压力差值,不能保证每次读压力差对应大小相同气泡。)
实验中为什么要测定水的?P 、max 由压力计读出。m ax ?
答案:答案:当曲率半径等于毛细管半径时的表面张力为: γ= ?P r m ax = K ?P 式中的K 为仪器常数,可用已知表面张力的标准物质测得,这种标准物质就是水。m ax 2
3、 对测量所用毛细管有什么要求?、对测量所用毛细管有什么要求?
答案:毛细管一定要清洗干净,管口平齐。
4、 在毛细管口所形成的气泡什么时候其半径最小?答案:测量时?P m ax 最大
7、表面张力为什么必须在恒温槽中进行测定?
答案:因为表面张力与温度有关,温度升高,表面张力下降。
8、如果气泡逸出的很快,或几个气泡一齐出,对实验结果有何影响?
答案:如果气泡逸出的很快,或几个气泡一齐出,即气泡形成时间太短,则吸附平衡就来不及在气泡表面建立起来,测得的表面张力也不能反映该浓度之真正的表面张力值。
为何要控制气泡逸出速率?提示:气泡逸出速率会影响气泡的大小,近而影响压力差值的大小,因而要保证测定过程中气泡逸出速率恒定。
9、根据什么来控制滴液漏斗的放液速度?对本实验有何影响?
答案:要求气泡从毛细管缓慢逸出,通过控制滴液漏斗的放液速度调节逸出气泡每分钟10 个左右。若形成时间太短,则吸附平衡就来不及在气泡表面建立起来,测得的表面张力也不能反映该浓度之真正的表面张力值。
10、测定正丁醇溶液的表面张力时,浓度为什么要按低到高的顺序依次测定?
答案:溶液的表面张力与浓度有关,浓度按低到高的顺序依次测定,可减少由测量瓶清洗不够
干净引起的误差。
11、温度变化对表面张力有何影响,为什么?
答案:温度升高,表面张力下降。表面张力与温度有关,
12 、测定时如何读取微压力计的压差?答案:测量时读取微压计上的最大压力。
13、对同一试样进行测定时,每次脱出气泡一个或连串两个所读结果是否相同,为什么?
答案:不同;每次脱出一个气泡结果才准确。如果气泡逸出的很快,或几个气泡一齐出,即气泡形成时间太短,则吸附平衡就来不及在气泡表面建立起来,测得的表面张力也不能反映该浓度之真正的表面张力值。
14 、准确地取x ml 正丁醇和、正丁醇和(1000 -x)ml 蒸馏水能得到准确的1000ml 溶液吗?
答案:不能,因为对真实液态混合物,混合前后体积不等,而且x 越大(浓度越大)时差别越大。
15、本实验为何要测定仪器常数?仪器常数与温度有关系吗?
答案:当曲率半径等于毛细管半径时的表面张力为: γ= ?P r m ax = K ? P 式中的K 为仪器常数,可用已知表面张力的标准物质-蒸馏水测得。仪器常数与m ax 2 温度无关,
16 、哪些因素影响表面张力测定的结果?如何减小或消除这些因素对实验的影响?
答案:温度、气泡逸出速度、毛细管是否干净及毛细管的尖端是否与液面相切会影响测定结果。措施:恒温、控制气泡逸出速率恒定、毛细管干净以及毛细管与液面相切。
17、如何检验仪器系统漏气?
答案:旋开分液漏斗,使压差计显示一定的数值,旋紧分液漏斗,此值保持一段时间不变。
18、从毛细管中逸出的气泡有什么要求?如何控制出泡速度?
答案:要求气泡从毛细管缓慢逸出,一个一个的出,逸出气泡每分钟10 个左右。通过控制滴
液漏斗的放液速度调节。
19、由0.5mol/l 的正丁醇溶液稀释浓度为0.02mol/l 正丁醇溶液50 ml,如何配制最简单?写出计算公式。、,如何配制最简单?写出计算公式。
答案: 0.5×0.25=(ρ/74)V 正丁醇(11.45ml)ρ)0.5x=0.02×50 2
20、微压计如何采零?、微压计如何采零?x=2 ml
答案:采零系与大气相通的时候,按下"采零"键,读数应显示"00.00"。
额外:如何由实验结果求算乙醇的横截面积?并与文献值相比较,写出计算相对误差和绝
对误差的计算公答案:由实验求得的Gm 代入a m = 1 Gm L -19 2 可求被吸附分子的截面
积am 。文献值:直链醇分子截面积为2.16×10 m -19 2 相对误差=(2.16×10 m - am )
/2.16×10 m :绝对误差=2.16×10 m - am -19 2 -19 2 14
21本实验为什么选用酒精压力计,而不用水银压力计?
答:本实验所测压差较小,若以水银压差计,误差很大。
旋光法测定蔗糖水解反应的速率常数
1、说出蔗糖溶液在酸性介质中水解反应的产物是什么?此反应为几级反应?、说出蔗糖溶液在酸性介质中水解反应的产物是什么?此反应为几级反应?? ?
答案:C 12H 22 O11 + H 2 O ? ? ? C 6 H 12 O 6 + C 6 H 12 H 6 ?H + ? 准一级反应蔗糖葡萄糖果糖
2、WZZ-2S 数字式旋光仪的使用分为哪几步?数字式旋光仪的使用分为哪几步?
答案:①.打开电源开关(POWER 仪器左侧),待5-10 分钟使钠灯发光稳定。②.打开光源开关
(LIGHT 仪器左侧),开关指DC 档,此时钠灯在直流电下点燃。③.按“测量”键,液晶显示屏应
有数字显示。④.清零⑤.测量
3、旋光管中的液体有气泡是否会影响实验数据?应如何操作?旋光管中的液体有气泡是否会影响实验数据?应如何操作?有气泡是否会影响实验数据?
答案:会,若管中液体有微小气泡,可将其赶至管一端的凸起部分。
4、本实验为什么可以通过测定反应系统的旋光度来度量反应进程?本实验为什么可以通过测定反应系统的旋光度来度量反应进程?
答案:在本实验中,蔗糖及其水解产物都具有旋光性,即能够通过它们的旋光度来量度其浓度。蔗糖是右旋的,水解混合物是左旋的,所以随水解反应的进行,反应体系的旋光度会由右旋逐渐转变为左旋,因此可以利用体系在反应过程中旋光度的改变来量度反应的进程。
5、旋光法测定蔗糖水解反应的速率常数实验分哪几步?旋光法测定蔗糖水解反应的速率
常数实验分哪几步?
答案:①.调节恒温槽的温度在30±0.1℃。②.溶液配制与恒温。③.仪器零点校正。④.测量(1)at 的测定(2)a8的测定
6、反应开始时,为什么将盐酸溶液倒入蔗糖溶液中,而不是相反?反应开始时,为什么将
盐酸溶液倒入蔗糖溶液中,而不是相反?
答案:因为将反应物蔗糖加入到大量HCl 溶液时,由于H 的浓度高,反应速率大,一旦加入蔗糖则马上会分解产生果糖和葡萄糖,则在放出一半开始时,已经有一部分蔗糖产生了反应,记录t 时刻对应的旋光度已经不再准确,影响测量结果。反之,将HCl 溶液加到蔗糖溶液中去,由于H+的浓度小,反应速率小,计时之前所进行的反应的量很小。
7、at 的测量时间是否正好为5,10,…60 分钟? 蔗糖水解过程中体系的旋光度增大还
是减小?蔗糖水解过程中体系的旋光度增大还是减小?
答案:不是,应在旋光度读数稳定后,先记录精确的反应时间,几分几秒,再读旋光度。由于反应体系的旋光度会由右旋逐渐转变为左旋,蔗糖水解过程中旋光度是在不断减小。
8、加入蔗糖中的蒸馏水的量有无限制?加入蔗糖中的蒸馏水的量有无限制?为什么?
答案:答案:有,不能加太多,因要移到25ml 容量瓶。
9、本实验需测哪些物理量?本实验需测哪些物理量?a8是如何测得的?是如何测得的?
答案:本实验需测不同时刻的at 及a8。将剩余混合液置于50-60℃的水浴中加热30 分钟,以加速水解:反应,然后冷却至实验温度,测其旋光度,此值即可认为是
10、氢离子浓度对反应速率常数测定是否有影响?氢离子浓度对反应速率常数测定是否有影响
答案:有影响。因a8。k 值与温度和催化剂的浓度有关。
11、实验中,为什么用蒸馏水来校正旋光仪的零点?实验中,为什么用蒸馏水来校正旋光仪的零点
答案:主要是因为蔗糖溶液以蒸馏水作溶剂,这样就消除了溶剂时实验结果的影响。故用纯蒸馏水:作零点校正。且蒸馏水没有旋光性,其旋光度为零。
12、实验结束后为什么必须将旋光管洗净?、实验结束后为什么必须将旋光管洗净?
答案:防止酸对旋光管的腐蚀。
13、记录反应开始的时间迟点或早点是否影响k 值的测定?、值的测定?
答案:不影响。因k 值与温度和催化剂的浓度有关,与时间无关。
14、在测定a8时,通过加热使反应速度加快转化完全,加热温度能否超过60℃?为什么?、时通过加热使反应速度加快转化完全,℃为什么?
答案:a8的测量过程中,剩余反应混合液加热温度不宜过高以50~55℃为宜,否则有副反应发生,溶液变黄。因为蔗糖是由葡萄糖的苷羟基与果糖的苷羟基之间缩合而成的二糖。在H+离子催化下,除了苷键断裂进行转化外,由于高温还有脱水反应,这就会影响测量结果。
15、蔗糖水解反应速率常数和哪些因素有关?、蔗糖水解反应速率常数和哪些因素有关?
答案:对指定的反应,速率常数和反应温度、催化剂有关。
16、在旋光度的测量中为什么要对零点进行校正?它对旋光度的精确测量有什么影响?在
本实验中若不进在旋光度的测量中为什么要对零点进行校正?它对旋光度的精确测量有什
么影响?行零点校正对结果是否有影响?行零点校正对结果是否有影响?
答案:(1)旋光仪由于长时间使用,精度和灵敏度变差,故需要对零点进行校正。答案:(2)若不进行零点校正,则各个时间所的的溶液的旋光度存在偏差,若不校正会使测量值的精确度变差,甚至产生较大的误差。本实验数据处理时,用旋光度的差值进行作图和计算,以ln(at ? a8) 对t 作图,故若不进行零点较正,只是a值不准确,但并不影响其差值,对k 的结果无影响。
17、配置蔗糖和盐酸溶液浓度不够准确,对测量结果是否有影响?、配置蔗糖和盐酸溶液浓度不够准确,对测量结果是否有影响?
答案:当蔗糖的浓度不准确时,对反应速率常数的测量结果无影响。当HCl 溶液浓度不准确时,对
反应速率常数的测量结果有影响。
18、蔗糖水解实验中为什么不用浓硫酸和稀硝酸,而用盐酸?
答案:浓硫酸有脱水性(会使蔗糖脱水变成碳)和强氧化性,浓稀硝酸都有强氧化性,所以不能使用(蔗糖水解生成的葡萄糖和果糖具有还原性)。
19、为什么配蔗糖溶液可以用粗天平称量?、为什么配蔗糖溶液可以用粗天平称量?
答案:本实验通过测at 来求得k, k 与反应物浓度无关,不同at 对应于不同的浓度值,无须知道它的准确浓度,所以配置蔗糖溶液可以用粗天平称量
20、旋紧旋光管的套盖时,用力过大会影响测量结果吗?、旋紧旋光管的套盖时,用力过大会影响测量结果吗?答案:会,若用力过大,易压碎玻璃盖片,或使玻璃片产生应力,影响旋光度。答案:凝固点降低法测定摩尔质量
21:蔗糖的浓度不影响lnc=-kt + B 的斜率,因而蔗糖浓度不准对k 的测量无影响。H+在该反应体系中作催化剂,它的浓度会影响k大小。
22在混合蔗糖溶液和盐酸溶液时,我们将盐酸溶液加到蔗糖溶液里去,可否将蔗糖溶液加到盐酸溶液中?为什么?
:不能。本反应中氢离子为催化剂,如果将蔗糖溶液加到盐酸溶液中,在瞬间体系中氢离子浓度较高,导致反应速率过快,不利于定。
23测定最终旋光度时,为了加快蔗糖水解进程,采用60℃左右的恒温使反应进行到底,为什么不能采用更高的温度进行恒温?
:温度过高将会产生副反应,颜色变黄。
24在旋光度的测量中,为什么要对零点进行校正?在本实验中若不进行校正,对结果是否有影响?
:因为除了被测物有旋光性外,溶液中可能还有其他物质有旋光性,因此一般要用试剂空白对零点进行校正。本实验不需要校正,
为在数据处理中用的是两个旋光度的差值。
25记录反应开始的时间晚了一些,是否会影响到k 值的测定?为什么?
:不影响。不同时间所作的直线的位置不同而已,但k(所作直线的斜率)相同。
胶体化学
1、何谓胶体?化学凝聚法制备Fe(OH)3 溶胶的基本原理是什么?
答案:溶胶是一种半径为1~1000nm 固体粒子(分散相)在液体介质(分散介质)中形成的多相高度分散的热力学不稳定系统。利用生成不溶性物质Fe(OH)3的化学反应,控制析晶过程,使其停留在胶核尺度的阶段,而得到溶胶的方法称为化学凝聚法。
2 、何谓电泳?胶体移动速度和那些因素有关?
答案:在外电场作用下,胶粒向异性电极定向移动的现象称为电泳。ζ=η? e0er E 胶体移动速度和胶体的纯度,电动电势ζ,介质粘度η,电位梯度E,介质等因素有关。
3、何谓电动电势?Fe(OH)3 溶胶的胶粒带何种电荷?
答案:滑动界面与溶液本体之间的电势差称电动电势ζ。Fe(OH)3溶胶的胶粒带正电荷。
4、电泳辅助液的选择根据什么条件?
答案:①不能与胶体发生反应②不挥发③辅助液中阴阳离子迁移速率要相近④辅助液的电导率与胶体的电导率相等,这样可避免因界面处电场强度突变造成两壁界面移动速率不等而产生的界面分层不好,模糊。
5 、电泳仪中两极距离是指两极间的最短距离吗?两极间距离是怎样量出来的?
答案:不是,用一根软电线或软线量取两电极沿U 型管的距离
6 、电解质引起溶胶聚沉的原因是什么?电解质是否越多越好?
答案:电解质中与胶体带有相反电荷的离子对溶胶有聚沉作用。不是,电解质太多反而将胶体保护起来而不聚沉。
7.何谓聚沉值?何谓聚沉能力?
答案:聚沉值是指:在一定时间,使一定量的溶胶发生明显的聚沉所需电解质的最小浓度,称为所加电解质的聚沉值。, 聚沉能力:聚沉值的倒数。
9、制成的胶体为什么要纯化?答案8:胶体不纯会影响胶体的电泳速率,从而影响到电动电势的测量,使ζ值不准。
9、电泳的时间是否越长越好,为什么?
答案:不是,时间太长,会使界面模糊,影响实验结果。
10、写出FeCl3水解反应式?解释胶粒带何种电荷取决于什么因素?
答: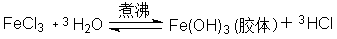
胶体带电性质取决于Fe(OH)3胶核对H+、Cl-Z吸附程度的大小及自身电离。
11、电泳的过程中外接电压是否要恒定?为什么?
答案:答案:要,ζ=E 是可变的,ζ值也是变化的。η? 公式中E(电位梯度)等于电压除以两极间距离,所以外加电压要恒定,否则e0er E
12、在计算电动电势时,胶粒移动、电泳过程中,连接(溶胶与辅助液界面)上升界面的是阴极还是阳极?在计算电动电势时胶粒移动程中距离是指界面上升距离吗?
答案:负极,是。
13、本实验用的是什么电极?为什么加人辅助液要沿着管壁慢慢地轻轻滴入?
答案:铂电极。防止辅助液与胶体混溶,界面模糊,影响实验结果的准确测定。
14、聚沉值的大小与哪些因素有关?、聚沉值的大小与哪些因素有关?
答案:影响聚沉的主要因素有温度、胶体的性质、胶体的浓度、反离子的价数、非电解质的作用、同号离子的作用等。温度升高聚沉值减少。
15、制备Fe(OH)3 溶胶时,如何往沸腾的蒸馏水中加入FeCl3 溶液?
答案:要一滴一滴的加FeCl3 溶液,这样使反应液可以充分反应,反应进行的完全。
16、为什么辅助液与胶体的界面要分明?、为什么辅助液与胶体的界面要分明?
答案:因为要量取胶体上升的距离,界面要清晰。
17、往电泳管里装入Fe(OH)3 溶胶及辅助液的过程有什么注意事项?
答案:两侧要同时并以同一速率加辅助液,而且要慢慢加入,防止辅助液与胶体混溶,造成二者界面答案:不清晰,影响实验测量。
18、在聚沉值测定实验中,每一种溶液是否要用固定的移液管取液?为什么?
答案:是,否则不同溶液间会造成污染,或是使溶液浓度不准,使得所测聚沉值不准。
19、做好聚沉值测定的关键是什么?、做好聚沉值测定的关键是什么?
答案:试管干净,移液管干净,要与原液比较。
20、电泳过程中电泳管为何要固定好?
答案:防止因为移动电泳管而使得两侧界面不清晰,刻度读数不准确。
21、电泳过程中,确定外接电压U 的大小的依据是什么?、电泳过程中,的大小的依据是什么?
答案:,电位梯度相同,对电泳速答案:影响电泳速度的一个重要因素是电位梯度E(电压除以两极间距离)度影响就相同,但电压不能过高,否则电流热效应增强,界面附近胶体密度增大,甚至出现凝聚现象。电位梯度一般采用3V/cm 左右。
22若电泳仪事先没有洗干净,内壁上残留有微量的电解质,对电泳测量的结果将会产生什么影响?
提示:可能改变ζ电势大小,甚至引起胶体的聚沉。
23电泳仪中不能有气泡,为什么?
提示:气泡会阻断电介质。
24 电泳速率的快慢与哪些因素有关?
提示:电泳苏联与胶粒的大小、带电量、电压的大小及两电极的距离等因素有关。
25. 高分子溶液对憎液溶胶有何影响。如何采用叔采-哈迪法则。
答:加入 较多高分子溶液可保护憎液溶胶,但少量高分子溶液则会使溶胶更不稳定。对于正胶,看负离子价数,对负胶,看正离子价数,叔采-哈迪规则说明反离子价态越高,越易使胶体聚沉。
二级反应-乙酸乙酯皂化
1.为什么实验用NaOH 和乙酸乙酯应新鲜配制?答:氢氧化钠溶液易吸收空气中二氧化碳而变质;乙酸乙酯容易挥发和发生水解反应而使浓度改变。
2.为何本实验要在恒温条件下进行,而且CH3 COOC2 H5 和NaOH 溶液在混合前还要预先恒温?混合时能否将乙酸乙酯溶液倒入NaOH溶液中一半时开始计时?
答:(1)因为温度对电导有影响。(2)不能,应刚混合完开始计时。
3.被测溶液的电导率是哪些离子的贡献?反应进程中溶液的电导率为何发生减少?
答:参与导电的离子有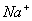 、
、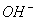 和
和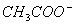 。
。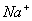 在反应前后浓度不变,
在反应前后浓度不变,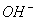 的迁移率比
的迁移率比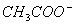 的迁移率大得多。随着时间的增加,
的迁移率大得多。随着时间的增加,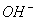 不断减少,
不断减少,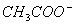 不断增加,所以,体系的电导率值不断下降。
不断增加,所以,体系的电导率值不断下降。
4. 为什么要使两种反应物的浓度相等?
答:为了使二级反应的数学公式简化。
5. 各溶液在恒温及操作中为什么要盖好?
答:因为本实验要测定溶液的电导率,对溶液浓度的要求特别高。若在恒温及操作过程中不盖好,则会因为溶液及溶剂的挥发或杂质的进入而造成溶液浓度的巨变而严重影响实验的结果,因此必须盖好装溶液的容器。
6. 如何从实验结果验证乙酸乙酯皂化反应为二级反应?
答:一方面,在同一温度下,通过计算得出的k为一定值。另一方面,通过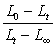 -t图,得到一直线。从这两方面均可说明乙酸乙酯皂化反应为二级反应。
-t图,得到一直线。从这两方面均可说明乙酸乙酯皂化反应为二级反应。
金属相图
实验注意事项:
1、内—外控转换开关不允许带电操作,转换时应切断电炉和控温仪电源,以免烧坏仪器。
2、避免温度过高而使样品发生氧化变质,否则体系的组成发生变化。
3、不能在一个步冷曲线的测试中不断改变冷却速度(即环境的温度),否则达不到均匀冷却而直接
影响实验结果。
4、降温速度不能太快,一般控制在5--7℃/分。
5、合金有两个转折点,必须待第二个转折点测完后方可停止实验,否则须重新测定。
6、实验结束时应将“加热量调节”旋钮和“冷风量调节”旋钮按逆时针旋到底位,然后切断电炉和
控温仪电源。
思考题:
1、何谓热分析法?用热分析法绘制相图时应注意些什么?
答:是相图绘制工作中的一种常用的实验方法,按一定比例配制均匀的液相体系,让他们缓慢冷却,以体系温度对时间作图,则为步冷曲线。曲线的转折点表征了某一温度下发生的相变的信息。
2、为什么要控制冷却速度,不能使其迅速冷却?
答:使温度变化均匀,接近平衡态,必须缓慢降低温度,一般每分钟降低5度。
3、如何防止样品发生氧化变质?
答:温度不可过高,空气不能过多和样品接触。
4、用相律分析在各条步冷曲线上出现平台的原因。
答:因为金属熔融系统冷却时,由于金属凝固放热对体系散热发生一个补偿,因而造成冷却曲线上
的斜率发生改变,出现折点。当温度达到了两种金属的最低共熔点,会出现平台。
5、为什么在不同组成融熔液的步冷曲线上,最低共熔点的水平线段长度不同?
答:不同组成,各组成的熔点差值不同,凝固放热对体系散热的补偿时间也不同。
6.样品融熔后为什么要保温一段时间再冷却?
答:使混合液充分混融,减小测定误差。
7.是否可用加热曲线来做相图?为什么?
答:不能。加热过程中温度难以控制,不能保持准静态过程。
8.为什么要缓慢冷却合金做步冷曲线?
答:使温度变化均匀,接近平衡态。
9.为什么坩埚中严防混入杂质?
答:如果混入杂质,体系就变成了另一多元体系,使绘制的相图产生偏差。
电导的测定
1、如何定性地解释电解质的摩尔电导率随浓度增加而降低?
答:对强电解质而言,溶液浓度降低,摩尔电导率增大,这是因为随着溶液浓度的降低,离子间引力变小,粒子运动速度增加,故摩尔电导率增大。对弱电解质而言,溶液浓度降低时,摩尔电导率也增加。在溶液极稀时,随着溶液浓度的降低,摩尔电导率急剧增加。
2、为什么要用音频交流电源测定电解质溶液的电导?交流电桥平衡的条件是什么?
答:使用音频交流电源可以使得电流处于高频率的波动之中,防止了使用直流电源时可能导致的电极反应,提高测量的精确性。
3、电解质溶液电导与哪些因素有关?
答:电解质溶液导电主要与电解质的性质,溶剂的性质,测量环境的温度有关。
4、测电导时为什么要恒温?实验中测电导池常数和溶液电导,温度是否要一致?
答:因为电解质溶液的电导与温度有关,温度的变化会导致电导的变化。实验中测电导池常数和溶液电导时的温度不需要一致,因为电导池常数是一个不随温度变化的物理量,因此可以直接在不同的温度下使用。
5 实验中为什么要用铂黑电极?使用时应注意什么?若不用铂电极,可采用什么电极代替?
答:镀铂黑的目的是为了增大电极的表面积,减小电流密度,从而降低由交流电引起的极化效应。但使用时要注意,不要用滤纸擦试铂黑,以免使铂黑脱落而改变电导池系数。实验结束后,用蒸馏水冲洗电极,并浸泡在蒸馏水中。可用石墨电极等惰性电极代替。
6. 电导测定中蒸馏水的电导是否应考虑?为什么?(水的电导率为10-6Ω-1·m-1)。
答:电导测定中蒸馏水的电导可以不考虑,因为水的电导率为10-6Ω-1·m-1,比待测溶液的电导小的多,所以其影响不大,可以忽略不计。
7. 试分析NaCl、HAc的电导率测定中随着溶液的稀释,其电阻的变化趋势,并加以解释。
答:NaCl、HAc的电导测定中,随着溶液的稀释,其电阻均变大。对NaCl来说,浓度减小,这溶液中的导电离子减少,故电导率下降,电阻变大;对HAc来说,浓度减小,离解度反而增大,但由于离子数减少,电阻也增大。
8. 如果长时间测不出平衡电阻(检流计不为零,耳机交流声大,示波器不为直线)是否影响测量准确度?(电导池电阻值是否会变?)
答:不会,因为该实验用的是交流电,频率较高,电导池中溶液各组分含量不变,电阻值不会改变。
