《有机综合推断》
一、知识讲解
有机综合推断题常以框图或变相框图的形式呈现一系列物质的衍变关系,经常是在一系列衍变关系中有部分产物已知或衍变条件已知,因而解答此类问题的关键是熟悉烃及各种衍生物之间的转化关系及转化条件。
(一)解答有机推断题的解题思路
1.剖析题意,分析已知条件和推断内容,弄清被推断物和其他有机物之间的关系
2.抓好解题关键,找出解题的突破口
3.联系题给信息和有关知识,应用规律进行逻辑推理或计算分析,排除干扰,精心筛选,作出正确的推断
(二)有机框图题的突破口
1.根据物质的性质和特征现象推断官能团
(1)能使溴水褪色的物质含有“碳碳双键”、“碳碳三键”、“酚类”或“—CHO”,含碳碳双键或三键的物质因加成而褪色;含醛基的物质因氧化而褪色;酚类物质因取代而褪色;液态饱和烃、液态饱和酯、苯及其同系物、氯仿、四氯化碳因萃取而褪色。
(2)能使酸性高锰酸钾溶液褪色的物质含有“碳碳双键”、“碳碳三键”、“—CHO”或为苯的同系物或还原性糖
(3)能发生银镜反应或能与新制氢氧化铜悬浊液反应的物质含有“—CHO”,可能为醛、甲酸、甲酸盐、甲酸酯、葡萄糖、果糖、麦芽糖等
(4)能发生加成反应的物质含有“碳碳双键”、“碳碳三键”“苯或苯的同系物”和“—CHO”
(5)能与Na发生置换反应的物质含有“—OH”或“—COOH”,可能为醇、酚或羧酸
(6)能与Na2CO3反应的物质含有“酚羟基”或“—COOH”,可能为酚或羧酸
(7)能与NaHCO3反应的物质含有“—COOH”或“—SO3H”,可能为羧酸或磺酸
(8)能发生消去反应的物质是“醇”或“卤代烃”
(9)能发生水解反应的物质是“卤代烃”或“酯”“二糖”、“多糖”、“蛋白质”
(10)遇FeCl3显紫色的物质含有“酚羟基”
(11)遇浓硝酸变黄的物质是“蛋白质”
(12)遇I2变蓝的物质是“淀粉”
(13)加入浓溴水出现白色沉淀的物质是“苯酚”
(14)把物质滴入新制氢氧化铜悬浊液中,颜色由蓝色变为绛蓝色,则原物质为多羟基物质
2.根据性质和有关数据推断官能团个数
(1)—CHO~2Ag~Cu2O
(2)2—OH~H2;2—COOH~CO32-~CO2;—COOH~HCO3-~CO2
3.根据某些反应产物推知官能团位置
(1)由醇氧化成醛或羧酸,推知“—OH”一定连接在有2个氢原子的碳原子上;由醇氧化成酮,推知“—OH”一定连接在有1个氢原子的碳原子上
(2)由消去反应的产物可确定“—OH”或“—X”的位置
(3)由取代反应的产物的种数可确定碳链的结构
(4)由加氢后碳链的结构可确定“碳碳双键”或“碳碳三键”的位置
4.根据反应条件推断反应类型
(1)NaOH的水溶液,发生水解反应:
①卤代烃的水解
②酯类的水解
(2)NaOH的醇溶液,加热,发生卤代烃的消去反应
(3)浓硫酸,加热,发生如下反应:
①醇的消去
②酯化反应
③成醚反应
④磺化反应
⑤硝化反应
⑥纤维素的水解
(4)溴水或溴的CCl4溶液,发生加成反应;如果加溴水有白色沉淀,则是苯酚的取代反应
(5)O2(Cu或Ag),加热,或CuO,加热,发生醇氧化反应
(6)O2或新制氢氧化铜悬浊液或银氨溶液,发生醛氧化反应;如果在框图中连续两次出现O2,则为醇—醛—酸的过程
(7)KMnO4(H+)或[O],发生醇、甲苯变成羧酸的反应
(8)稀硫酸,加热,发生酯类、淀粉的水解反应
(9)H2,催化剂(Ni或Pt),加热,发生不饱和键如碳碳双键、碳碳叁键、芳香烃、醛和酮的加成反应
(10)光照,X2,发生烷基上的取代反应
(11)Fe粉,Br2,发生苯环上的取代反应
(12)Fe粉,盐酸,发生—NO2被还原为—NH2的反应
5.特征数字
(1)某有机物与醋酸反应,相对分子质量增加42,则含有一个“—OH”;增加84,则含有两个“—OH”。即一个“—OH”转变为—OOCCH3。
(2)由“—CHO”变为“—COOH”,相对分子质量增加16;增加32则为两个“—CHO”
(3)与Cl2反应,如果相对分子质量增加71,则含有一个双键,如果增加34.5,则为取代反应,增加了一个氯原子。
(4)根据与H2加成时所消耗H2的物质的量进行突破:1mol“—C=C—”加成时需1mol H2,1mol “—C≡C—”完全加成时需2mol H2,1mol“—CHO”加成时需1mol H2,而1mol苯环完全加成时需3mol H2。
(5)1mol一元醇与足量乙酸反应生成1mol酯时,其相对分子质量将增加42,1mol二元醇与足量乙酸反应生成酯时,其相对分子质量将增加84。
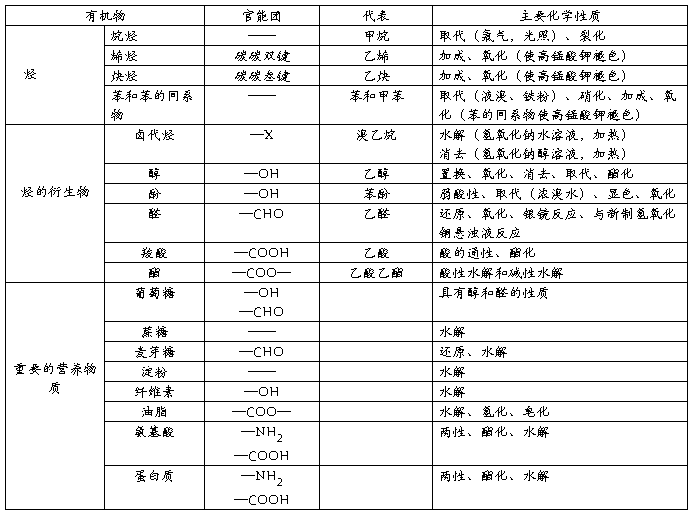
6.常见有机物的化学性质
7.推断有机物分子式的方法
(1)“单位物质的量”法
根据有机物的摩尔质量(分子量)和有机物中各元素的质量分数,推算出1 mol有机物中各元素原子的物质的量,从而确定分子中各原子个数,最后确定有机物分子式。
【例1】某化合物由碳、氢两种元素组成,其中含碳的质量分数为85.7%,在标准状况下11.2L此化合物的质量为14g,求此化合物的分子式.
【解析】此烃的摩尔质量为Mr=14g÷ =28g/mol
=28g/mol
1 mol 此烃中碳原子和氢原子的物质的量分别为:
n(C)=28g×85.7%÷12g/mol=2mol n(H)=28g×14.3%÷1g/mol=4mol
所以1mol此烃中含2 molC和4molH 即此烃的分子式为C2H4
(2)最简式法
根据有机物各元素的质量分数求出分子组成中各元素的原子个数之比(最简式),然后结合该有机物的摩尔质量(或分子量)求有机物的分子式。
【例1】另解:由题意可知:C和H的个数比为  :
: =1:2
=1:2
所以此烃的最简式为CH2,设该有机物的分子式为(CH2)n
由前面求得此烃的分子量为28可知14 n=28 n=2 即此烃的分子式为C2H4。
(3)燃烧通式法
根据有机物完全燃烧反应的通式及反应物和生成物的质量或物质的量或体积关系利用原子个数守恒来求出1 mol有机物所含C、H、O原子的物质的量从而求出分子式。
如烃和烃的含氧衍生物的通式可设为CxHyOz(Z=0为烃),燃烧通式为
CxHyOz+(x+y/4-z/2)O2 → xCO2+y/2H2O
【例2】某有机物0.6g完全燃烧后生成448mL(标准状况)CO2和0.36g水。已知该物质的蒸气对氢气的相对密度为30,求有机物的分子式。
【解析】该有机物的分子量为30×2=60
0.6g该有机物的物质的量为 = 0.01 mol
= 0.01 mol
n(CO2)= =0.02mol n(H2O)=
=0.02mol n(H2O)=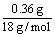 =0.02mol
=0.02mol
由原子个数守恒可知n(C)=n(CO2)=0.02mol,n(H )=2n(H2O)=0.04mol
0.6g该有机物中m(c)= M(C) ×n(C) =12 g/mol×0.02mol =0.24g
m(H)= M(H) ×n(H) = 1 g/mol×0.04mol=0.04g
m(O) = 0.6g-0.24g-0.04g=0.32g
CxHyOz +(x+y/4-z/2)O2 → x CO2 + y/2H2O
1 x y/2
0.01 mol 0.02 mol 0.02 mol
x=0.02 mol×1/0.01 mol=2 y=0.02 mol×4/0.01 mol=4
z=0.32g÷16g/mol÷0.01 mol =2
所以该有机物的分子式为C2H4O2
(4)平均值法
根据有机混合物中的平均碳原子数或氢原子数确定混合物的组成。
平均值的特征为: C小≤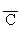 ≤C大 H小≤
≤C大 H小≤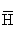 ≤H大
≤H大
求混合烃的组成烃时,一般方法有:
(1)一般是设平均分子式,结合反应方程式和体积求出平均组成,利用平均值的含义确定混合烃可能的分子式。有时也利用平均分子量来确定可能的组成,此时,采用十字交叉法计算较为简捷。
(2)两混合烃,若平均分子量小于或等于26,则该烃中必含甲烷。
(3)两混合气态烃,充分燃烧后,生成CO2气体的体积小于2倍原混合烃的体积,则原混合烃中必有CH4;若生成水的物质的量小于2倍原混合烃的物质的量,则原混合烃中必有C2H2。
(4)温度在100℃以上,气体混合烃与足量的氧气充分燃烧后,若总体积保持不变,则原混合烃中的氢原子平均数为4;若体积扩大,则原混合烃中的氢原子平均数大于4;若体积缩小,则原混合烃中氢原子平均数小于4,必有C2H2。
(5)有机物无论以何种比例混合,只要总质量一定或总物质的量一定,完全燃烧后产生CO2(或H2O)的量不变或耗氧量不变,确定各有机物应满足的关系:
1.总质量一定时:
①若生成H2O的量不变,则各有机物含氢的质量分数一定相等。
②若生成CO2的量不变,则各有机物含碳的质量分数一定相等。
③若耗氧量、生成CO2及H2O的量均不变,则各有机物的最简式一定相同。
2.总物质的量一定时:
①若生成H2O的量不变,则各有机物分子式中氢原子个数相同。
②若生成CO2的量不变,则各有机物分子式中碳原子个数相同。
③若耗氧量不变,烃设为CxHy 则“x+y/4” 的值相同; 若为烃的衍生物(设为CxHyOz) 则“x+y/4-z/2”的值相同; 或将烃的衍生物变形,既分子通式为CaHb(CO2)x(H2O)y(a,b为常数,x,y均可变化)。 ④若耗氧量、生成CO2及H2O的量均不变,则各有机物分子式肯定相同(即为同分异构体)。
【例3】某混合气体由两种气态烃组成,取0.1 mol 该混合气态烃完全燃烧后得4.48LCO2(标准状况)和3.6gH2O则这两种气体可能是( )
A.CH4和C3H8 B.CH4和C3H4 C.C2H4和C3H4 D.C2H2和C2H6
【解析】由题意可知0.1 mol 该混合气态烃含碳原子的物质的量为:
n(c) = n(CO2) =  = 0.2 mol
= 0.2 mol 

含氢原子的物质的量n(H) = 2n(H2O) =2×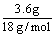 = 0.4 mol
= 0.4 mol
即1 mol该混合气态烃含碳原子的物质的量n(C) =2 mol n(H) = 4mol
该混合气态烃的平均分子式为C2H4,根据平均值的特征可知选BD。
(5)商余通式法(适用于烃类分子式的求法)
根据烷烃(CnH2n+2),烯烃和环烷烃(CnH2n),炔烃和二烯烃(CnH2n-2),苯和苯的同系物(CnH2n-6)的通式可以看出这些烃类物质的分子中都有一个共同的部分为CnH2n,这部分的式量为14n,因此用烃的分子量除以14就可以得到分子所含碳原子数即n值,再根据余数就可以求得烃的分子式。其规律为:
Mr/14能除尽,可推知为烯烃或环烷烃
Mr/14余数为2,可推知为烷烃
Mr/14差2可推知二烯烃或炔烃
Mr/14差6可推知为苯或苯的同系物
【例4】某烃的相对分子量为106,求该烃的分子式。
【解析】106/14差6能除尽即(106+6)/14=8所以该烃的分子式为C8H10
(6)区间法
根据有机物燃烧耗O2量的上下限值及有机物通式列出不等式进行求解确定其分子式。
【例5】常温下,在密闭容器中混有2ml气态烷烃和13mlO2,点燃爆炸,生成的只是气态产物,除去CO2和H2O后,又在剩余物中加入6mlO2,再进行爆炸重新得到的也只是气态产物,除得到CO2外,还剩余O2,试确定该烃的分子式。
【解析】设烷烃的分子式为CnH2n+2,1ml完全燃烧时耗O2为(3n+1)/2ml,
2ml完全燃烧时耗O2为(3n+1)ml。由题意可知13<3n+1<13+6
即4<n<6 所以n =5 分子式为C5H12
(7)讨论法
当反应物的相对用量不确定或条件不足时应根据有机物的状态或分子式中碳原子或氢原子数为正整数等这些条件来讨论有机物的分子式。
【例6】吗啡是严格查禁的毒品,吗啡分子中含碳71.58%,氢6.67%,氮4.91%,其余为氧元素。已知吗啡相对分子质量不超过300,试求吗啡的分子式。
【解析】分析题意就会发现吗啡的分子量不超过300,氮原子的百分含量最小,原子个数最少。根据有机物中原子个数为正整数的特点,先设吗啡分子中氮原子数为1,由题意可知吗啡的分子量为:14/4.91% = 285 < 300,如果氮原子数大于1,很显然吗啡的分子量会超过300不符合题意。因此可以确定吗啡的分子量为285,该分子中所含N、C、H、O个数分别为:N(N)=1,N(C)=285×71.58%÷12=17, N(H)=285×6.67%÷1=19,N(O)=285×16.84%÷16=3。故吗啡的分子式为C17H19NO3。
8.有机分子中的共线共面问题
解决有机分子里原子共线共面问题除了必须具备一定的化学知识外,还应注意化学与数学的结合,运用所学立体几何知识,凭借简单分子作母体模型解决相关问题。
(1)常见简单分子的几何构型及取代规律
1.甲烷的正四面体结构:在甲烷分子中,1个碳原子和任意2个氢原子可确定一个平面,其余的2个氢原子位于该平面的两侧,即甲烷分子中有且只有三原子共面(称为三角形规则)。当甲烷分子中某氢原子被其他原子或原子团取代时,该代替原子的共面问题,可将它看作是原来氢原子位置。
2.乙烯的平面结构:乙烯分子中的所有原子都在同一平面内,键角为120°。当乙烯分子中某氢原子被其他原子或原子团取代时,则代替该氢原子的原子一定在乙烯的平面内。
3.苯的平面结构:苯分子所有原子在同一平面内,键角为120°。当苯分子中的一个氢原子被其他原子或原子团取代时,代替该氢原子的原子一定在苯环所在平面内。
4.乙炔的直线结构:乙炔分子中的2个碳原子和2个氢原子一定在一条直线上,键角为180°。当乙炔分子中的一个氢原子被其他原子或原子团取代时,代替该氢原子的原子一定和乙炔分子的其他原子共线。
(2)价键特点及组合规律
1.共价型分子中,形成共价单键的原子可以绕轴旋转,如苯分子中苯环可以任一碳氢键为轴旋转,形成双键和叁键的原子不能绕轴旋转的,故原子有的一定共面,有的可能共面。
2.直线形分子中有2个原子处于某一平面内时,该分子中的所有原子也必落在此平面内。
3.共面的不在同一直线上的3个原子处于另一平面时,两平面必然重叠,两平面内的所有原子必定共平面。
第二篇:高考化学,有机推断题眼总结
高考化学,有机推断题眼总结
性质
①能使溴水褪色的有机物通常含有“—C=C—”、“—C≡C—”或“—CHO”。
②能使酸性高锰酸钾溶液褪色的有机物通常含有“—C=C—”或“—C≡C—”、“—CHO”或为“苯的同系物”。
③能发生加成反应的有机物通常含有“—C=C—”、“—C≡C—”、“—CHO”或“苯环”,其中“—CHO”和“苯
环”只能与H2发生加成反应。
④能发生银镜反应或能与新制的Cu(OH)2悬浊液反应的有机物必含有“—CHO”。 ⑤能与钠反应放出H2的有机物必含有“—OH”、“—COOH”。
⑥能与Na2CO3或NaHCO3溶液反应放出CO2或使石蕊试液变红的有机物中必含有-COOH。
⑦能发生消去反应的有机物为醇或卤代烃。
⑧能发生水解反应的有机物为卤代烃、酯、糖或蛋白质。
⑨遇FeCl3溶液显紫色的有机物必含有酚羟基。
⑩能发生连续氧化的有机物是伯醇,即具有“—CH2OH”的醇。比如有机物A能发生如下反应:A→B→C,
则A应是具有“—CH2OH”的醇,B就是醛,C应是酸。
条件
1.光照 烷烃或烷基中的H被取代
2.浓硫酸,170℃ 乙醇脱水成乙烯
3.浓硫酸,140℃ 乙醇脱水成乙醚
4.浓硫酸加热 醇脱水成烯烃醇与羧酸反应成酯 酯的酸性水解
5.NaOH溶液 --X被取代成—OH
6.NaOH的醇溶液 --X消去成烯烃
7.H2,催化剂,△ 烯烃或者醛的加成反应
8.Cu,O2,△ 醇催化氧化成醛
9.[O] 醇氧化成醛或羧酸或醛氧化成羧酸
10.→,Fe 苯环上的氢被取代
11.Br2或Br2得CCl4溶液 加成反应
①当反应条件为NaOH醇溶液并加热时,必定为卤代烃的消去反应。
②当反应条件为NaOH水溶液并加热时,通常为卤代烃或酯的水解反应。
③当反应条件为浓H2SO4并加热时,通常为醇脱水生成醚或不饱化合物,或者是醇与酸的酯化反应。
④当反应条件为稀酸并加热时,通常为酯或淀粉的水解反应。
⑤当反应条件为催化剂并有氧气时,通常是醇氧化为醛或醛氧化为酸。
⑥当反应条件为催化剂存在下的加氢反应时,通常为碳碳双键 、碳碳叁键、苯环或醛基的加成反应。
⑦当反应条件为光照且与X2反应时,通常是X2与烷或苯环侧链烃基上的H原子发生的取代反应,
而当反应条件为催化剂存在且与X2的反应时,通常为苯环上的H原子直接被取代。 数据
①根据与H2加成时所消耗H2的物质的量进行突破:1mol—C=C—加成时需1molH2,1mol—C≡C—
完全加成时需2molH2,1mol—CHO加成时需1molH2,而1mol苯环加成时需3molH2。 ②1mol—CHO完全反应时生成2molAg↓或1molCu2O↓。
③2mol—OH或2mol—COOH与活泼金属反应放出1molH2。
④1mol—COOH与碳酸钠或碳酸氢钠溶液反应放出1molCO2↑。
⑤1mol一元醇与足量乙酸反应生成1mol酯时,其相对分子质量将增加42,1mol二元醇与足量乙酸
反应生成酯时,其相对分子质量将增加84。
⑥1mol某酯A发生水解反应生成B和乙酸时,若A与B的相对分子质量相差42,则生成1mol乙酸,
若A与B的相对分子质量相差84时,则生成2mol乙酸。
结构
①具有4原子共线的可能含碳碳叁键。 ②具有4原子共面的可能含醛基。 ③具有6原子共面的可能含碳碳双键。 ④具有12原子共面的应含有苯环。 通式
符合CnH2n+2为烷烃,符合CnH2n为烯烃,符合CnH2n-2为炔烃,符合CnH2n-6为苯的同系物,符合
CnH2n+2O为醇或醚,符合CnH2nO为醛或酮,符合CnH2nO2为一元饱和脂肪酸或其与一元饱和醇生成
的酯。
物理性质
在通常状况下为气态的烃,其碳原子数均小于或等于4,而烃的衍生物中只有CH3Cl、CH2=CHCl、
HCHO在通常情况下是气态。
特殊性
1.能与Na反应 醇羟基,酚羟基,羧基
2.能与NaOH溶液反应 酚羟基,羧基;卤代烃;酯基
3.能与Na2CO3溶液反应 酚羟基,羧基
4.能与Na2CO3溶液反应放↑ 羧基
5.能与NaHCO3溶液反应 羧基
颜色变化
1.苯酚遇氯化铁溶液 紫色
2.苯酚遇浓溴水 白色↓
3.蛋白质遇浓硝酸 黄色
4.苯酚在空气中被氧气氧化为红色
