第一章 从实验学化学
一、常见物质的分离、提纯和鉴别
1.常用的物理方法——根据物质的物理性质上差异来分离。 混合物的物理分离方法
2、蒸馏 蒸馏是提纯或分离沸点不同的液体混合物的方法。用蒸馏原理进行多种混合液体
的分离,叫分馏。 操作时要注意:
①在蒸馏烧瓶中放少量碎瓷片,防止液体暴沸。
②温度计水银球的位置应与支管底口下缘位于同一水平线上。 ③蒸馏烧瓶中所盛放液体不能超过其容积的2/3,也不能少于l/3。 ④冷凝管中冷却水从下口进,从上口出。
⑤加热温度不能超过混合物中沸点最高物质的沸点,例如用分馏的方法进行石油的分馏。 3、分液和萃取 分液是把两种互不相溶、密度也不相同的液体分离开的方法。萃取是利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的方法。选择的萃取剂应符合下列要求:和原溶液中的溶剂互不相溶;对溶质的溶解度要远大于原溶剂,并且溶剂易挥发。
在萃取过程中要注意:
①将要萃取的溶液和萃取溶剂依次从上口倒入分液漏斗,其量不能超过漏斗容积的2/3,塞好塞子进行振荡。
②振荡时右手捏住漏斗上口的颈部,并用食指根部压紧塞子,以左手握住旋塞,同时用手指控制活塞,将漏斗倒转过来用力振荡。
③然后将分液漏斗静置,待液体分层后进行分液,分液时下层液体从漏斗口放出,上层液体从上口倒出。例如用四氯化碳萃取溴水里的溴。
iv、升华 升华是指固态物质吸热后不经过液态直接变成气态的过程。利用某些物质具有升华的特性,将这种物质和其它受热不升华的物质分离开来,例如加热使碘升华,来分离I2和SiO2的混合物。
② 几种重要阳离子的检验
(1)Ba2+ 能使稀硫酸或可溶性硫酸盐溶液产生白色BaSO4沉淀,且沉淀不溶于稀硝酸。 (2)Mg2+ 能与NaOH溶液反应生成白色Mg(OH)2沉淀,该沉淀能溶于NH4Cl溶液。 (3)Al3+ 能与适量的NaOH溶液反应生成白色Al(OH)3絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液。
(4)Ag+ 能与稀盐酸或可溶性盐酸盐反应,生成白色AgCl沉淀,不溶于稀 HNO3,但溶于氨水,生成[Ag(NH3)2]+。
(5)NH4+ 铵盐(或浓溶液)与NaOH浓溶液反应,并加热,放出使湿润的红色石蓝试纸变蓝的有刺激性气味NH3气体。
(6)Fe2+ 能与少量NaOH溶液反应,先生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。或向亚铁盐的溶液里加入KSCN溶液,不显红色,加入少量新
-
制的氯水后,立即显红色。2Fe2++Cl2=2Fe3++2Cl
(7) Fe3+ 能与 KSCN溶液反应,变成血红色 Fe(SCN)3溶液,能与 NaOH溶液反应,生成红褐色Fe(OH)3沉淀。 ③ 几种重要的阴离子的检验
-
(1)Cl 能与硝酸银反应,生成白色的AgCl沉淀,沉淀不溶于稀硝酸,能溶于氨水,
-
生成[Ag(NH3)2]+。(Br 能与硝酸银反应,生成淡黄色AgBr沉淀,不溶于稀硝酸。) -
(I能与硝酸银反应,生成黄色AgI沉淀,不溶于稀硝酸;也能与氯水反应,生成I2,使淀粉溶液变蓝。)
-
(2)SO42 能与含Ba2+溶液反应,生成白色BaSO4沉淀,不溶于硝酸。
-
(3)CO32 能与BaCl2溶液反应,生成白色的BaCO3沉淀,该沉淀溶于硝酸(或盐酸),生成无色无味、能使澄清石灰水变浑浊的CO2气体。
--
(4)HCO3 取含HCO3盐溶液煮沸,放出无色无味CO2气体,气体能使澄清石灰水变浑
-
浊或向HCO3盐酸溶液里加入稀MgSO4溶液,无现象,加热煮沸,有白色沉淀 MgCO3生成,同时放出 CO2气体。
三、化学计量 ①物质的量
定义:表示一定数目微粒的集合体 符号n 单位 摩尔 符号 mol
23
阿伏加德罗常数:0.012kgC-12中所含有的碳原子数。用NA表示。 约为6.02x10 微粒与物质的量 。 公式:n=
N
NAm M
②摩尔质量:单位物质的量的物质所具有的质量 用M表示 单位:g/mol 数值上等于该物质的分子量。质量与物质的量公式:n=
③物质的体积决定:①微粒的数目②微粒的大小③微粒间的距离 微粒的数目一定 固体液体主要决定②微粒的大小 气体主要决定③微粒间的距离。体积与物质的量公式:n=
V
Vm
标准状况下 ,1mol任何气体的体积都约为22.4L
④阿伏加德罗定律:同温同压下, 相同体积的任何气体都含有相同的分子数 ⑤物质的量浓度:单位体积溶液中所含溶质B的物质的量。符号CB 单位:mol/l 公式:CB=nB/V nB=CB×V V=nB/CB
溶液稀释规律 C(浓)×V(浓)=C(稀)×V(稀)
(1)配制一定物质的量浓度的溶液 (配制前要检查容量瓶是否漏水) 计算:算出固体溶质的质量或液体溶质的体积。
称量:用托盘天平称取固体溶质质量,用量简量取所需液体溶质的体积。
溶解:将固体或液体溶质倒入烧杯中,加入适量的蒸馏水(约为所配溶液体积的1/6),用玻璃棒搅拌使之溶解,冷却到室温后,将溶液引流注入容量瓶里。 洗涤(转移):用适量蒸馏水将烧杯及玻璃棒洗涤2-3次,将洗涤液注入容量瓶。振荡,使溶液混合均匀。
定容:继续往容量瓶中小心地加水,直到液面接近刻度2-3mm处,改用胶头滴管加水,使溶液凹面恰好与刻度相切。把容量瓶盖紧,再振荡摇匀。 5、过滤 过滤是除去溶液里混有不溶于溶剂的杂质的方法。 过滤时应注意:①一贴:将滤纸折叠好放入漏斗,加少量蒸馏水润湿,使滤纸紧贴漏斗内壁。 ②二低:滤纸边缘应略低于漏斗边缘,加入漏斗中液体的液面应略低于滤纸的边缘。
③三靠:向漏斗中倾倒液体时,烧杯的夹嘴应与玻璃棒接触;玻璃棒的底端应和过滤器有三层滤纸处轻轻接触;
漏斗颈的末端应与接受器的内壁相接触,例如用过滤法除去粗食盐中少量的泥沙。
如:烟、云、雾等的分散剂为气体,这样的胶体叫做气溶胶;AgI溶胶、Fe(OH)3溶胶、
Al(OH)3溶胶,其分散剂为水,分散剂为液体的胶体叫做液溶胶;有色玻璃、烟水晶均以
固体为分散剂,这样的胶体叫做固溶胶。 3、离子方程式的书写
? 第一步:写(基础) 写出正确的化学方程式 例如:CuSO4+BaCl2=BaSO4↓+CuCl2
第二步:拆(关键) 把易溶、易电离的物质拆成离子形式(难溶、难电离的以及气体等仍
+-+-+-
用化学式表示) Cu2+SO42+Ba2+2Cl=BaSO4↓+Cu2+2Cl
-
第三步:删(途径)删去两边不参加反应的离子 Ba2+ + SO42 = BaSO4↓
-
第四步:查(保证) 检查(质量守恒、电荷守恒)Ba2+ + SO42 = BaSO4↓ ※离子方程式的书写注意事项:
1.非电解质、弱电解质、难溶于水的物质,气体在反应物、生成物中出现,均写成化学式或分式。
4.浓H2SO4作为反应物和固体反应时,浓H2SO4写成化学式。 5.H3PO4中强酸,在写离子方程式时按弱酸处理,写成化学式。
6.金属、非金属单质,无论在反应物、生成物中均写成化学式。如:Zn+2H+=Zn2++H2↑ 7. 微溶物作为反应物时,处于澄清溶液中时写成离子形式;处于浊液或固体时写成化学式。微溶物作为生成物的一律写化学式 如条件是澄清石灰水,则应拆成离子;若给的是石灰乳或浑浊石灰水则不能拆,写成化学式。 9、离子共存问题
凡是能发生反应的离子之间或在水溶液中水解相互促进的离子之间不能大量共存(注意不是完全不能共存,而是不能大量共存)一般规律是:
1、凡相互结合生成难溶或微溶性盐的离子(熟记常见的难溶、微溶盐); 2、与H+不能大量共存的离子(生成水或弱)酸及酸式弱酸根离子: 氧族有:OH-、S2-、HS-、SO32-、HSO3- 卤族有:F-、ClO-
碳族有:CH3COO-、CO32-、HCO32-、SiO32- 3、与OH-不能大量共存的离子有:
NH42+和HS-、HSO3-、HCO3-等弱酸的酸式酸根离子以及弱碱的简单阳离子(比如:Cu2+、Al3+、Fe3+、Fe2+、Mg2+等等)
4、能相互发生氧化还原反应的离子不能大量共存: 常见还原性较强的离子有:Fe3+、S2-、I-、SO32-。
氧化性较强的离子有:Fe3+、ClO-、MnO4-、Cr2O72-、NO3-
10、氧化还原反应
①、氧化反应:元素化合价升高的反应 还原反应:元素化合价降低的反应
氧化还原反应:凡有元素化合价升降的化学反应就是 ②、氧化还原反应的判断依据-----有元素化合价变化
失电子总数=化合价升高总数==得电子总数==化合价降低总数。 ③、氧化还原反应的实质------电子的转移(电子的得失或共用电子对的偏移
口诀:失电子,化合价升高,被氧化(氧化反应),还原剂; ...
得电子,化合价降低,被还原(还原反应),氧化剂; ...④氧化剂和还原剂(反应物)
氧化剂:得电子(或电子对偏向)的物质------氧化性 还原剂:失电子(或电子对偏离)的物质------还原性 氧化产物:氧化后的生成物 还原产物:还原后的生成物。
第二篇:高一数学必修2知识点总结人教版
高中数学必修二复习
基本概念
公理1:如果一条直线上的两点在一个平面内,那么这条直线上的所有的点都在这个平面内。
公理2:如果两个平面有一个公共点,那么它们有且只有一条通过这个点的公共直线。
公理3: 过不在同一条直线上的三个点,有且只有一个平面。
推论1: 经过一条直线和这条直线外一点,有且只有一个平面。
推论2:经过两条相交直线,有且只有一个平面。
推论3:经过两条平行直线,有且只有一个平面。
公理4 :平行于同一条直线的两条直线互相平行。
等角定理:如果一个角的两边和另一个角的两边分别平行并且方向相同,那么这两个角相等。
空间两直线的位置关系:
空间两条直线只有三种位置关系:平行、相交、异面
1、按是否共面可分为两类:
(1)共面: 平行、 相交
(2)异面:
异面直线的定义:不同在任何一个平面内的两条直线或既不平行也不相交。
异面直线判定定理:用平面内一点与平面外一点的直线,与平面内不经过该点的直线是异面直线。
两异面直线所成的角:范围为 ( 0°,90° ) esp.空间向量法
两异面直线间距离: 公垂线段(有且只有一条) esp.空间向量法
2、若从有无公共点的角度看可分为两类:
(1)有且仅有一个公共点——相交直线;(2)没有公共点—— 平行或异面
直线和平面的位置关系:
直线和平面只有三种位置关系:在平面内、与平面相交、与平面平行
①直线在平面内——有无数个公共点
②直线和平面相交——有且只有一个公共点
直线与平面所成的角:平面的一条斜线和它在这个平面内的射影所成的锐角。
esp.空间向量法(找平面的法向量)
规定:a、直线与平面垂直时,所成的角为直角,b、直线与平面平行或在平面内,所成的角为0°角
由此得直线和平面所成角的取值范围为 [0°,90°]
最小角定理: 斜线与平面所成的角是斜线与该平面内任一条直线所成角中的最小角
三垂线定理及逆定理: 如果平面内的一条直线,与这个平面的一条斜线的射影垂直,那么它也与这条斜线垂直
esp.直线和平面垂直
直线和平面垂直的定义:如果一条直线a和一个平面 内的任意一条直线都垂直,我们就说直线a和平面 互相垂直.直线a叫做平面 的垂线,平面 叫做直线a的垂面。
直线与平面垂直的判定定理:如果一条直线和一个平面内的两条相交直线都垂直,那么这条直线垂直于这个平面。
直线与平面垂直的性质定理:如果两条直线同垂直于一个平面,那么这两条直线平行。
③直线和平面平行——没有公共点
直线和平面平行的定义:如果一条直线和一个平面没有公共点,那么我们就说这条直线和这个平面平行。
直线和平面平行的判定定理:如果平面外一条直线和这个平面内的一条直线平行,那么这条直线和这个平面平行。
直线和平面平行的性质定理:如果一条直线和一个平面平行,经过这条直线的平面和这个平面相交,那么这条直线和交线平行。
两个平面的位置关系:
(1)两个平面互相平行的定义:空间两平面没有公共点
(2)两个平面的位置关系:
两个平面平行-----没有公共点; 两个平面相交-----有一条公共直线。
a、平行
两个平面平行的判定定理:如果一个平面内有两条相交直线都平行于另一个平面,那么这两个平面平行。
两个平面平行的性质定理:如果两个平行平面同时和第三个平面相交,那么交线平行。
b、相交
二面角
(1) 半平面:平面内的一条直线把这个平面分成两个部分,其中每一个部分叫做半平面。
(2) 二面角:从一条直线出发的两个半平面所组成的图形叫做二面角。二面角的取值范围为 [0°,180°]
(3) 二面角的棱:这一条直线叫做二面角的棱。
(4) 二面角的面:这两个半平面叫做二面角的面。
(5) 二面角的平面角:以二面角的棱上任意一点为端点,在两个面内分别作垂直于棱的两条射线,这两条射线所成的角叫做二面角的平面角。
(6) 直二面角:平面角是直角的二面角叫做直二面角。
esp. 两平面垂直
两平面垂直的定义:两平面相交,如果所成的角是直二面角,就说这两个平面互相垂直。记为 ⊥
两平面垂直的判定定理:如果一个平面经过另一个平面的一条垂线,那么这两个平面互相垂直
两个平面垂直的性质定理:如果两个平面互相垂直,那么在一个平面内垂直于交线的直线垂直于另一个平面。
Attention:
二面角求法:直接法(作出平面角)、三垂线定理及逆定理、面积射影定理、空间向量之法向量法(注意求出的角与所需要求的角之间的等补关系)
多面体
棱柱
棱柱的定义:有两个面互相平行,其余各面都是四边形,并且每两个四边形的公共边都互相平行,这些面围成的几何体叫做棱柱。
棱柱的性质
(1)侧棱都相等,侧面是平行四边形
(2)两个底面与平行于底面的截面是全等的多边形
(3)过不相邻的两条侧棱的截面(对角面)是平行四边形
棱锥
棱锥的定义:有一个面是多边形,其余各面都是有一个公共顶点的三角形,这些面围成的几何体叫做棱锥
棱锥的性质:
(1) 侧棱交于一点。侧面都是三角形
(2) 平行于底面的截面与底面是相似的多边形。且其面积比等于截得的棱锥的高与远棱锥高的比的平方
正棱锥
正棱锥的定义:如果一个棱锥底面是正多边形,并且顶点在底面内的射影是底面的中心,这样的棱锥叫做正棱锥。
正棱锥的性质:
(1)各侧棱交于一点且相等,各侧面都是全等的等腰三角形。各等腰三角形底边上的高相等,它叫做正棱锥的斜高。
(3) 多个特殊的直角三角形
esp:
a、相邻两侧棱互相垂直的正三棱锥,由三垂线定理可得顶点在底面的射影为底面三角形的垂心。
b、四面体中有三对异面直线,若有两对互相垂直,则可得第三对也互相垂直。且顶点在底面的射影为底面三角形的垂心。
直线与方程
(1)直线的倾斜角
定义:x轴正向与直线向上方向之间所成的角叫直线的倾斜角。特别地,当直线与x轴平行或重合时,我们规定它的倾斜角为0度。因此,倾斜角的取值范围是0°≤α<180°
(2)直线的斜率
①定义:倾斜角不是90°的直线,它的倾斜角的正切叫做这条直线的斜率。直线的斜率常用k表示。即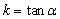 。斜率反映直线与轴的倾斜程度。
。斜率反映直线与轴的倾斜程度。
当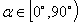 时,
时,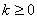 ;
;
当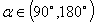 时,
时,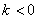 ;
;
当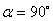 时,
时, 不存在。
不存在。
②过两点的直线的斜率公式: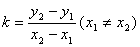
注意下面四点:
(1)当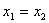 时,公式右边无意义,直线的斜率不存在,倾斜角为90°;
时,公式右边无意义,直线的斜率不存在,倾斜角为90°;
(2)k与P1、P2的顺序无关;
(3)以后求斜率可不通过倾斜角而由直线上两点的坐标直接求得;
(4)求直线的倾斜角可由直线上两点的坐标先求斜率得到。
(3)直线方程
①点斜式: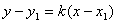 直线斜率k,且过点
直线斜率k,且过点
注意:当直线的斜率为0°时,k=0,直线的方程是y=y1。
当直线的斜率为90°时,直线的斜率不存在,它的方程不能用点斜式表示.但因
l上每一点的横坐标都等于x1,所以它的方程是x=x1。
②斜截式: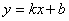 ,直线斜率为k,直线在y轴上的截距为b
,直线斜率为k,直线在y轴上的截距为b
③两点式: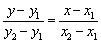 (
(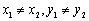 )直线两点
)直线两点 ,
,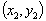
④截矩式: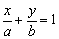
其中直线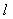 与
与 轴交于点
轴交于点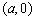 ,与
,与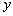 轴交于点
轴交于点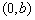 ,即
,即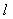 与
与 轴、
轴、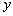 轴的截距分别为
轴的截距分别为 。
。
⑤一般式: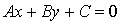 (A,B不全为0)
(A,B不全为0)
注意:1各式的适用范围
2特殊的方程如:平行于x轴的直线: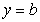 (b为常数);
(b为常数);
平行于y轴的直线: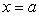 (a为常数);
(a为常数);
(4)直线系方程:即具有某一共同性质的直线
(一)平行直线系
平行于已知直线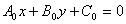 (
( 是不全为0的常数)的直线系:
是不全为0的常数)的直线系: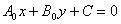 (C为常数)
(C为常数)
(二)垂直直线系
垂直于已知直线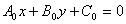 (
( 是不全为0的常数)的直线系:
是不全为0的常数)的直线系: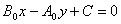 (C为常数)
(C为常数)
(三)过定点的直线系
① 斜率为k的直线系: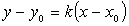 ,直线过定点
,直线过定点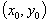 ;
;
② 过两条直线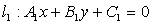 ,
,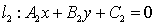 的交点的直线系方程为
的交点的直线系方程为
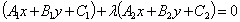 (
(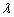 为参数),其中直线
为参数),其中直线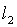 不在直线系中。
不在直线系中。
(5)两直线平行与垂直
当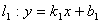 ,
,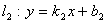 时,
时,
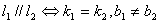 ;
;
注意:利用斜率判断直线的平行与垂直时,要注意斜率的存在与否。
(6)两条直线的交点
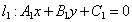
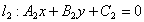 相交
相交
交点坐标即方程组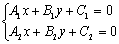 的一组解。
的一组解。
方程组无解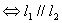 ; 方程组有无数解
; 方程组有无数解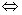
 与
与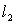 重合
重合
(7)两点间距离公式:设 是平面直角坐标系中的两个点,
是平面直角坐标系中的两个点,
则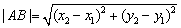
(8)点到直线距离公式:一点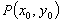 到直线
到直线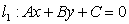 的距离
的距离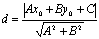
(9)两平行直线距离公式
在任一直线上任取一点,再转化为点到直线的距离进行求解。
圆的方程
(1)标准方程 ,圆心
,圆心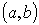 ,半径为r;
,半径为r;
(2)一般方程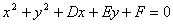
当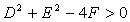 时,方程表示圆,此时圆心为
时,方程表示圆,此时圆心为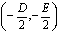 ,半径为
,半径为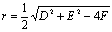
当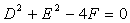 时,表示一个点; 当
时,表示一个点; 当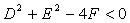 时,方程不表示任何图形。
时,方程不表示任何图形。
(3)求圆方程的方法:
一般都采用待定系数法:先设后求。确定一个圆需要三个独立条件,若利用圆的标准方程,
需求出a,b,r;若利用一般方程,需要求出D,E,F;
另外要注意多利用圆的几何性质:如弦的中垂线必经过原点,以此来确定圆心的位置。
直线与圆的位置关系
直线与圆的位置关系有相离,相切,相交三种情况:
(1)设直线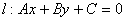 ,圆
,圆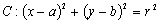 ,圆心
,圆心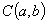 到l的距离为
到l的距离为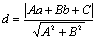 ,则有
,则有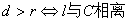 ;
;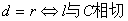 ;
;
(2)过圆外一点的切线:①k不存在,验证是否成立②k存在,设点斜式方程,用圆心到该直线距离=半径,求解k,得到方程【一定两解】
(3)过圆上一点的切线方程:圆(x-a)2+(y-b)2=r2,圆上一点为(x0,y0),则过此点的切线方程为(x0-a)(x-a)+(y0-b)(y-b)= r2
圆与圆的位置关系
通过两圆半径的和(差),与圆心距(d)之间的大小比较来确定。
设圆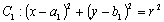 ,
,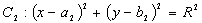
两圆的位置关系常通过两圆半径的和(差),与圆心距(d)之间的大小比较来确定。
当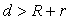 时两圆外离,此时有公切线四条;
时两圆外离,此时有公切线四条;
当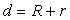 时两圆外切,连心线过切点,有外公切线两条,内公切线一条;
时两圆外切,连心线过切点,有外公切线两条,内公切线一条;
当 时两圆相交,连心线垂直平分公共弦,有两条外公切线;
时两圆相交,连心线垂直平分公共弦,有两条外公切线;
当 时,两圆内切,连心线经过切点,只有一条公切线;
时,两圆内切,连心线经过切点,只有一条公切线;
当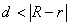 时,两圆内含; 当
时,两圆内含; 当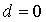 时,为同心圆。
时,为同心圆。
注意:已知圆上两点,圆心必在中垂线上;已知两圆相切,两圆心与切点共线
圆的辅助线一般为连圆心与切线或者连圆心与弦中点
