一、氧化还原基本概念
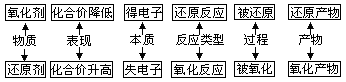
1. 四组重要概念间的关系
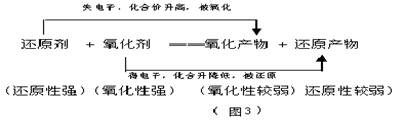
(1) 氧化还原反应:凡是反应过程中有元素化合价变化(或电子转移)的化学变化叫氧化还原反应。
氧化还原反应的特征:元素化合价的升降;氧化还原反应的实质:电子转移。
(2) 氧化反应和还原反应:在氧化还原反应中,反应物所含元素化合价升高(或者说物质失去)电子的反应成为氧化反应;反应物所含元素化合价降低(或者说是物质得到电子)的反应称为还原反应。
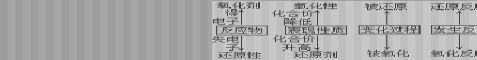
(3) 氧化剂、还原剂是指反应物。所含元素化合价降低的物质叫做氧化剂,所含元素化合价升高的物质叫做还原剂。
(4) 氧化产物、还原产物是指生成物。所含元素化合价升高被氧化,所得产物叫做氧化产物,所含元素化合价降低被还原,所得产物叫做还原产物。
关系:

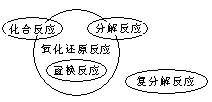
2. 氧化还原反应与四种基本反应类型

注意:有单质参加的化合反应和有单质生成的分解反应均为氧化还原反应。
二、氧化还原反应的有关计算
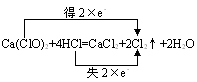
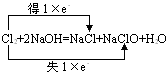
1. 氧化还原中的电子转移表示法
(1) 双线侨法:在反应物和生成物之间表示电子转移结果,该法侧重于表示同一元素的原子或离子间的电子转移情况,如


注意:
1线桥从方程式的左侧指向右侧;
2箭头不表示得失,只表示变化,所以一定要标明“得”或“失”。
…… …… 余下全文







 。同理,不同的还原剂与同一氧化剂反应时,反应条件越易,其还原剂的还原性越强。
。同理,不同的还原剂与同一氧化剂反应时,反应条件越易,其还原剂的还原性越强。

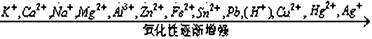
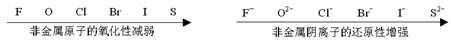
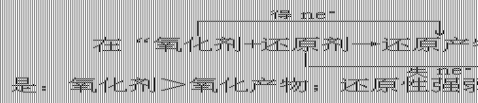
 3、根据氧化还原反应发生的条件(难易)或反应速率的大小来判断:
3、根据氧化还原反应发生的条件(难易)或反应速率的大小来判断: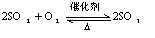 ,
,






 。同理,不同的还原剂与同一氧化剂反应时,反应条件越易,其还原剂的还原性越强。
。同理,不同的还原剂与同一氧化剂反应时,反应条件越易,其还原剂的还原性越强。 ,根据铁被氧化程度的不同
,根据铁被氧化程度的不同 ,可判断氧化性:
,可判断氧化性: 。同理,当不同的还原剂与同一氧化剂反应时,氧化剂被还原的程度越大,还原剂的还原性就越强。
。同理,当不同的还原剂与同一氧化剂反应时,氧化剂被还原的程度越大,还原剂的还原性就越强。