必修一、二化学实验整理
作者:高一三班组 季荣
1-1 1-2粗盐的提纯
实验步骤:
1、 粗盐溶解:称取约4g粗盐,加约12mL水。
2、 过滤:制作一个过滤器,组装过滤装置,进行过滤操作。
3、 蒸发。
4、 食盐晶体的洗涤:重新制作一个过滤器,将蒸发皿中物质全部转移到过滤器中,并用少量蒸馏水洗涤食盐。
5、 杂质离子(S042-)的检验:取上述得到的食盐0.5kg放入试管中,加约2mL水配成溶液,先滴几滴稀硝酸酸化,然后再滴入几滴BaCl2溶液。
6、 除杂
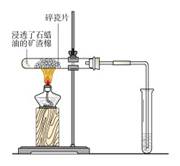
1-3制取蒸馏水
实验器材:
大试管、带单孔塞的导管、铁架台、酒精灯、大烧杯、碎瓷片AgNO3溶液和几滴稀硝酸。
实验步骤:
1 蒸馏前的检验:在试管中加入少量自来水,滴加几滴AgNO3溶液和几滴稀硝酸。
2 装配冷凝装置。检查气密性。
3 蒸馏:在烧瓶中加入约1/2体积的自来水,再加几粒沸石(或碎瓷片),重新连接好装置。加热,锥形瓶中收集到约10mL液体,停止加热。
4 蒸馏后的检验:在试管中加入少量蒸馏出的液体,滴加几滴AgNO3溶液和几滴稀硝酸。
1-4 碘的萃取
实验步骤:
1 混合:用量筒量取10mL碘的饱和水溶液,倒入分液漏斗,然后再加入4mL 四氯化碳,盖好玻璃塞
2 振荡:用右手压住分液漏斗口部(上端的玻璃塞),左手握住活塞部分,把分液漏斗倒转过来用力振荡。
3 静置:将分液漏斗放在铁架台上静置
4 分液:待液体分层后,将漏斗上端玻璃塞打开(或使塞上的凹槽对准漏斗上的小孔),再将漏斗下面的活塞打开,使下层液体慢慢沿烧杯壁留下,到有色液体接近流完时快速关闭活塞
1-5 配制100mL 1.00mol/L NaCl 溶液
实验步骤:
1 计算:计算实验所需NaCl固体的质量为______克。
…… …… 余下全文
 化学方程式:
化学方程式: 





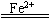 2H2O+O2↑
2H2O+O2↑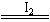 2H2O+O2↑
2H2O+O2↑