《选修1·化学与生活》
第一章 关注营养平衡第一节 生命的基础能源—糖类
1、糖类是绿色植物光合作用的产物。由C、H、O三种元素组成的一类有机化合物,也叫碳水化合物(通式为Cn(H20)m),但其实此名称并不能真实反应糖类的组成和特征,如鼠李糖C6H12O5是糖却不符合此通式,而符合此通式的,如甲醛HCHO、乙酸CH3COOH却不是糖类。
2、葡萄糖分子式C6H12O6,是一种白色晶体,有甜味,能溶于水
3、葡萄糖的还原性:
和银氨溶液反应: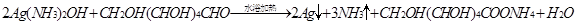 ;
;
和新制Cu(OH)2反应: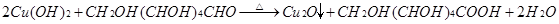 。
。
4、葡萄糖为人体提供能源
①葡萄糖提供能量的方程式: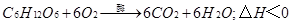 ;
;
②粮食中的糖类在人体中转化成葡萄糖而被吸收,在体内有三条途径,即:a、直接氧化供能;b、转化成糖元被肝脏和肌肉储存,当血液中的葡萄糖即血糖的质量分数比正常值低时,糖元就释放出来维持血糖浓度的相对稳定;c、转变为脂肪,储存在脂肪组织里。
5、蔗糖和麦芽糖是二糖,它们水解的化学方程式分别是: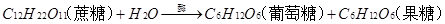
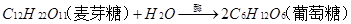
6、淀粉是一种重要的多糖,分子式(C6H10O5)n,是一种相对分子质量很大的天然高分子有机化合物,没有甜味,是一种白色粉末,不溶于冷水,但在热水中一部分淀粉溶解在水中,一部分悬浮在水里,长时间或高温可产生糊化。它能水解。淀粉在人体内的水解过程可表示为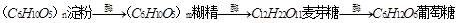 ,也可在酸的催化下逐步水解,其方程式
,也可在酸的催化下逐步水解,其方程式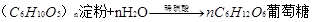 。 淀粉的特性:I2能使淀粉溶液变成蓝色。这是实验室检验淀粉或I2存在的重要原理。
。 淀粉的特性:I2能使淀粉溶液变成蓝色。这是实验室检验淀粉或I2存在的重要原理。
7、纤维素是绿色植物通过光合作用生成的,是构成植物细胞的基础物质,它是白色,无色无味的物质,是一种多糖,属于天然有机高分子化合物。纤维素在酶或浓硫酸催化下发生水解,其化学方程式为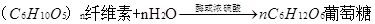 。纤维素不能作为人类的营养食物,但在人体内不可或缺,如:能刺激肠道蠕动和分泌消化液,有助于失误和废物的排泄……。
。纤维素不能作为人类的营养食物,但在人体内不可或缺,如:能刺激肠道蠕动和分泌消化液,有助于失误和废物的排泄……。
…… …… 余下全文