实验一 硫酸铜晶体里结晶水含量的测定
●实验用品
托盘天平、研钵、坩埚、坩埚钳、三脚架、泥三角、玻璃棒、干燥器、酒精灯、药匙、硫酸铜晶体(CuSO4·xH2O)、无水硫酸铜粉末
CuSO4·5H2O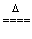 CuSO4+5H2O
CuSO4+5H2O
CuSO4+5H2O===CuSO4·5H2O
[问]上述两个反应是否互为可逆反应?为什么?
[生]不是。因为它们反应的条件不同:硫酸铜晶体失水需要加热,而硫酸铜粉末变为晶体在常温下就能进行。
[板书]实验一 硫酸铜晶体里结晶水含量的测定
一、测定原理
[学生讨论后回答]先取一定量的晶体样品,加热,使其失去结晶水,然后再称一下失去结晶水后的硫酸铜粉末的质量,前后两次的质量差即为结晶水的质量。根据结晶水的质量与原晶体的质量比即可求得结晶水的质量分数和x值。
[师]很好,上述测定原理我们可简单表示如下:
[讲解并板书]CuSO4·nH2O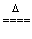 CuSO4+nH2O
CuSO4+nH2O
w(结晶水)=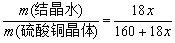
[师]现在,请大家先来认识一下实验台上的仪器及物品。
[教师举起研钵]这是什么?它有什么用途
[生]是研钵。可把固体块状物研碎成粉末。
[教师示范研碎硫酸铜晶体]
[讲解]把硫酸铜晶体研碎,可防止其加热时发生崩溅。
[向学生介绍坩埚、坩埚钳、三脚架、泥三角]
[讲解]坩埚是一种可直接用来加热的仪器,能承受较高的温度,常和三脚架和泥三角配套使用。取、放坩埚时,要用坩埚钳操作,尤其注意不能用手去触摸受热的坩埚。
[向学生介绍干燥器]
[讲解]该仪器主要用来干燥固体试剂,其盖子的揭法和普通盖子不一样,它是磨口的。
[教师示范干燥器的揭盖方法]
[教师举起托盘天平]
[问]这是我们最熟悉不过的称量用具,使用它时,我们应该注意什么呢?
[学生回答]使用前,应先调节天平平衡;称量时,砝码放在右盘,被称物放在左盘;对于有腐蚀性的药品,应放在玻璃器皿里称量;不能称量热的物品(须冷却到室温称量)。
[追问]若要称量那些和空气接触易变质或易吸水的物品时,又要注意什么?
[学生回答]要使称量动作足够快。
[师]很好!现在我们就利用实验台上的这些仪器并根据测定硫酸铜晶体结晶水含量的原理,来设计出一个具体的操作步骤。
[板书]二、实验步骤
[师]请大家先思考以下问题。
[投影]1.加热硫酸铜晶体应选用什么仪器?
2.加热硫酸铜晶体时应注意什么?
3.刚刚失水的硫酸铜晶体在冷却时应注意什么?应采取什么措施?
4.怎样才能使称量次数最少且又能达到实验目的?
5.要求测定结果准确,你觉得有重复称量的必要吗?
答案:1.坩埚
2.应用酒精灯缓慢加热,同时用玻璃棒轻轻搅拌,以防硫酸铜晶体局部受热而喷溅。
3.热的无水硫酸铜粉末在冷却时应避免与空气接触,以免吸收空气中的水分而造成实验误差。把热的硫酸铜粉末放在干燥器里冷却可避免其与空气接触。
4.直接用坩埚称取硫酸铜晶体样品,称其失去结晶水前后的质量即可。
5.有必要!
[过渡]现在,请大家根据测定硫酸铜晶体结晶水含量的原理并结合以上注意事项,分组讨论,设计出一个合理的实验方案。
[学生讨论后宣读实验方案]
[教师在评价学生的方案后,博采众长,与学生共同设计出一个比较完整的实验方案,供学生操作]
[教师也可投影出以下实验方案,供学生参考]
[投影展示]测定硫酸铜晶体结晶水含量的实验步骤:
1.研磨 在研钵中将硫酸铜晶体研碎。
2.称量 用坩埚准确称取2.0 g已经研碎的硫酸铜晶体,记下坩埚和硫酸铜晶体的总质量(m1)。
3.加热 将盛有硫酸铜晶体的坩埚放在三脚架上面的泥三角上,用酒精灯缓慢加热,同时用玻璃棒轻轻搅拌硫酸铜晶体,直到蓝色硫酸铜晶体完全变成白色粉末,且不再有水蒸气逸出。然后将坩埚放在干燥器里冷却。
4.称量 待坩埚在干燥器里冷却后,将坩埚放在天平上称量,记下坩埚和无水硫酸铜的总质量(m2)。
5.再加热称量 把盛有无水硫酸铜的坩埚再加热,然后放在干燥器里冷却后再称量,记下质量,到连续两次称量的质量差不超过0.1 g为止。
6.计算 根据实验数据计算硫酸铜晶体里结晶水的质量分数和化学式中x的实验值。
w(结晶水)=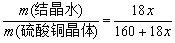
[m(结晶水)=m1-m2]
[师]请大家按以上设计方案进行操作。
[学生操作,教师巡视指导]
[学生实验完毕]
[教师]事实上,我们实验所用的硫酸铜晶体,就是五水合硫酸铜(CuSO4·5H2O)。
现在,请大家根据硫酸铜晶体的化学式计算结晶水的质量分数。将实验测定的结果与根据化学式计算的结果进行对比,并计算实验误差。
[学生活动]
[教师板书]三、实验结果分析
[各小组同学公布自己的计算结果]
[师]请大家对自己的实验结果进行误差分析。
[学生分组讨论,并宣布讨论结果进行交流]
[教师总结]对于定量实验而言,每一步操作的正确与否都直接影响着实验结果的准确性。由刚才大家的讨论结果可知:在操作过程中,若硫酸铜晶体脱水不充分或从干燥器里拿出坩埚后称量不及时均会造成测定结果的偏小;若在加热过程中有硫酸铜晶体崩出或盛硫酸铜晶体的坩埚预先未干燥均会引起实验结果的偏大,另外,天平使用或读数不准确,也会造成实验误差。
[投影练习]
根据实验室中测定硫酸铜晶体结晶水含量的实验,填写下列空白:
(1)从下列仪器中选出所需仪器(用标号字母填写) ;
A.托盘天平(带砝码) B.研钵 C.试管夹 D.酒精灯 E.蒸发皿 F.玻璃棒 G.坩埚
H.干燥器 I.石棉网 J.三脚架
除上述仪器外,还需要的仪器是: ;
(2)某学生实验后得到以下数据:
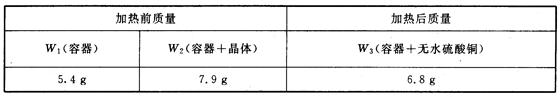
请写出结晶水含量(x%)的计算公式(用W1、W2、W3表示)
x%= ;
该生测定结果是偏高还是偏低?____________。
从下列分析中选出该学生产生实验误差的原因可能是(填写字母)____________
A.加热前称量时容器未完全干燥
B.最后两次加热后质量相差较大(大于0.1 g)
C.加热后容器未放入干燥器中冷却
D.加热过程中有少量溅失
[讲解]根据本节课所用仪器,不难得出(1)的答案。
对于(2),由实验的步骤及原理可知,样品晶体中结晶水的质量为W2-W3,而样品的质量应为:W2-W1,所以结晶水含量的计算式应为:
x%= ×100%
×100%
把实验所得数据代入上式:x%= ×100%=44%而CuSO4·5H2O晶体中结晶水含量的准确值是:
×100%=44%而CuSO4·5H2O晶体中结晶水含量的准确值是:
 ×100%=36%<44%,
×100%=36%<44%,
即实验值偏高。
若加热前称量时容器未完全干燥,则其中留有的水分会被算入结晶水中,导致结晶水含量偏高;对于B项,无法分析其对实验结果的影响;C项操作将会使热的CuSO4重新吸收空气中的水分而使W3比实际值偏大,从而导致W2-W3偏小而使x%也偏小;D项加热过程中溅失的CuSO4会导致W3偏小而使x%增大。
答案:(1)A、B、D、F、G、H、J 坩埚钳、泥三角、药匙
(2) ×100% 偏高 AD
×100% 偏高 AD
[小结]本节课我们主要学习了测定硫酸铜晶体里结晶水含量的原理和方法。
●板书设计
实验一 硫酸铜晶体里结晶水含量的测定
一、测定原理
CuSO4·nH2O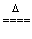 CuSO4+nH2O
CuSO4+nH2O
w(结晶水)=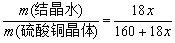
二、实验步骤
三、实验结果分析
●教学说明
本实验是继“一定物质的量浓度溶液的配制”和“中和滴定”之后的又一定量实验。相对定性实验而言,定量实验对实验步骤操作的准确度要求较高。而学生做好这一切的前提,首先是心中有数,即对实验步骤的每一步因果关系都十分明确,这就要求学生对实验原理的理解和领悟要尽量透彻。基于此,本节课把数学重点放在了实验原理的探究和实验方案的设计上。在教学方法上,主要采取了引导、启发、探究、讨论和实验等,这样,可以更大程度地调动学生学习的积极性,且可让学生亲自参予到教学中来,从而真正地提高教学效果。
第二篇:硫酸铜晶体里结晶水含量的测定及水晶知识
水晶常识
紫水晶
水晶是一种无色透明的石英结晶体矿物。它的主要化学成分是二氧化硅,跟普通砂子是同一娘胎的物质。当二氧化硅结晶完美时就是水晶;二氧化硅胶化脱水后就是玛瑙;二氧化硅含水的胶体凝固后就成为蛋白石;二氧化硅晶体粒子小于几微米时,就组成玉髓、燧石、次生石英岩。
结晶完美的水晶晶体属于六方晶系,常呈六棱柱状,柱体为一头尖或两头尖,多条长柱体连结在一块,通称晶族,美丽而壮观。二氧化硅结晶不完整,形状可谓是千姿百态。当你到海南水晶陈列馆去瞧一瞧,可以大开眼界:除了常见的长柱状外,还似宝剑形,有的若板状,有的如短柱形,有的像双锥。有的小如手指,有的大如巨石,有的不足半两,有的重达300多公斤。
水晶为什么能受得起一般性摔打?这是因为它有强健的“筋骨”,宝石学称之为硬度,硬度是指宝石抵抗外力刻划的强度。
水晶的硬度如何测得?
很早以前,当铺的老板对他们认为可疑的水晶仿制品,利用一个硬的尖物或钢锉在不明显的翻面作硬度检测,他们在面上刻划,留下一点不显眼痕迹,以便提醒其它典当同行注意。很显然这是一种最原始、最笨拙的测试手段,它有可能导致水晶破损。
1824年,一位叫弗里希.摩斯的奥地利矿物学家,从许多矿物中抽出10个品种,经过科学实验测出它们的相对硬度,由此得出水晶硬度为摩氏7。尽管后来美国国家标准局使用、推广更科学的诺普硬度测试器,但世界上许多国家的珠宝商,仍习惯于摩氏硬度表。
水晶的硬度相当于钢锉一般坚硬,这使得脆且易碎的黄玉、钻石、欧泊石、祖母绿之类的宝石相形见拙。
水晶解理:无。
解理,俗称辟开。某些宝石(如黄玉、钻石)在外力敲打、挤压或碰撞后,会沿着一个平面裂开,宝石的这种性质称为解理。
水晶破口:贝壳状。
破口,矿物学称为断口。它是指宝石在一定外力撞击下,不按一定的结晶方向破裂,而是形成一个断开的面。换一种解释,是说宝石的裂口可以沿着任何方向延伸,而不是沿着解理而发展。
结晶完好的水晶,常有好的人字形断口;在紫晶和热处理的黄晶中,多呈不平坦到薄片状破口。
水晶比重:2.56-2.66克/立方厘米。
这意味着一定体积水晶的重量,是相同体积水的重量的2.56-2.66倍。块状变种水晶密度可能稍高些。
水晶条痕:无色。
条痕,通常说的颜色,是人眼对一定波长的光线感觉的结果。
水晶透明度与透过它的光的质与量有关。
透明标准为:光线透明过厚度为1厘米以上的水晶碎片或薄片时,可以清晰地看到映出的图像。如是底像不够清楚,仅见轮廓,那便是半透明。
水晶光泽:玻璃光泽。无论在抛光面上还是在破口,都是如此。
光泽,指宝石表面对光线反射的一种光学性质。水晶既不像星光蓝宝石那样反射出绮丽的星光形条纹,又不像月光石那样发出淡蓝色波形光彩,更不像乘欧泊石那样闪烁着五颜六色。
观察水晶的光泽,可用手握着它,以灯光或窗户投进来的光线看表面反射,透明水晶亮度与光泽强弱有关。
水晶折射率:1.544-1.553,几乎不超出此范围。
折射率,是当光由空气中透入宝石晶体,并产生折射现象,其入射角正弦与折射角正弦之比值。
水晶重折射率:0.009(最大),此值非常稳定。
水晶光性特征:一轴晶正光性。
水晶色散:0.013。
色散是说宝石的折射率随照明光的不同而有一定的变化。例如钻石对红光折射为2.405;对绿光为2.427;紫光为2.449。
水晶熔点为1713摄氏度。其受热易碎的特性,是在实验时发现的。将水晶放在喷焰器的烈焰燃烤,除非有很好的保护,且慢慢冷却,否则晶体容易碎裂。这一脾性,古人已摸透。《博物要览》提醒道:“凡用水晶器物,不可用热汤滚水注之,即粉裂如击破者。”
水晶另一脾性就是怕碱不怕酸(氢氟酸除外),这是由于氧化硅特性所决定的。
像玛瑙一类宝石,当受热、摩擦、吹气或受打击时,往往散发一种特殊气味,使人联想到大蒜、马肉、萝卜、松香味儿,然而,水晶在上述情况下,绝无异味。
附:
水晶的化学成分及性质:
化学式为SiO2。纯净的无色透明的水晶是石英的变种。化学成分中含Si—46.7%,O—53.3%。由于含有不同的混入物而呈多种颜色。紫色和绿色等颜色是由金属离子所致。在水晶中含有砂状、碎片状针铁矿、赤铁矿、金红石、磁铁矿、石榴石、绿泥石等包裹体;发晶中则含有肉眼可见的似头发状的针状矿物的包裹体形成。含锰和铁者称紫水晶;含铁者( 呈金黄色或柠檬色 )称黄水晶;含锰和钛呈玫瑰色者称蔷薇石英;烟色者称烟水晶;褐色者称茶晶;黑色透明者称为墨晶;呈浅绿色者称为石髓。
水晶晶体结构及形态:
属三方晶系。晶体呈棱柱状并带六边形锥,柱面有横纹,紫水晶中常有角状色带。在自然界中,水晶常呈晶簇产出,造型美观。
水晶的物理性质:
水晶呈无色、紫色、黄色、绿色及烟色等。玻璃光泽。透明至半透明。硬度7。性脆。比重2.65。无解理。贝壳状断口,也有人字形断口。紫水晶具有清楚的二色性,黄水晶和茶水晶具有弱的二色性。发光水晶具有强烈的磷光性。带绿色的砂金水晶在长、短波紫外线照射下发灰绿色荧光。具有猫眼、虹彩和砂金效应。水晶具压电性。
硫酸铜晶体里结晶水含量的测定
一、“相似相溶”原理
在水、四氯化碳中分别加入蔗糖、磷酸、碘和萘(C10H8)晶体,试观察这四种分子晶体在上述两种溶剂中的溶解性。
几种分子晶体在水和四氯化碳中的溶解情况:(见下表)
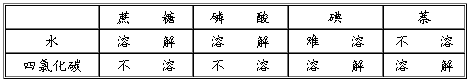
可以看出,蔗糖和磷酸易溶于水,不易溶于四氯化碳;而萘和碘却易溶于四氯化碳,不易溶于水。这说明,有些分子晶体在溶解性上差异很大,并且同一分子晶体在不同的溶剂中溶解性也有很大的差别。若分析这几种晶体和溶剂的结构就可以知道,蔗糖、磷酸、水是极性分子,而碘、萘和四氯化碳是非极性分子。通过对该实验和其他许多实验的观察和研究,人们得出了一个经验性的“相似相溶”结论:非极性溶质一般能溶于非极性溶剂;极性溶质一般能溶于极性溶剂。
二、硫酸铜晶体里结晶水含量的测定
1.实验原理
硫酸铜晶体中结晶水的质量分数=
(硫酸铜晶体和瓷坩埚的质量—无水硫酸铜和瓷坩埚的质量=结晶水的质量)。
2.实验步骤
①研磨:在研钵中将硫酸铜晶体研碎。
②称量;准确称量干燥的瓷坩埚的质量,并用此坩埚准确称取一定质量已研碎的硫酸铜晶体。
③加热:加热晶体,并用玻璃棒轻轻搅拌晶体,使其失去全部结晶水(由蓝色完全变为白色)。加热装置如下图所示(加热时去掉坩埚上盖)。
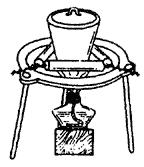
④称量:在干燥器内冷却后称量,并记下瓷坩埚和无水硫酸铜的质量。
⑤再加热、再称量至恒重:把盛有无水硫酸铜的瓷坩埚再加热,再放入干燥器里冷却后再称量,记下质量。到两次称量的质量相差不超过0.1g为止。
⑥计算:根据实验测得的结果求硫酸铜晶体中结晶水的质量分数。
3.注意事项
①晶体加热后先放在石棉网上稍冷却,之后一定要放在干燥器内冷却,以保证无水硫酸铜不会从空气中吸收水分而引起测得值偏低(相当于水没有完全失去)。
②晶体要在坩埚底上摊开加热,有利于失去全部结晶水,以免引起测得值偏低。
③加热时间不充分、加热温度过低(未全变白),都会使测得值偏低。
④加热过程中,应慢慢加热(可改垫石棉网),以防因局部过热而造成晶体溅失,引起测量值偏高。
⑤加热温度过高或时间过长,会导致硫酸铜少量分解,使测得值偏高。
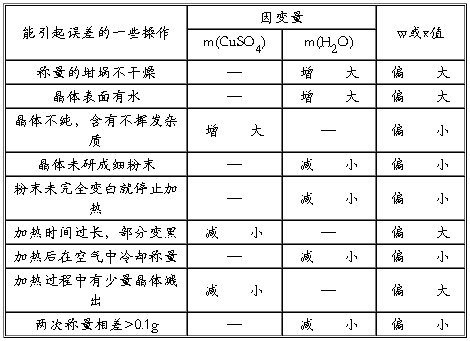
4.讨论题解答:分析实验中产生误差的原因
设硫酸铜晶体组成CuSO4·xH2O,m1为坩埚和晶体的质量,m2为加热后冷却称量所得坩埚与粉末的质量。
原理: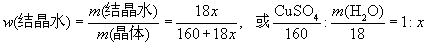
产生误差的原因及误差分析:
(1)称量的坩埚不干燥:加热后水分蒸发,这样实验过程减少的质量包括晶体中结晶水的质量和坩埚带有水的质量两部分,因计算时将实验过程减少的质量看作结晶水的质量,这样该过程计算时代入的m1—m2的值偏大,则计算出的w或x偏大。
(2)晶体表面有水:加热后水分蒸发,原理同(1),使得m1—m2的值偏大,则w或x偏大。
(3)晶体不纯,含有不挥发杂质:加热后不挥发性杂质不分解,只有其中的硫酸铜晶体分解,使得m1—m2的值偏小,则w或x偏小。
(4)晶体未研成细粉末:加热时由于晶体颗粒太大,使得颗粒内部的结晶水不能失掉,导致m1—m2的值偏小,则w或x偏小。
(5)粉末未完全变白就停止加热:粉末未完全变白说明结晶水未完全失掉,导致m1—m2的值偏小,则w或x偏小。
(6)加热时间过长,部分变黑:晶体变黑说明CuSO4已发生分解:CuSO4 CuO+SO3↑,使得m1—m2的值偏大,则w或x偏大。
CuO+SO3↑,使得m1—m2的值偏大,则w或x偏大。
(7)加热后在空气中冷却:加热后在空气中冷却,会使CuSO4又结合空气中的水蒸气,使得m1—m2的值偏小,则w或x偏小。
(8)加热过程中有少量晶体溅出:晶体溅出,使得m1—m2的值偏大,则w或x偏大。
(9)两次称量相差>0.1g:两次称量相差>0.1g,说明结晶水未完全失掉,使得m1—m2的值偏小,则w或x偏小。
以上分析可归结为下表:
硫酸铜晶体结晶水含量测定实验误差分析