pH法测定乙酸的电离平衡常数
实验原理
设乙酸的初始浓度为c0, 平衡时乙酸溶液中H+的浓度为x, 并假设
乙酸的电离常数足够大,可以忽略水的电离平衡的影响, 则对乙酸在
水中的离解:
HAc ? H+ + Ac-
初始浓度 c0 - -
平衡浓度 c0 – x x x
乙酸的电离平衡常数
在一定温度下利用酸度计测定乙酸溶液的pH值,而溶液的pH值与乙酸溶液中H+浓度之间存在如下关系:
pH=-lg[H+] 或 [H+]=10-pH
因此,若已知乙酸溶液的初始浓度c0,并且利用酸度计测定了乙酸溶液的pH值,通过计算可以求出电离平衡常数Ki值。
1.酸度计的准备
(1)打开酸度计的开关;
(2)选择钮置于pH;
(3)温度钮置于溶液温度;
(4) 用去离子水润洗复合电极,并用滤纸擦干,将其插入
pH=6.9 的标准缓冲溶液,将斜率调至最大,用调节定位旋钮使显示pH=6.9,然后再一次润洗复合电极并用滤纸擦干,插入pH=4.0的标准缓冲溶液,调节斜率旋钮使显示pH=4.0, 重复上述操作,直至显示值与标准缓冲溶液的pH一致为止。此时酸度计校正好了。
.2配制不同浓度的乙酸溶液
取干燥、洁净的100ml烧杯5只,编号1-5。在酸式滴定管中加
入已知浓度的乙酸溶液,在碱式滴定管中加入去离子水。按
下表依次向1-5号烧杯中加入一定体积的乙酸溶液和去离子水
编号 乙酸溶液的体积 / ml 去离子水
体积 / ml 混合后乙酸
浓度/(mol/L) 混合后溶液pH测定值 混合后溶液
c(H+) 乙酸电离
常数Ki
1 3.00 47.00
2 6.00 44.00
3 9.00 41.00
4 12.00 38.00
5 15.00 35.00
3.测定所配乙酸溶液的pH值:
利用酸度计依次测定所配乙酸溶液的pH值,并记录在上表中。分别计算出1-5号溶液的电离平衡常数Ki,取平均值即为乙酸溶液的电离平衡常数。
第二篇:实验六 电导法测定乙酸电离平衡 常数
实验六 电导法测定乙酸电离平衡常数
一、 实验目的
1、 掌握电导、电导率、摩尔电导率的概念以及他们之间的联系。
2、 掌握由电导法测定弱电解质电离平衡常熟的原理。
二.实验原理:
1.电离平衡常数Kc的测定原理
在弱电解质溶液中,只有已经电离的部分才能承担传递电量的任务。在无限稀释的溶液中可以认为弱电解质已全部电离,此时溶液的摩尔电导率为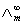 ,可以用离子的极限摩尔电导率相加而得。而一定浓度下电解质的摩尔电导率∧m与无限稀释的溶液的摩尔电导率
,可以用离子的极限摩尔电导率相加而得。而一定浓度下电解质的摩尔电导率∧m与无限稀释的溶液的摩尔电导率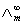 是有区别的,这由两个因素造成,一是电解质的不完全离解,二是离子间存在相互作用力。二者之间有如下近似关系:
是有区别的,这由两个因素造成,一是电解质的不完全离解,二是离子间存在相互作用力。二者之间有如下近似关系:
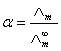 (1)
(1)
式中为弱电解质的电离度。
对AB型弱电解质,如乙酸(即醋酸),在溶液中电离达到平衡时,其电离平衡常数Kc与浓度c和电离度α的关系推导如下:
CH3COOH →CH3COO- + H+
起始浓度 c 0 0
平衡浓度 c(1-α) ca ca
则
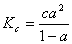 (2)
(2)
以式(1)代入上式得: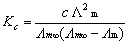 (3)
(3)
因此,只要知道∧m∞和∧m就可以算得该浓度下醋酸的电离常数Kc。
将式(2)整理后还可得:
 (4)
(4)
由上式可知,测定系列浓度下溶液的摩尔电导率∧m,将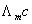 对1/Λm作图可得一条直线,由直线斜率可测出在一定浓度范围内
对1/Λm作图可得一条直线,由直线斜率可测出在一定浓度范围内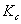 的平均值。
的平均值。
2.摩尔电导率∧m的测定原理
电导是电阻的倒数,用G表示,单位S(西门子)。电导率则为电阻率的倒数,用k表示,单位为G·m-1。
摩尔电导率的定义为:含有一摩尔电解质的溶液,全部置于相距为1m的两个电极之间,这时所具有的电导称为摩尔电导率。摩尔电导率与电导率之间有如下的关系。
∧m= κ/c (5)
式中c为溶液中物质的量浓度,单位为mol·m-3。
在电导池中,电导的大小与两极之间的距离l成反比,与电极的面积A成正比。
G = κA/ l (6)
由(6)式可得
κ=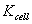 G (7)
G (7)
对于固定的电导池,l和A 是定值,故比值l/A为一常数,以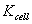 表示,称为电导池常数,单位为m-1。为了防止极化,通常将铂电极镀上一层铂黑,因此真实面积A无法直接测量,通常将已知电导率κ的电解质溶液(一般用的是标准的0.01000mol·L-1KCl溶液)注入电导池中,然后测定其电导G即可由(7)式算得电导池常数
表示,称为电导池常数,单位为m-1。为了防止极化,通常将铂电极镀上一层铂黑,因此真实面积A无法直接测量,通常将已知电导率κ的电解质溶液(一般用的是标准的0.01000mol·L-1KCl溶液)注入电导池中,然后测定其电导G即可由(7)式算得电导池常数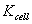 。
。
当电导池常数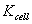 确定后,就可用该电导池测定某一浓度c的醋酸溶液的电导,再用(7)式算出κ,将c、κ值代入(5)式,可算得该浓度下醋酸溶液的摩尔电导率。
确定后,就可用该电导池测定某一浓度c的醋酸溶液的电导,再用(7)式算出κ,将c、κ值代入(5)式,可算得该浓度下醋酸溶液的摩尔电导率。
在这里的求测是一个重要问题,对于强电解质溶液可测定其在不同浓度下摩尔电导率再外推而求得,但对弱电解质溶液则不能用外推法,通常是将该弱电解质正、负两种离子的无限稀释摩尔电导率加和计算而得,即:
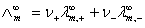 (8)
(8)
不同温度下醋酸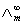 的值见表1。
的值见表1。
表2.5 不同温度下醋酸的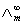 (S·m2·mol-1)
(S·m2·mol-1)

二、 实验器材
DDBJ-350便携式电导率仪,电导电极,恒温槽,烧杯、锥型瓶,移液管(25mL);
0.0200 mol·L-1  标准溶液,0.1779 mol·L-1
标准溶液,0.1779 mol·L-1 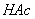 标准溶液
标准溶液
四、实验步骤
1、 调节恒温水槽水浴温度为25°C,将实验中要测定的溶液和一定量的蒸馏水恒温。
2、 校准便携式电导率仪的电导常数:量取一定量0.2mol/L的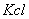 溶液于小烧杯中,并放置于恒温水槽中恒温至25°C。用滤纸将两电极擦拭干净并测出
溶液于小烧杯中,并放置于恒温水槽中恒温至25°C。用滤纸将两电极擦拭干净并测出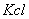 溶液的电导率;并与0.276s/m相比,若差很多,重新调节。
溶液的电导率;并与0.276s/m相比,若差很多,重新调节。
3、 测量醋酸溶液的电导率:
(1)、取50ml0.1779mol/L的醋酸溶液于小锥形瓶中并置于恒温水槽中至温度升到25°C,两电极洗净擦干,用电导率仪测出其电导率,每隔一两分钟测一次,测三次。
(2)、用移液管吸取锥形瓶中醋酸25ml,再加入25ml水稀释醋酸,并测其电导率。重复该操作,依次稀释四次。
(3)记录实验数据。
(4)将电导电极、温度传感器洗净,依然将电导电极泡在蒸馏水中。收拾好实验桌。
五、数据处理
实验温度: 25℃
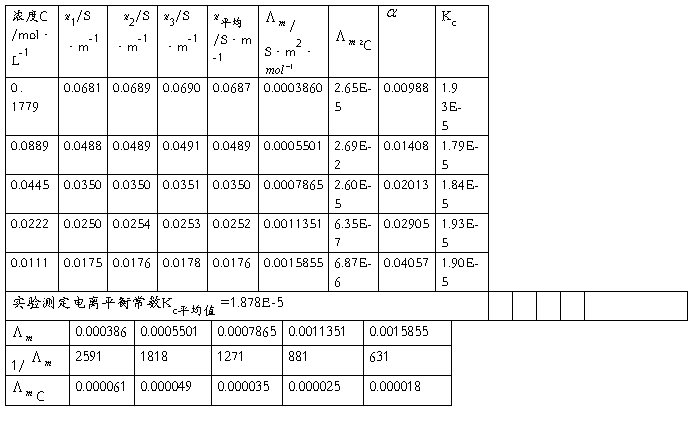
用 对1/∧m作图或进行线性回归,求出相应的斜率和截距,求出平均电离常数Kc
对1/∧m作图或进行线性回归,求出相应的斜率和截距,求出平均电离常数Kc
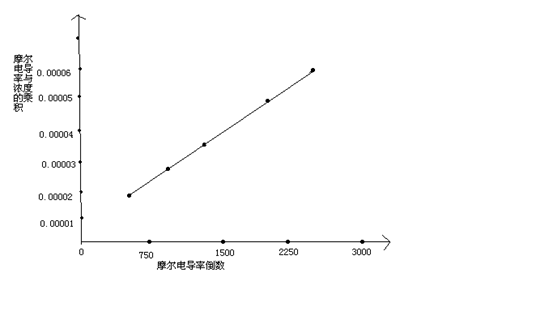
直线斜率为2.9×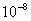 ,又因为斜率表示为
,又因为斜率表示为 所以可得:
所以可得: =2.9×
=2.9×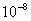 ,得
,得 =1.87×
=1.87×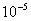
六、思考题:
1.电导池常数是否可用测量几何尺寸的方法确定?
答:不能。测定电导池常数可以用标准溶液测定法,用氯化钾为标准物质;还可以用与标准电极比较法测定。
2.实际过程中,若电导池常数发生改变,对平衡常数测定有何影响?
答:溶液电导一经测定,则?正比于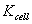 。即电导池常数测值偏大,则算得的溶液的溶解度、电离常数都偏大,反之,电导池常数测值偏小,则电离常数偏小。
。即电导池常数测值偏大,则算得的溶液的溶解度、电离常数都偏大,反之,电导池常数测值偏小,则电离常数偏小。
七、误差分析
1、所取溶液浓度的准确性。
2、读数过程中,温度是否达到25℃;读数间隔时间是否够。
3、稀释过程的准确性。
4、电导仪校准时也可能未达要求。
