新乡医学院 医用化学 实验课教案首页
授课教师姓名及职称:
新乡医学院化学教研室 年 月 日
实验 常压蒸馏及沸点测定
一、实验目的
1.了解沸点测定的原理及意义;
2.掌握常压蒸馏操作技术及沸点测定方法。
二、实验原理
沸点测定实际上是一个蒸馏操作。蒸馏是一个将物质蒸发、冷凝其蒸气,并将冷凝液收集在另一种容器中的操作过程。当混合物中各组分的沸点不同时,可用蒸馏的方法将它们分开,所以蒸馏是分离有机化合物的常用手段。蒸馏的方法主要有以下四种:常压蒸馏、减压蒸馏、分馏和水蒸气蒸馏。下面我们就简单介绍一下,实验室中最常用的常压蒸馏。
基本原理
液体的分子由于热运动有从液体表面逸出的倾向,这种倾向随着温度的升高而增大,进而在液面上部形成蒸气。如果把液体置于密闭的真空体系中,液体分子继续不断地逸出而在液面上部形成蒸气,最后使得分子由液体逸出的速度与分子由蒸气中回到液体中的速度相等,亦即使其蒸气保持一定的压力。此时液面上的蒸气达到饱和,称为饱和蒸气,它对液面所施加的压力称为饱和蒸气压,简称蒸气压。同一温度下,不同的液体具有不同的蒸气压,这是由液体的本性决定的,而且在温度和外压一定时都是常数。
将液体加热,它的饱和蒸气压就随着温度升高而增大。当液体的蒸气压增大到与外界施于液面上的总压力(通常为大气压力)相等时,就有大量气泡从液体内部逸出,即液体沸腾。这时的温度称为液体的沸点。显然沸点与外压大小有关。通常所说的沸点是指在101.3 kPa压力下液体的沸腾温度。例如水的沸点为100℃,就是指在101.3 kPa压力下,水在100℃时沸腾。在其它压力下的沸点应注明压力。例如在70 kPa时水在90℃沸腾,这时水的沸点可以表示为90℃/70 kPa。
所谓蒸馏就是将液体加热到沸腾变为蒸气,再将蒸气冷凝为液体这两个过程的联合操作。如将沸点差别较大(至少30℃以上)的液体蒸馏时,沸点较低者先蒸出,沸点较高的随后蒸出,不挥发的留在蒸馏瓶内,这样可达到分离和提纯的目的,故蒸馏为分离和提纯液态有机化合物常用的方法之一。但在蒸馏沸点比较接近的混合物时,各物质的蒸气将同时被蒸出,只不过低沸点的多一些,难以达到分离和提纯的目的,只能借助于分馏(见分馏部分)。在常压下进行蒸馏时,由于大气压往往不是恰好为101.3 kPa,因而严格说来应对观察到的沸点加以校正,但由于偏差一般都很小,即使大气压相差2.7 kPa,这项校正值也不过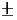 1℃左右,因此可忽略不计。
1℃左右,因此可忽略不计。
纯液态有机化合物在蒸馏过程中沸点范围(沸程)很小,为0.5~1℃,所以蒸馏可以用来测定沸点。用蒸馏法测定沸点叫常量法,此法样品用量较大,要10 mL以上。若样品不多,可采用微量法。纯的液态有机化合物在一定压力下具有一定的沸点,但具有固定沸点的液体不一定都是纯的化合物,因为某些有机化合物常和其它组分形成二元或三元共沸混合物,它们也有一定的沸点。
将盛有液体的烧瓶放在石棉网上进行加热时,在液体底部和玻璃受热的接触面上就有蒸气气泡形成。溶解在液体内部的空气或以薄膜形式吸附在瓶壁上的空气有助于这种气泡的形成,玻璃的粗糙面也起促进作用,这种小气泡(称为气化中心)即可作为大的蒸气气泡的核心。在沸点时,液体释放出大量蒸气至小气泡中,待气泡中的总压力增加到超过大气压,并足以克服液柱所产生的压力时,蒸气的气泡就上升逸出液面。因此,如在液体中有许多小空气泡或其它气化中心时,液体就可平稳地沸腾。如果液体中几乎不存在空气,瓶壁又非常洁净和光滑,形成气泡就非常困难。这样加热时,液体温度可能上升到超过沸点很多而不沸腾,这种现象称为“过热”。一旦有一个气泡形成,由于液体在此温度时的蒸气压已远远超过大气压和液柱压力之和,因此上升的气泡增大得非常快,甚至将液体冲溢出瓶外,这种现象称为“暴沸”。
为了消除在蒸馏过程中的过热现象,保证沸腾的平稳进行,常加入素烧瓷片或沸石,或一端封口的毛细管,它们都能形成气化中心,防止过热时出现暴沸现象,故把它们叫做助沸物。但要注意,助沸物应在加热前加入。当加热后发现未加助沸物或原有的助沸物失效时,千万不能匆忙加入,应先移去热源,待液体冷至沸点以下再补加。因为在液体沸腾时投入助沸物,会引起剧烈暴沸,液体易冲出瓶外发生危险。如中途停止蒸馏,切记在再次加热前补加新的助沸物。
蒸馏操作是实验室中常用的实验技术,一般用于下列几方面:
a.分离液体混合物,仅对混合物中各成分的沸点有较大差别(如30℃以上)时才能有效地进行分离。b.测定化合物的沸点(常量法)。c.提纯液体及低熔点固体,以除去不挥发性的杂质。d.回收溶剂,或蒸出部分溶剂以浓缩溶液。
三、实验用品
圆底烧瓶(50 mL、100 mL)、直形冷凝管、蒸馏头、空气冷凝管、玻璃漏斗、量筒、温度计、真空接液管、酒精灯、三角瓶、工业乙醇、溴苯
四、实验步骤
1.蒸馏装置及安装:实验室常用的蒸馏装置(见图3-5)主要有下列三部分组成:
a.蒸馏烧瓶:蒸馏瓶一般为带支管的圆底烧瓶或圆底烧瓶,为加热容器。液体在瓶内受热气化,蒸气经支管进入冷凝管。b.冷凝管:冷凝管的作用是将蒸气冷凝为液体。冷凝管有空气冷凝管和水冷凝管两种。液体沸点高于140℃的用空气冷凝管;低于140℃的用水冷凝管。冷凝管的形状很多,常用的为直形冷凝管和球形冷凝管,冷凝管下端为进水口,用橡皮管接自来水龙头,上端为出水口,套上橡皮管引入水槽中。上端出水口应向上,以保证套管内充满水。c.接受器:由接液管和接受瓶(锥形瓶或圆底烧瓶)组成。两者不可用塞子塞紧,应与大气相通。
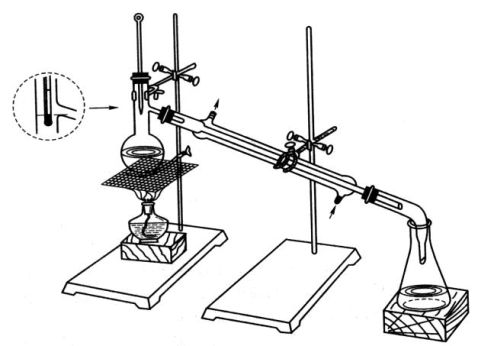
常压蒸馏装置图
仪器安装前,首先要根据蒸馏物的量,选择大小合适的蒸馏瓶,一般是使蒸馏物液体的体积不超过蒸馏瓶容积的2/3,也不少于1/3。仪器的安装顺序应先从热源开始,自下而上,从左到右,依次安放铁圈或三脚架、石棉网,然后安装蒸馏瓶。注意瓶底应距石棉网1~2 mm,不要触及石棉网。蒸馏瓶用铁夹垂直夹好。安装冷凝管时应先调整好它的位置,使其与蒸馏瓶支管同轴,然后再松开固定冷凝管的铁夹,使冷凝管沿此轴移动与蒸馏瓶连接。铁夹不应夹得太紧或太松,以夹好后稍用力尚能转动为宜。在冷凝管尾部通过接液管连接接受瓶。整套装置安装好后应紧密不漏气和端正,不论从侧面或背面看去,各个仪器的中心线都要在一条直线上。所有铁夹和铁架台应尽可能整齐地放在仪器的背部。
2.蒸馏操作及沸点测定
加料:将待蒸馏液通过玻璃漏斗(或取下蒸馏瓶)小心倒入蒸馏瓶中,要注意不使液体从支管流出,加入2~3粒沸石或其它助沸物,塞好带温度计的塞子,将仪器固定好。
加热:用水冷凝管时,开启冷却水后进行加热,液体沸腾后,便可观察到蒸气逐渐上升,当上升到温度计水银球周围时,温度计汞线急剧上升,这时应适当调整热源,使加热速度减慢,控制蒸馏速度以1~2滴/秒为宜。在整个蒸馏过程中,应使温度计水银球上经常有被冷凝的液滴,此时的温度即为液体与蒸气平衡时的温度,温度计的读数就是液体(馏出液)的沸点。另外,在蒸馏过程中,一定要控制好馏速,否则,热源太强,馏速过快会出现过热现象,使沸点偏高;反之,馏速过慢,温度计水银球不能被蒸气充分浸润而使读得的沸点偏低或不规则。
观察沸点及收集馏液:在蒸馏前,至少要准备两个接受瓶。因为在达到所需要物质的沸点前,常有沸点较低的液体先蒸出,这部分馏液称为“馏头”或“前馏分”。前馏分蒸完,温度趋于稳定后,蒸出的即为较纯的物质,这时应更换另一个洁净干燥的接受瓶,并记下这部分液体开始馏出时和最后一滴时温度计的读数,为该馏分的沸程(沸点范围)。如待蒸馏液中含有高沸点杂质,再继续加热时,温度计读数会显著升高;若维持原来的加热温度,就不会再有馏液蒸出,温度会突然下降,这时应停止蒸馏。但要注意,无论蒸馏何种液体都不允许蒸干,至少要在留1 mL左右的液体时停止加热,以免蒸馏瓶破裂或发生其它意外事故。
3.蒸馏完毕,应先停火,再停冷凝水,然后按与安装时相反的顺序拆卸。
在100 mL圆底烧瓶中加入40 mL工业乙醇。加料时用玻璃漏斗将蒸馏液体小心倒入,注意勿使液体从支管流出。加入2~3粒沸石,塞好带有温度计的塞子,通入冷凝水,调节中等流速,按适当的方法加热,当液体开始沸腾、蒸气到达温度计水银球时,温度计读数急剧上升,这时应调节加热速度,控制蒸馏速度1~2滴/秒。当温度计读数恒定时,更换接受瓶,观察并记录馏出温度。继续蒸馏,定期记录馏出温度直至蒸馏瓶内仅剩1~2 mL液体,若维持原来的加热速度,温度计读数会突然下降,即可停止蒸馏。不应将瓶内液体完全蒸干。观察、记录工业乙醇沸程,记下馏出液的体积。
五、思考题
1.蒸馏时为什么蒸馏瓶所盛液体的量不应超过容积的2/3也不应少于1/3?
2.蒸馏时,如果温度计水银球超过蒸馏瓶支管口上缘,将会对结果造成什么影响?
3.为什么用蒸馏法测沸点时要加入少许沸石?多加沸石有什么影响?
4.当加热后有馏液出来时,才发现冷凝管未通水,应如何处理?为什么?
第二篇:蒸馏及沸点的测定
蒸馏及沸点的测定
一实验目的:
1, 掌握蒸馏的原理及方法。
2, 了解测定沸点的意义,
3, 掌握蒸馏发测定沸点的原理及方法。
二,实验原理
液体化合物在一定的温度下具有一定的蒸汽压,将液体加热,它的蒸汽压随着温度的升高而增大,当液体的蒸汽压增大到外界施与液面的总压力时(通常指大气压)相等时,就有大量气泡从液体内部溢出,即液体沸腾,这时的温度称为液体的沸点。
蒸馏就是将该液态物质加热到沸腾变为蒸汽。又将蒸汽冷却为液体这两个过程的联合操作。纯液态有机物在蒸馏过程中沸点范围很小(0.5-1摄氏度),所以可以利用蒸馏来测定沸点,蒸馏时分离和提纯液体有机物(沸点相差30摄氏度以上)最常用的方法之一。
三,仪器的安装
从左到右,从上到下。
四,实验步骤
1, 量取50ml工业酒精倒入蒸馏瓶内,加两粒沸石。安装好蒸馏装置,检查装置无误后,开始加热。
2, 加热到液体沸腾,观察温度计水银柱的上升。调节加热速度,使蒸馏不是立即沸腾冲出冷凝管,而是冷凝回流,水银球上保持有液滴。控制加热温度,使蒸馏液滴以每秒1-2滴为宜。
3, 温度上升,有沸点较低的液体先蒸出,用接收器收集前馏分。
4, 前馏分蒸完后,当温度计读数稳定时,另换接收器收取馏分。此时温度计的读数为该物质的沸点。纪录这部分液体开始流出时和最后一滴的温度,即是该馏分的沸程。
5, 瓶内只剩少量液体时,温度值不变,温度计读数会突然下降,即可停止蒸馏。
6, 蒸馏完毕,应先停止加热,关水,拆除装置的次序与安装时相反。
7, 将产品倒入量筒,计算产率。
五,蒸馏五十毫升工业乙醇,计算产率。
蒸馏装置:



