粘 度 法 测 定 高 聚 物 相 对 分 子 质 量
一. 实验目的
1. 掌握用乌氏粘度计测定高聚物溶液粘度的原理和方法。
2. 测定线型聚合物聚乙二醇的粘均相对分子质量。
二. 实验原理
聚合物的相对分子质量是一个统计的平均值。粘度法测定高聚物相对分子质量适用
的相对分子质量范围为1×104~1×107,方法类型属于相对法。
粘性液体在流动过程中所受阻力的大小可用粘度系数来表示。粘度分绝对粘度和
相对粘度。绝对粘度有两种表示方法:动力粘度和运动粘度。相对粘度是某液体粘度
与标准液体粘度之比。
溶液粘度与纯溶剂粘度的比值称作相对粘度ηr,即ηr=η/ηo,相对于溶剂,溶液
粘度增加的分数称为增比粘度,ηsp=ηr-1。
使用同一粘度计,在足够稀的聚合物溶液里,ηr=η/ηo=t/to,只要测定溶液和溶
剂在毛细管中的流出时间就可得到ηr;同时,在足够稀的溶液里,质量浓度c,ηr和[η]
之间符合经验公式:(lnηr)/c=[η]-β[η]2c,通过lnηr/c对c作图,外推至c=0时所
得截距即为[η];同时,在足够稀的溶液里,质量浓度c,ηsp和[η]之间符合经验公式:
ηsp/c=[η]+k[η]2c,通过ηsp/c对c作图,外推至c=0时所得截距即为[η]。两个线性
方程作图得到的截距应该在同一点。
聚合物溶液的特性粘度[η]与聚合物相对分子质量之间的关系,可以通过Mark—
—Houwink经验方程来计算,[η]=KMηα;Mη是粘均相对分子质量,K、α是与温度、
聚合物及溶剂的性质相关的常数;聚乙二醇水溶液在30℃的K值为12.5×106/m3·kg-1,
α值为0.78。
通过以上的原理阐述,就可以通过本次实验测定高聚物的粘均相对分子质量。
三. 实验仪器和试剂
仪器:恒温槽1套;乌氏粘度计1支;100ml容量瓶5只;秒表1只。
试剂:聚乙二醇(AR);去离子水。
四. 实验步骤
1. 设定恒温槽温度为30℃±0.5℃。
2. 配制溶液。8%(质量分数)的聚乙二醇溶液5ml、10ml、15ml、20ml、25ml定容于100ml容量瓶中。
3. 洗涤粘度计。
4. 测定溶剂流出时间to,测定不同浓度的溶液流出时间t。
五. 数据记录与处理
实验室室温:28.5℃ 大气压:101.52Kpa
to:纯溶剂在a、b线移动所需时间;
t1:5ml8%聚乙二醇溶液定容于100ml容量瓶中溶液在a、b线移动所需时间;
t2:10ml8%聚乙二醇溶液定容于100ml容量瓶中溶液在a、b线移动所需时间;
t3:15ml8%聚乙二醇溶液定容于100ml容量瓶中溶液在a、b线移动所需时间;
t4:20ml8%聚乙二醇溶液定容于100ml容量瓶中溶液在a、b线移动所需时间;
t5:25ml8%聚乙二醇溶液定容于100ml容量瓶中溶液在a、b线移动所需时间;
所有溶液的密度以1×103kg/m3的水的标准密度,以简化计算。
以下数据表格为excel处理结果
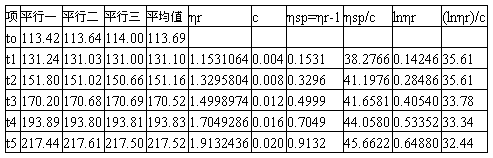
在origin中,ηsp/c对c作图
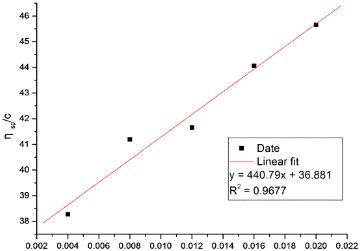
在origin中,(lnηr)/c对c作图

[η]的平均值为(36.881+36.742)/2=36.8115, 粘均分子质量为39937
乌氏粘度计参数为:
检定温度:20℃
毛细管内径:0.5~0.6mm
粘度计常数:0.007176mm2/s2
六. 实验结果与讨论
测定粘度的过程对温度的恒定要求很高。测定去离子水的时间to时,由于恒温时间
不够,各个数据之间的平行性不好,而后的各个t的平行性因为恒温时间都很长,所以相对去离子水的数据就好很多了。可见,粘度对温度的变化是非常灵敏的。
另外,乌氏粘度计中在a、b线间如果有气泡,对实验数据也有很大的影响。虽然没有搞清楚到底是增大粘度还是减少粘度,但无疑,t2受到气泡的影响使数据之间的平行性受到了很大的影响。赶气泡效果最好的方法是把所有的液体都先赶下去再吸上来。吸的过程中乌氏粘度计的c管当然是要堵住的。
第二篇:物化实验报告_实验B偶极矩的测定
实验B 偶极矩的测定
摘 要:本实验通过测定正丁醇的环己烷溶液折射率的测定可以计算出溶液的偶极距,根据介电常数和密度随浓度的变化,利用外推法确定线性关系系数,从而求得正丁醇的固有偶极矩大小。
关键词:正丁醇 极化度 偶极距 折射率 介质常数
The determination of dipole moment
Abstract: In this experiment,we determine the refractive indexes,dielectricconstants and density of 1-butyl alcohol and cyclohexane solution under different concentrations.The data are processed to resolve the linear relation constant by using extrepolation, and then we can get the intrinsic dipole moment of 1-butyl alcohol.
Keywords:1-Butyl alcohol,Polarizability,Dipole moment,Refractive index,Dielectric constant
1. 前言
偶极矩是一个向量,方向规定从负电荷指向正电荷——注意,以前化学上曾经约定为相反的方向,但是现在与物理学采用了一致的约定“从负到正”!电偶极矩的SI制单位为C·m,微观物理学中常用的单位为“德拜Debye”,1Debye=3.336E-30C·m。
分子的正负电荷中心不重合,可以是这一分子在无外界电场作用下就能表现出的固有属性——此时它被称为“极性分子”;也可以是正负电荷中心原本重合的“非极性分子”,在外电场作用下发生了正负电荷中心的相互分离。因此偶极矩大小定量的表现出分子当前极性程度的大小,本实验就是要测定极性分子正丁醇的固有偶极矩大小。
电介质分子处于电场中,电场会使非极性分子的正负电荷中心发生相对位移而变得不重合;电场也会使极性分子的正负电荷中心间距增大,这样会使分子产生附加的偶极矩(诱导偶极矩)。这种现象称为分子的变形极化,可以用平均诱导偶极矩m来表示变形极化的程度。在中等强度的电场下设m=αDE内式中E内为作用于个别分子上的强场,αD为变形极化率。
因为变形极化产生于两种因素:分子中电子相对于核的移动和原子核间的微小移动,所以有αD=αE+αA式中αE、αA分别称为电子极化率和原子极化率。设n为单位体积中分子的个数,根据体积极化的定义(单位体积中分子的偶极矩之矢量和)有
P=nm=nαDE内
为了计算E内,考虑匀强电场中分子受到的静电力:维持匀强电场的电荷σ所产生的力F1,电介质极
化产生的感生电荷σ’产生的力F2,单个分子周围的微小空隙界面上的感生电荷产生的力F3,各分子间的相互作用F4 (忽略)
E内=E1+E2+E3=4πσ+4πP+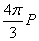 =E+
=E+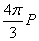 式中σ为极板表面电荷密度。
式中σ为极板表面电荷密度。
平行板电容器内电量为定值的条件下:ε=C/C0=E0/E ,式中ε,C分别为电介质的介电常数和电容器的电容;脚标0对应于真空条件下的数值
因为 E=4πσ-4πσ’=E0-4πσ’
又 E0=εE
可得  式中σ’为感生电荷的面电荷密度。
式中σ’为感生电荷的面电荷密度。
体积极化的等价定义为“单位立方体上下表面的电荷σ’与其间距的积”,所以
P=1×σ’=σ’
因此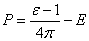 ,即
,即
可得E内=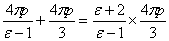
P=nαDE内=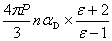 ,即
,即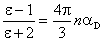
上式两边同乘分子量M和同除以介质的密度ρ,并注意到nM/ρ=N0,即得
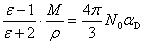 这就是Clausius-Mosotti方程。
这就是Clausius-Mosotti方程。
定义“摩尔变形极化度”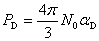
电场中的分子除了变形极化外还会产生取向极化,即具有固有偶极矩的分子在电场的作用下,会或多或少地转向电场方向。设它对极化率的贡献为PO,总摩尔极化度为P=PD+PO=PE+PA+PO,式中PE、PA、PO分别为摩尔电子极化度,
摩尔原子极化度和摩尔取向极化度
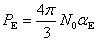 ,
,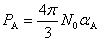
由玻尔兹曼分布定律可得:
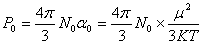 式中μ为极性分子的固有偶极矩,
式中μ为极性分子的固有偶极矩,
K为玻尔兹曼常数,T为绝对温度
最后得到
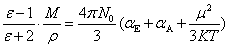 此式称为Clausius-Mosotti-Debye方程。
此式称为Clausius-Mosotti-Debye方程。
将电介质置于交变电场中时,其极化情况和电场变化的频率有关,交变电场的频率小于1010Hz时,极性分子的摩尔极化度P中包含了电子、原子和取向的贡献。若P=PE则ε=n2,n为介质的折射率,这时的摩尔极化度称为摩尔折射度R:
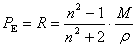
因为PA只有PE的10%左右,一般可以略去,或按PE的10%修正。
由
略去PA则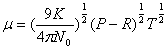 ,代入常数值得
,代入常数值得
由计算E内忽略了分子间相互作用项F4,故需用无限稀的P∞、R∞,也即

所以我们在实验中要测不同浓度下的P、R,再用外推法求P∞和R∞。
由溶剂1和溶剂2组成的溶液体系,在浓度不很高时,其介电常数、折射率、摩尔极化度以及密度均和浓度成线性关系,即:
ε=ε1(1+αX2)
n=n1(1+γX2)
P=X1P1+X2P2
ρ=ρ1(1+βX2)
式中X1、X2分别为溶剂和溶质的摩尔分数,ε、ρ、P、n;ε1、ρ1、P1、n1;ε2、ρ2、P2、n2分别为溶液、溶剂和溶质的介质常数、密度、摩尔极化度和折射率,α、β、γ为常数。由此可得:
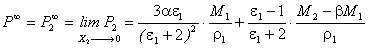
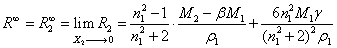
这样我们可用交变频率为1000Hz的交流电桥,测量电容池中各浓度下溶液的电容,用此电容除以真空(代之以空气)下电容池的电容即得介电常数ε;用阿贝折射仪测出可见光下各溶液的折射率n;再用比重瓶和电子天平测出各溶液的密度ρ。由此三组数据作拟合可定出α、β、γ,再代入上两式算出P∞和R∞,最后算出分子的固有偶极矩μ。
2. 实验部分
2.1 仪器与试剂
阿贝折射仪一台;CCJ-1型精密电容测量仪一台;电子天平一台;超级恒温槽一台;
干燥器一只;容量瓶(25毫升)6只;电吹风一只;比重瓶1只;电容池1只。
正丁醇(分析纯) 74.12 g/mol 环已烷(分析纯) 84.16 g/mol
2.2 实验步骤
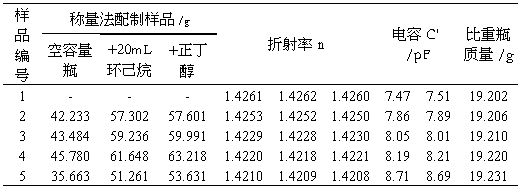
1) 配制正丁醇的环己烷溶液:对2~4号容量瓶分别称重;各加入20mL环己烷后再分别称重(1号也加,但不称重);依次加入0.5mL、1mL、2mL、3mL正丁醇,再次分别称重。注意随时盖好容量瓶的瓶塞;最后溶液要摇匀。
2) 测定各溶液的折射率:用阿贝折光仪测量1~5号溶液的折射率,每种溶液测量三次。
3) 测定各溶液为电介质时的电容:先测定以空气(拟真空)为电介质时电容池的电容C0’;再依次换用1~5号溶液作电介质,测定电容池的电容。每组电容数据测定两次;注意更换溶液时电容池和电极要清理干净。
4) 测定各溶液的密度:用比重瓶测定1~5号溶液的密度。使用比重瓶时不要用手直接拿取。
3.结果与讨论
3.1 实验结果
正丁醇的固有偶极矩大小μ =1.58 Debye
与文献值1.66 Debye比较,相对误差4.8%
3.2 误差分析
①用比重瓶和电子天平测密度的误差较大:正丁醇的环己烷溶液有较强的挥发性,装入比重瓶后,如果仔细的慢慢擦拭瓶口附近溢出的溶液,则毛细管上端的液柱总是会回缩产生一段空气柱。这段空气柱必然带来较大的误差,但是溢出的溶液又不能不擦净,否则也同样会带来较大误差。
②恒温水浴的温度与室温:本实验中,电容、折射率的数据是在恒温水浴的温度下进行测量的;而配制溶液、测量密度是在接近室温的条件下进行的;最后我选择的水的密度以及温度变量T均为恒温水浴温度下相应的值。这就要求恒温水浴温度尽量接近室温,本实验数据与文献值之间误差的来源也应该在此。
③本实验测得的溶质的偶极矩和气相测得值之间存在一定偏差,其原因主要在于溶液中溶
质分子和溶剂分子以及溶剂和溶质各分子间相互作用的溶剂效应。
④实验中在使用阿贝折射仪测量时的估读误差大小对结果的准确性有显著影响。因此,使
视野清晰,色散影响减小对结果至关重要,但由于人的视觉分辨率的限制,估读误差是不可
避免的,所以会对结果产生一定影响。通过多次测量求平均值可减小偶然误差。
⑤ 正丁醇和环己烷本身极易挥发,在实验中,尽管及时加盖,防止挥发,但仍会有一定
的挥发量,会产生误差。
参考文献:
[1] 崔献英,柯燕雄,单绍纯.物理化学实验[M].中国科技大学出版社,2000: 29~32.
[2] 付献彩,沈文霞,姚天扬,侯文华.《物理化学》(第五版)上册[M].高等教育出版社,2005:277~280.
附件:实验数据处理
1. 数据记录
T:19.0℃
空气电容:5.36 5.34(pF)
空瓶质量:11.341 g
加水质量:21.457 g
Table1
2. 数据处理
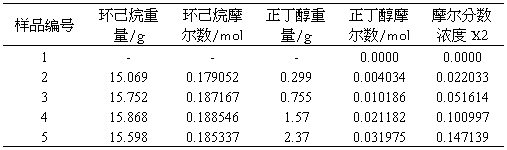
2.1 计算各溶液的摩尔分数浓度
Table 2
2.2 计算各浓度溶液的折射率求参数γ
Table 3
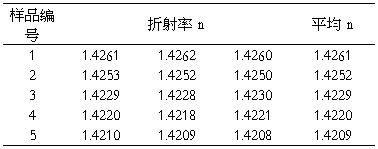
Table 4

Fig 1
Parameter Value Error
------------------------------------------------------------
A 1.42567 4.70691E-4
B -0.0351 0.00563
------------------------------------------------------------
R SD N P
-----------------------------------------------------------
-0.96356 6.72539E-4 5 0.0083
k= -0.0351
b=1.42567= n1
γ= k / b=-0.0351/1.42567=-0.0246
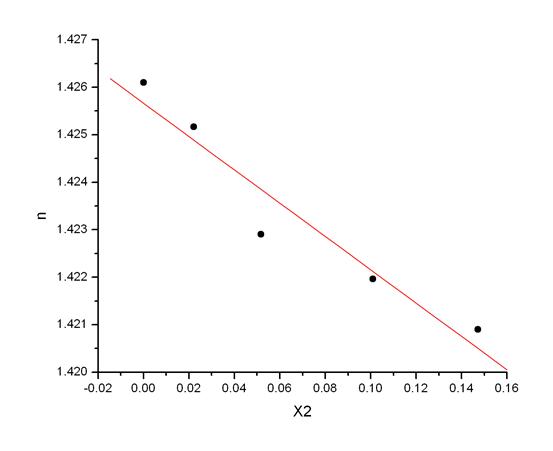
2.3 由各浓度溶液做电介质时电容池的电容求参数α
根据公式:
ε环= C环/ Co = 2.023-0.0016 ( t-20 )
C′环= C环+ Cd
Co= Co+ Cd
可得:
C环/ Co = 2.023-0.0016 ( t-20 )= 2.023-0.0016 ( 19-20 )=2.0246
8.70= C环+ Cd
5.35=Co+ Cd
联立解得:Co=3.27
Table 5

Table 6

Fig 2
Parameter Value Error
------------------------------------------------------------
A 1.32267 0.02672
B 2.20422 0.31942
------------------------------------------------------------
R SD N P
------------------------------------------------------------
0.96991 0.03819 5 0.00624
k= 2.20422
b= 1.32267=ε1
α= k / b= 1.6664
2.4由各浓度溶液的密度求参数β
根据公式: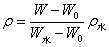 ,其中W是加溶液的容量瓶质量,W水是加水的容量瓶质量,W0是空容量瓶质量
,其中W是加溶液的容量瓶质量,W水是加水的容量瓶质量,W0是空容量瓶质量
W水=21.457
W0 =11.341
水的密度为0.99843 g/cm3。
可得密度如下表所示
Table 7

Table 8
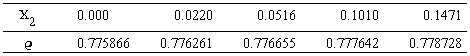
Fig 3
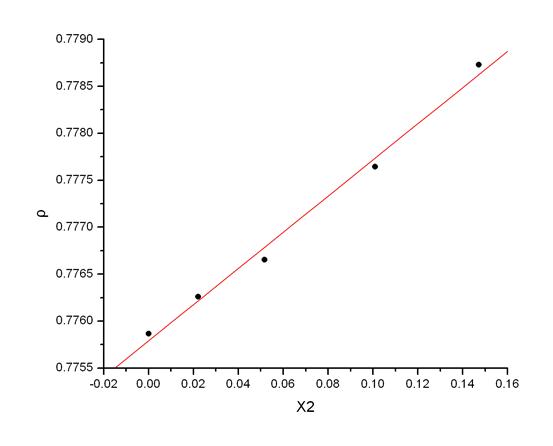
Parameter Value Error
------------------------------------------------------------
A 0.77579 8.46693E-5
B 0.01926 0.00101
------------------------------------------------------------
R SD N P
------------------------------------------------------------
0.99589 1.20978E-4 5 3.16679E-4
------------------------------------------------------------
k= 0.01926
b= 0.77579 =ρ1
β= k / b= 0.0248
2.5 计算P∞、R∞和固有偶极矩μ
已经求得α、β、γ,n1、ε1、ρ1,M1、M2、T各参数,其值分别为:
α=1.6664,β=0.0248,γ=-0.0246;
n1=1.42567,ε1= 1.32267,ρ1=0.77579;
M1=84.16,M2=74.12,T=292.15
 =73.991
=73.991
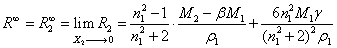 =21.773
=21.773
 =1.58 Debye
=1.58 Debye
与测得结果1.71 Debye比较,实验相对误差为
(1.66-1.58)/1.66*100%=4.8%
