药品稳定性考察方案
1.考察目的
药品的稳定性是指原料药及其制剂保持其物理、化学、生物学和微生物学性质的能力。考察药物制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期。
2.考察范围
适用于公司所有成品及原液的考察。药品稳定性考察包括:加速试验和长期(持续)稳定性试验。长期(持续)稳定性考察主要针对市售包装产品,但也需兼顾待包装产品。例如,当待包装产品在完成包装前,还需要长期贮存时,应当在相应环境条件下,评估其对包装后产品稳定性的影响。此外,还应考虑到对贮存时间较长的中间产品进行考察。加速试验主要针对批量放大及上市后变更(如生产设备变更、原辅料变更、工艺调整等)时生产的产品的稳定性试验。
3.考察依据
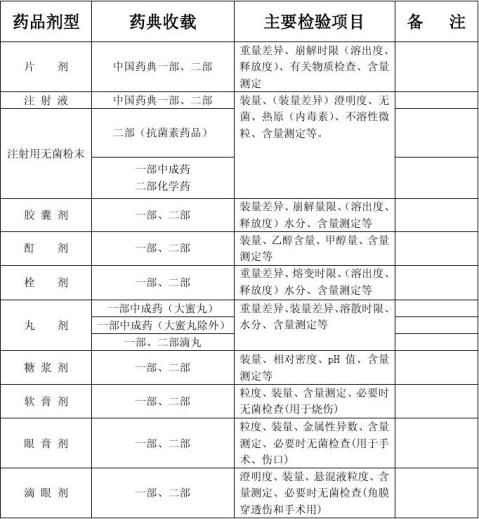
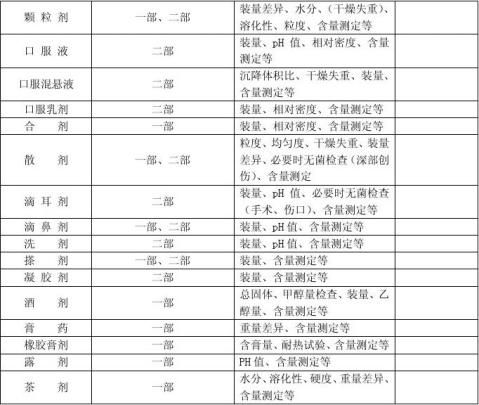
依据《中国药典》2010版二部附录中《原料药与药物制剂稳定性试验指导原则》进行确认。
4.职责
质保部部长负责稳定性考察方案与报告的起草。
质控部人员按照该方案完成实验并报告检验结果。
质保部部长负责检验结果的汇总。
质保部部长负责稳定性考察方案、检验结果、报告的审核。
质量授权人负责稳定性考察方案及报告的批准。
5.产品介绍(将做稳定性考察产品的介绍填在附表)
内容:产品名称、代码、考察方法、批号、规格、包装规格、考察数量、生产数量、有效期至
6.考察方法
6.1加速试验
此项实验在加速条件下进行,目的是通过加速药物制剂的化学或物理变化,探讨药物制剂的稳定性,为药品审评、包装、运输及贮存提供必要的资料。
…… …… 余下全文