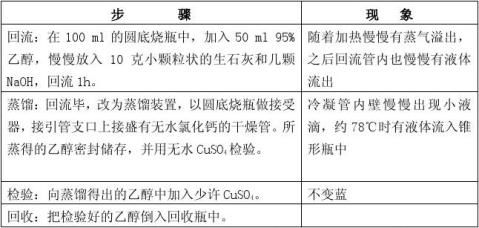
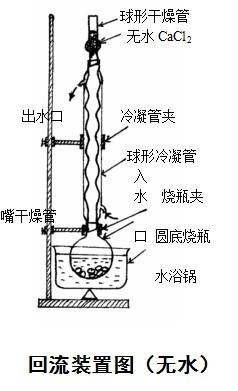
实验四 醇和酚的性质及塞子的打孔
一.实验目的
 1.进一步认识醇类的一般性质。
1.进一步认识醇类的一般性质。
2.比较醇和酚化学性质上的差别。
3.认识羟基和烃基的互相影响。
4.学会实验室常用塞子的打孔。
二.实验仪器与药品
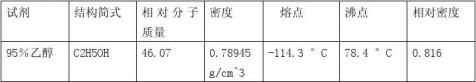
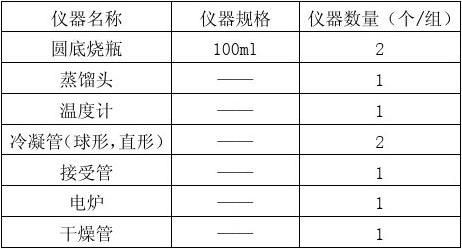
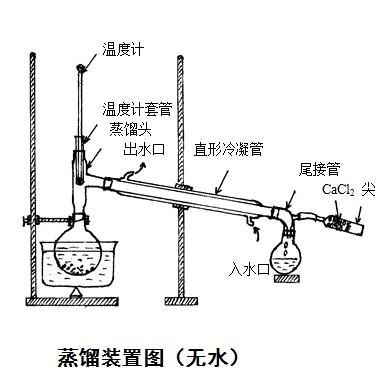
试管,胶头滴管,烧杯,打孔器,镊子,表面皿,玻璃棒,量筒;[P1]
三.实验步骤
1.醇的性质
(1)比较醇的同系物在水中的溶解度
四支试管中加入2 mL水,一支做空白对照,其余三支分别加入乙醇、丁醇、辛醇各10滴,振荡观察溶解情况。
(2)醇钠的生成及水解
在一干燥的试管加入1 mL无水乙醇,投入1小粒钠,观察现象,检验气体,待金属钠完全消失后,向试管中加入2滴酚酞指示剂,观察现象。
(3)醇与Lucas试剂的作用
在3支干燥的试管中,分别加入0.5 mL正丁醇,仲丁醇、叔丁醇、再加入2 mL Lucas试剂,振荡,保持26-27 ℃,观察5 min混合物变化。
(4)醇的氧化
 在试管中加入1 mL乙醇,滴入1% KMnO4 2滴,振荡,微热,观察现象。以仲丁醇和叔丁醇作同样实验,观察现象。
在试管中加入1 mL乙醇,滴入1% KMnO4 2滴,振荡,微热,观察现象。以仲丁醇和叔丁醇作同样实验,观察现象。
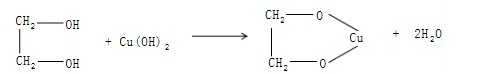
(5)多元醇与Cu(OH)2作用
用6 mL 5% NaOH及10滴10% CuSO4,配制成新鲜的Cu(OH)2,分在两个试管,分别加入乙二醇、甘油,观察现象。
2.酚的性质
(1)苯酚的酸性
取广泛试纸一条,放在表面皿上,用玻璃棒沾取一滴苯酚溶液于pH试纸上,观察现象。
(2)苯酚的氧化
取苯酚、苯、甲苯溶液各3 mL,置于3支干试管中,苯酚中加5% Na2CO3 0.5 mL及1% KMnO4 2滴,振荡,苯和甲苯中加入1% KMnO4 2滴,观察现象。
(3)苯酚与FeCl3作用
取苯酚溶液1 mL,放入试管中,加入几滴FeCl3溶液,观察颜色变化。
3.塞子的打孔
…… …… 余下全文