大学化学实验 报告本 (一)
姓名: 实验室: 周次: 周一 实验柜台: 61 指导老师: 章文伟
硫酸亚铁铵的制备
一.实验目的
1. 学会利用溶解度的差异制备硫酸亚铁铵。
2. 从实验中掌握硫酸亚铁、硫酸亚铁铵复盐的性质
3. 掌握水浴、减压过滤等基本操作
4. 学习pH试纸、吸管、比色管的使用
5. 学习用目测比色法检验产品质量。
二.原理
铁屑溶于稀硫酸生成硫酸铁。硫酸铁与硫酸铵作用生成溶解度较小的硫酸亚铁铵。
三.仪器及药品
洗瓶、250ml烧杯、10ml量筒、50ml量筒、吸滤瓶、比色管、铁粉、盐酸2mol/L、3mol/L硫酸、
四.实验步骤
1. 硫酸亚铁制备

2.
3. 硫酸亚铁铵的制备


Fe3+的限量分析








五.记录
1. 实验现象:
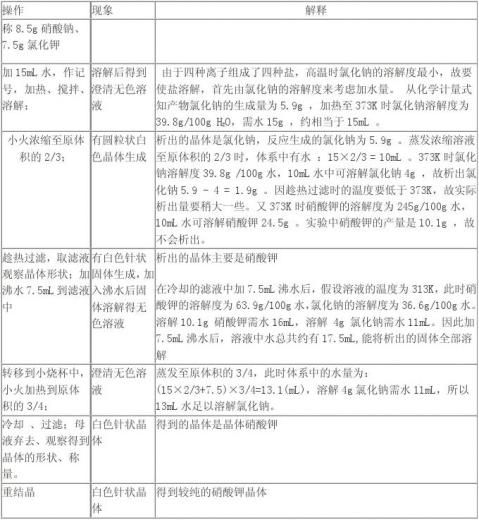
① 小火加热硝酸钠和氯化钾混合溶液过程中,烧杯内会有氯化钠晶体析出。
② 热过滤后,漏斗滤纸上出现氯化钠白色晶体。
③ 滤瓶内液温降低后,出现白色针状的硝酸钾晶体。
④ 硝酸钾溶液加热浓缩后静置,降至室温出现较多的硝酸钾晶体。
⑤ 抽滤后漏斗上出现干燥的硝酸钾晶体。
2. 产量:粗产品:2.78g
3. 理论产量:
KCl+NaNO3===K NO3+NaCl
m (K NO3) =(8.5*101.1)/85=10.1g
4. 产率:2.78/10.1=27.5%
六.思考题
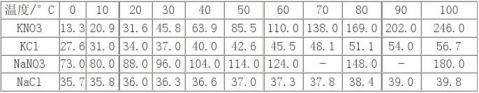
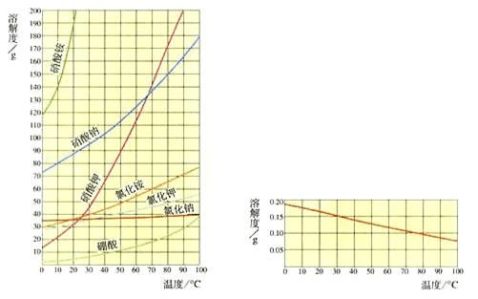
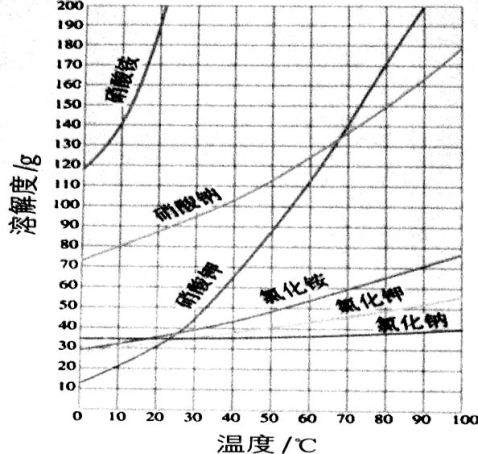
1. 怎样利用溶解度差别从氯化钾—硝酸钠制备硝酸钾?
当硝酸钠和氯化钾溶液混合时,溶液中会有硝酸钾、氯化钠、硝酸钠和氯化钾四种盐。在不同温度下它们在水中溶解度不同,特别是在较高温度,硝酸钾在水中的溶解度比氯化钠的要大得多,所以在冷却过程中氯化钠首先析出,趁热过滤后滤液中即含有硝酸钾。
…… …… 余下全文

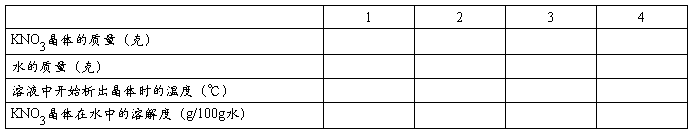
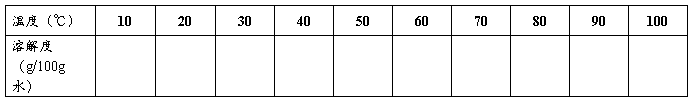
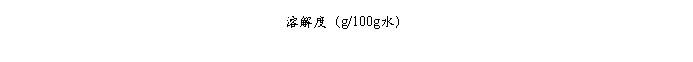


 硝酸钾的溶解度曲线(实验值 ,理论值 )
硝酸钾的溶解度曲线(实验值 ,理论值 ) 的基本原理和操作技术;
的基本原理和操作技术;