实验一 双缩脲法测定血清蛋白质含量
【实验名称】:双缩脲法测定血清蛋白质含量
室温:20°
(一)实验目的: 1.掌握双缩脲法测定蛋白质的原理。2.学习掌握分光光度计的使用。
3.掌握标准曲线的制作。4.学习分光光度法测定的原理和方法。
(二)实验原理:血清中蛋白质的肽键(-CO-NH-)在碱性溶液中能与2价铜离子作用生成稳定的紫红色络合物。此反应和两个尿素分子缩合后生成的双缩脲(H2N-OC-NH-CO-NH2)在碱性溶液中与铜离子作用形成紫红色的反应相似,故称之为双缩脲反应。这种紫红色络合物在540nm处有明显吸收峰,吸光度在一定范围内与血清蛋白含量呈正比关系,经与同样处理的蛋白质标准液比较,即可求得蛋白质含量。
(三)实验材料与仪器:
1.仪器和材料: 分光光度计、7支试管、1毫升刻度吸管3支、移液器、坐标纸。
2.试剂:6mol/L的NaOH、双缩脲试剂、9g/L的NaCl溶液、蛋白质标准液(10g/L)、待测血清样本。
(四)实验步骤和结论:
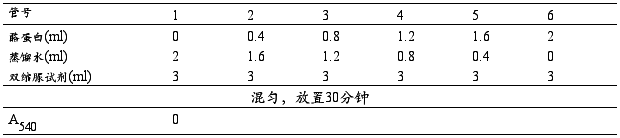
1.取7支试管,编号,按照图1操作并记录。
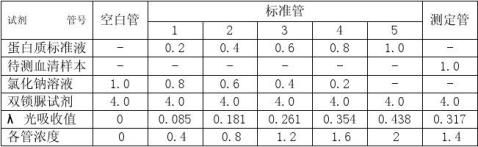
表 1
2.在坐标纸上以各管蛋白质含量为横坐标,光吸收值(两管平均值)为纵坐标,绘制标准曲线。
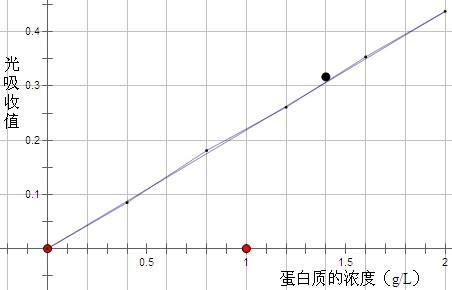
表2
3、由标准曲线查出待测的血清样本的蛋白质浓度,由表1得出测定管的蛋白质的λ光吸收值为0.317,由表2得出测定管的蛋白质的浓度为1.4g/L
4、按照光吸收法计算公式计算,从标准管中选一管与测定管光吸收值接近者,按公式
C标A测C测?A标
计算待测血清样本的蛋白质浓度,从上可选A测 = 0.317
C标=0.354 ,A标=1.6 g/L; 则得到:C测=1.432 g/L
【注意事项】 : 1.本实验是定量实验,要求所有玻璃仪器必须清洁,整齐、干燥。蛋白质标准液和血清取量必须准确。
…… …… 余下全文



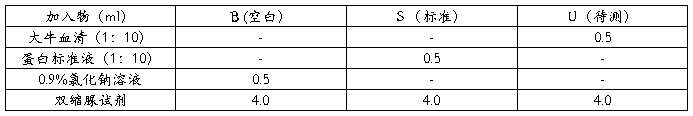
 取3支试管,做好标记(B空白对照,S标准液,U为待测大牛血清),按下表操作:
取3支试管,做好标记(B空白对照,S标准液,U为待测大牛血清),按下表操作: