蛋白质的沉淀反应
一、目的和要求
1、加深对蛋白质胶体溶液稳定因素的认识
2、掌握几种沉淀蛋白质的方法
3、了解蛋白质变性与沉淀的关系
二、沉淀反应
(一)原理
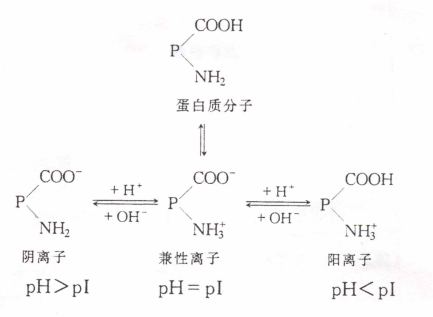
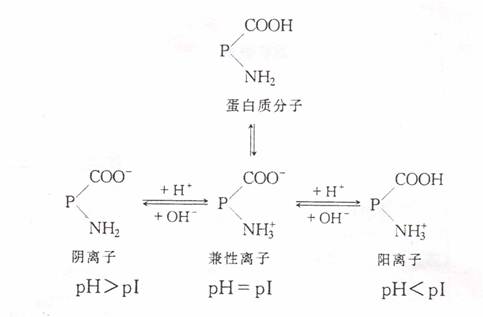
在水溶液中,蛋白质分子的表面上由于有水化层和同性电荷的作用,所以成为稳定的胶体颗粒。但这种稳定的状态是有条件的。在某些理化因素的作用下,蛋白质分子表面带电性质发生变化、脱水甚至变性,则会以固态形式从溶液中析出,这个过程就称为蛋白质的沉淀反应。蛋白质的沉淀反应可分为以下两种类型:
1、可逆沉淀反应
沉淀反应发生后,蛋白质分子内部结构并没有发生大的或者显著变化。在沉淀因素去除后,又可恢复其亲水性,这种沉淀反应就是可逆沉淀反应,也叫做不变性沉淀反应。属于这类沉淀反应的有盐析作用、等电点沉淀以及在低温下短时间的有机溶剂沉淀法等。
2、不可逆沉淀反应
蛋白质在沉淀的同时,其空间结构发生大的改变,许多副键发生断裂,即使除去沉淀因素,蛋白质也不会恢复其亲水性,并丧失生物活性,这种沉淀反应就是不可逆沉淀反应。重金属盐、生物碱试剂、强酸、强碱、加热、强烈震荡、有机溶剂等都能使蛋白质发生不可逆沉淀反应。
(二)盐析
1、材料与试剂
(1)10%的卵清蛋白溶液(要求新鲜配制)、浓蛋白溶液(2)饱和硫酸铵溶液 (3)固体硫酸铵 (4)滤纸、玻棒
2、操作方法
(1)取试管一支,加入浓蛋白溶液2ml,再加等量的饱和硫酸铵溶液,混匀后静置10分钟将出现沉淀。此沉淀物为球蛋白。
(2)取上清液于另一支试管。
(3)向上清液液中加入硫酸铵粉末,边加边用玻棒搅拌,直至粉末不再溶解为止。静置数分钟后,沉淀析出的是清蛋白。
(4)向两支试管中分别加水,观察其沉淀是否溶解。
(三)重金属盐沉淀
重金属离子如Pb2+、Cu2+、Hg2+、Ag2+等可与蛋白质分子上的羟基结合生成不溶性金属盐而沉淀:
…… …… 余下全文