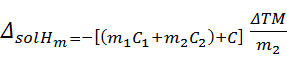溶解热的测定
姓名:学号:班级:(同组实验者:)
实验日期:提交报告日期:
带实验助教:
1 引言
1.1 实验目的
1.测量硝酸钾在不同浓度水溶液中的溶解热,并求其在水中溶解过程中的各种热效应。
2.掌握量热装置的基本组合及电热补偿法测定热效应的基本原理。
3.复习和掌握常用的测温技术。
1.2 实验原理[1]
1.几个基本概念
(1)溶解热:恒温恒压下,溶质B溶于溶剂A(或溶于某浓度溶液)中产生的热效应,用?sol?表示。
(2)摩尔积分溶解热:恒温恒压下,1mol溶质溶解于一定量的溶剂中形成一定浓度的溶液,整个过程产生的热效应。用?sol?m表示。
?sol??sol?m= B
式中,?B为溶解于溶剂A中的溶质B的物质的量。
(3)摩尔微分溶解热:恒温恒压下,1mol溶质溶于某一确定浓度的无限量的溶液中产生的热效应,以 ??sol?
??B?,?,?A表示,简写为 ??sol???B 。 ?A
(4)稀释热:恒温恒压下,一定量的溶剂A加到某浓度的溶液使之稀释所产生的热效应。
(5)摩尔积分稀释热:恒温恒压下,在含有1mol溶质的溶液中加入一定量的溶剂,使之稀释成另一浓度的溶液的过程中产生的热效应,以?dil?m表示。
?dil?m=?sol?m2??sol?m1
式中,?sol?m2、?sol?m1为两种浓度下的摩尔积分溶解热。
(6)摩尔微分稀释热:恒温恒压下,1mol溶剂加入到某一浓度无限量的溶液中所发生的热效应,以 ??sol?
??A?,?,?B表示,简写为 ??sol???A 。 ?B
2.恒温恒压下,对指定的溶剂A和溶质B,溶解热大小取决于A和B的物质的量,即
?sol?= ?A,?B
从而
?sol?=?A
?sol?m=
令?0=?A/?B,则上式可写为 ??sol???sol?+?B A?,?,?B?,?,?B?B??A??sol???sol? + BA?,?,?B?,?,?
…… …… 余下全文

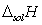 表示。
表示。 表示。
表示。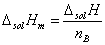 (1)
(1)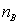 为溶解于溶剂A中的溶质B的物质的量。
为溶解于溶剂A中的溶质B的物质的量。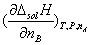 表示,简写为
表示,简写为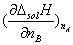 。
。 表示。
表示。