溶解热的测定
姓名:学号:班级:(同组实验者:)
实验日期:提交报告日期:
带实验助教:
1 引言
1.1 实验目的
1.测量硝酸钾在不同浓度水溶液中的溶解热,并求其在水中溶解过程中的各种热效应。
2.掌握量热装置的基本组合及电热补偿法测定热效应的基本原理。
3.复习和掌握常用的测温技术。
1.2 实验原理[1]
1.几个基本概念
(1)溶解热:恒温恒压下,溶质B溶于溶剂A(或溶于某浓度溶液)中产生的热效应,用?sol?表示。
(2)摩尔积分溶解热:恒温恒压下,1mol溶质溶解于一定量的溶剂中形成一定浓度的溶液,整个过程产生的热效应。用?sol?m表示。
?sol??sol?m= B
式中,?B为溶解于溶剂A中的溶质B的物质的量。
(3)摩尔微分溶解热:恒温恒压下,1mol溶质溶于某一确定浓度的无限量的溶液中产生的热效应,以 ??sol?
??B?,?,?A表示,简写为 ??sol???B 。 ?A
(4)稀释热:恒温恒压下,一定量的溶剂A加到某浓度的溶液使之稀释所产生的热效应。
(5)摩尔积分稀释热:恒温恒压下,在含有1mol溶质的溶液中加入一定量的溶剂,使之稀释成另一浓度的溶液的过程中产生的热效应,以?dil?m表示。
?dil?m=?sol?m2??sol?m1
式中,?sol?m2、?sol?m1为两种浓度下的摩尔积分溶解热。
(6)摩尔微分稀释热:恒温恒压下,1mol溶剂加入到某一浓度无限量的溶液中所发生的热效应,以 ??sol?
??A?,?,?B表示,简写为 ??sol???A 。 ?B
2.恒温恒压下,对指定的溶剂A和溶质B,溶解热大小取决于A和B的物质的量,即
?sol?= ?A,?B
从而
?sol?=?A
?sol?m=
令?0=?A/?B,则上式可写为 ??sol???sol?+?B A?,?,?B?,?,?B?B??A??sol???sol? + BA?,?,?B?,?,?
??sol???sol??sol?m=?0 + A?,?,?B?,?,?B?
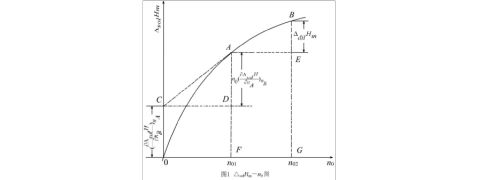
上式中?sol?m可由实验测得,?0由实验中所用溶质和溶剂的物质的量计算得到。据此可作出?sol?m-?0曲线,如图1。曲线某点的切线的斜率为该浓度下的摩尔微分稀释热,切线与纵坐标的截距,为该浓度下的摩尔微分溶解热(即OC)。显然,图中A点的摩尔溶解热与B点
1 / 6
的摩尔溶解热之差为该过程的摩尔积分稀释热(即BE)。
欲求溶解过程的各种热效应,应测定各种浓度下的摩尔积分溶解热。实验中采用累加的方法,先在纯溶剂中加入溶质,测出溶解热,然后在这溶液中再加入溶质,测出热效应,根据先后加入溶质总量可求出?0,各次热效应总和即为该浓度下的溶解热。
3.实验采用绝热式测温量热计,装置图如图2。KNO3在水中的溶解热是一个吸热过程,热量的标定采用电热补偿法,先测定体系的起始温度,溶解过程中体系温度随吸热反应进行而降低,再用电加热法使体系升温至起始温度,根据所消耗电能求出热效应Q,如下式求算出溶解热:
?2??1?sol?=?21?=?2??
′′′′式中:?1、?2为加入溶质始末的体系的温度;Q为使体系从?2升至?1时的电热(J);?2、?1为
电加热始末的体系温度,I为电流强度(A);R为加热器电阻(Ω);t为通电加热时间(s)。采用
′′热敏电阻测温系统,(?2??1)为溶解过程校正后的峰高,(?2??1)为加热过程校正后的峰高。
2 实验操作
2.1实验药品、仪器型号及测试装置示意图
保温瓶(750mL)1个,78-2型双向磁力搅拌器1台(江苏省金坛市荣华仪器制造有限公司),热敏电阻测温装置1套,数显惠斯通电桥(清华大学化学系),台式自动平衡记录仪,加热器,直流稳压稳流电源(DYY-7型转移电泳仪),秒表,容量瓶(500mL),烧杯(1000mL),温度计,研钵1只,称量瓶,分析天平(公用),Hewlett Packard 34401A高精度万用表(公用)。
KNO3(AR)。
2.2 实验条件
室温:17.5℃,大气压:102.01 kPa。
2.3 实验操作步骤及方法要点
(1)测量室温,取不少于500 mL的去离子水,根据室温调节水的温度,使之尽量接近室温,量取500 mL注入保温瓶内。这样体系温度与室温(环境)接近,减少体系与环境的热交换。按图2将装置安装好,记录仪量程20mV,走纸速度4mm/min。
(2)在分析天平上准确称量约5g左右(已研细并烘干)的KNO3待用。
2 / 6
(3)开动搅拌器,调节测温电桥平衡调节旋钮,使记录仪的记录笔处于记录纸的中间位置,待温度基本稳定后,记录约4 min(约记录纸的1格半)。电源调至稳流,打开电源开始加热,同时将电流值调至950 mA左右(此后不要再调节电流),温度升高,记录笔升至约80格左右(记录纸上的刻度),关闭电源停止加热。待记录仪记录约8 min左右,加入称量好的KNO3。此时由于KNO3溶解吸热,温度降低,记录笔降低,待温度稳定后再记录约8 min左右。严格的操作应将样品装在蜡封样品管中,放在保温瓶中恒温,加样时用玻璃棒戳破管底,样品溶入溶液。本实验采用称量瓶装样品,直接倒入,由减量法求出样品质量。
(4)打开加热电源加热,同时打开秒表计时,待记录笔升至80格左右(加热使温度升高的格数,以下次加入KNO3的量决定),关闭电源停止加热,同时停止计时,记下加热时间。再记录约8min左右。整个过程如图3所示。
(5)按上述步骤依次加入约6、7、7、7.1、7.3和6g的KNO3。
(6)用万用表测量实验所用加热器的阻值R。
(7)整理实验仪器。
3 结果与讨论
3.1 原始实验数据
所得数据如下表1列出(略去雷诺图解法步骤;由于记录仪量程存在问题,在加入7 g硝酸钾时,图线就很接近图纸的边缘,后来的几组实际加入硝酸钾的量少于书中所给)。
3 / 6
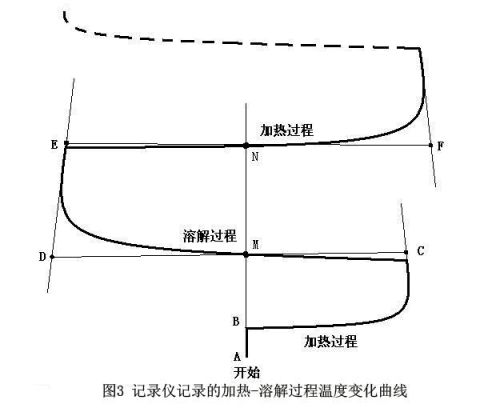
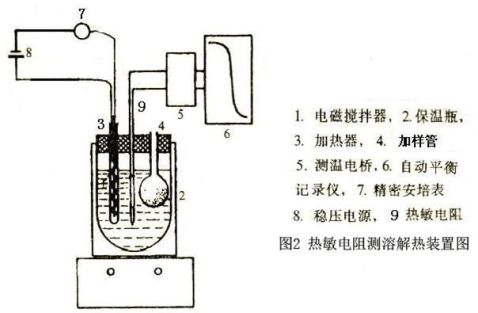
表1 实验原始数据
实验序号 1 2 3 4 5 6 7
KNO3加入前质量/g 4.9991 6.0006 6.9968 7.1144 7.3151 7.0150 6.0043
KNO3加入后质量/g 0.0007 -0.0053 -0.0008 0.0086 0.0014 -0.0007 0.0000
加热时间/min 1′43″63 2′12″56 2′17″90 2′14″25 2′13″72 1′48″31 1′13″28
加热电流/mA 952 952 952 952 952 952 952
?1??2格
数 69.9 80.9 92.1 90.5 90.0 83.9 70.5
′′?1??2格
数
67.5 87.0 90.1 87,8 86.8 70.8 47.9
测得加热器电阻值?=15.186 Ω,溶剂(去离子水)500 mL。 计算公式如下: 每步的电能产热
?=?2??
溶解过程的热效应
?2??1
?溶=?
21?0=
则
?sol?=
其中?B、?B为各次的累加。
?溶B
?A?A?A?B
=BAB
3.2 计算的数据结果
水的摩尔质量为18.015 g/mol,查阅数据得17.5℃时水的密度为998.704 kg/m3,则水的
物质的量?H2O=27.79 mol。硝酸钾的摩尔质量为101.103 g/mol。利用?=?2??求出每次加热的Q及加入的硝酸钾的量,各项累加后求出?0和累计的效应,进而求出?sol?m,列出表2。
序号 1 2 3 4 5 6 7
1426.27 1824.44 1897.94 1847.70 1840.41 1490.68 1008.56
累计热效应/J 1476.98 3173.50 5113.57 7018.09 8926.35 10692.85 12177.26
累计KNO3物质的量/mol
0.04944 0.10884 0.17806 0.24834 0.32068 0.39007 0.44946
0562.01 255.33 156.07 111.90 86.660 71.244 61.830
solm29.874
29.157 28.718 28.260 27.836 27.413 27.093
根据上表中的?0和?sol?m数据,利用origin软件可作出散点图并拟合出曲线,可以看出数据的拟合效果很好,如图4。曲线的方程为
?=A1?
?
?1
+A2?
?
?2
+?0
A1=?2.77143,A2=?6.16766,?0=31.05288,?1=657.51935,?2=42.42573。
4 / 6
求出?0为80、100、200、300、400处摩尔积分溶解热、微分溶解热、微分稀释热,以及?0为80→100、l00→200、200→300、300→400过程的摩尔稀释热,分别列出表3、表4。
表3 摩尔积分溶解热、微分溶解热、微分稀释热 ?0 80 100 200 300 400
摩尔积分溶解热?sol?m/(kJ?mol-1)
27.663 28.088 28.953 29.292 29.544
摩尔微分溶解热
sol??B
/
?A
摩尔微分稀释热
(kJ?mol-1) 25.600 26.349 28.070 28.454 28.622
5 / 6
??sol???A
/ (kJ?mol-1)
?2.5790×10-2 1.7387×10-2 4.4132×10-3 2.7943×10-3 2.3057×10-3
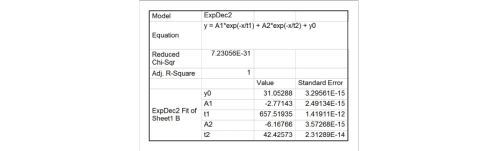
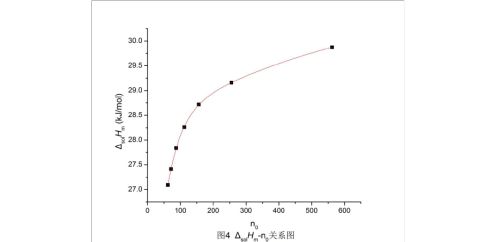
表4 摩尔积分稀释热
?0
80-100 100-200
200-300
300-400 摩尔积分稀释热?dil?m/ (kJ?mol-1) 0.425 0.865 0.339 0.252
3.3 讨论分析
1.根据拟合出的曲线方程可知?sol?m存在极限为31.052 kJ/mol,与理论值35.392 kJ/mol相比偏小,因为保温瓶不能完全减少体系与环境的热交换,加样时打开瓶盖直接加入,必然会有热交换。
2.实验开始前恒温水的准确配置非常重要,测量室温和去离子水的温度计必须是同一只,因为各温度计的性能存在差异,测量结果可能会不同。
3.实验加热时需注意加热时间,记录仪的量程需要合适;加热时间的长短应以下依次加入的样品的量决定,如果下次加入量较大可适当延长加热时间,但整个过程中注意不要超过量程。如果本次加入样品后图线已快超过量程可减少下次加入的样品的量。
4.从表3和表4可看出,摩尔积分溶解热、摩尔微分溶解热随?0增大而增大,摩尔微分稀释热则随?0增大而减小;在?0变化值相同的各个过程中,随着?0的增大摩尔积分稀释热逐渐减小。
4 结论
摩尔积分溶解热、摩尔微分溶解热随?0增大而增大,摩尔微分稀释热、摩尔积分稀释热(?0变化值相同)则随?0增大而减小,摩尔积分溶解热存在极限值31.052 kJ/mol,相比理论值偏小。
5 参考文献
[1] 贺德华,麻英,张连庆.《基础物理化学实验》.北京:高等教育出版社,2008.62-67. 6 附录
思考题
1.如何用本装置测定液体的比热?
答:测量出一个过程中液体温度上升的值和此过程吸收的热量,便可得出液体热容。采用本装置将液体加热到高于室温的温度后冷却,再将体系加热到某高于室温的温度,记录下加热的时间及电流值,重复几组实验。由于已知待测液体的质量和加热电阻的电阻值,通过?2??=????,以液体温度变化值为横坐标,加热的热量为纵坐标,进行直线拟合。拟合直线的除以?即为溶液的比热。当然,由于需要温度的准确值,需知到每格代表的温度数。
2.如果反应是放热的如何进行实验?
答:可采取这样的方法:所用的仪器装置和流程大体不变,只是先加入样品,溶液升温,待溶液温度下降图线走平稳后再用电加热升温,之后再冷却,然后重复实验,仍可用上述公式来计算溶解热,不过这个过程时间较长。
3.温度和浓度对溶解热有无影响?如何从实验温度下的溶解热计算其它温度下的溶解热?
答:温度和浓度都有影响,因为溶解热是溶解过程中微观上,固态晶体的溶解、与水分子的作用(水合)、扩散(稀释)的总效果,所以温度和浓度都会影响到以上过程进行的难易程度,以及相应的热效应。通过基尔霍夫公式可用一个温度下的热效应求另一个温度下的热效应,只需知道定压热容随温度的变化情况。
6 / 6
第二篇:燃烧热实验报告
燃烧热的测定
摘要
本实验中借助氧弹式量热计,在测定标准物质苯甲酸的燃烧热的基础上,先求算出了所用仪器的量热计热容,再以此为基础测定了蔗糖的恒容燃烧热。文章末尾对实验中的误差和雷诺校正方法的合理性进行了讨论。
实验步骤(修正)
1. 取消硝酸滴定过程
2. 先向量热器内加入2000mL去离子水,放入氧弹后再加入1000mL去离子水。
3. 实验过程中,在开始时恒温段每30s记录一个数据,维持5min;之后使用电极点火燃烧,燃烧过程中每15s记录一个数据,直至温度升高并恒定;温度升高并恒定后再次恢复至每30s记录一个数据。
数据记录及处理
1. 样品质量的测量:
表1 样品质量测定

2、水当量的测定:
表2 苯甲酸T-t数据表

3、蔗糖燃烧热的测定:
表3 蔗糖T-t数据表

4、苯甲酸燃烧T-t数据作图(雷诺校正)

由雷诺校正图可知,升温△T=1.098K,t=409.8s
5、蔗糖燃烧T-t数据作图(雷诺校正)

由雷诺校正图可知,升温△T=1.030K,t=391.3s
6.水当量的计算
(1) 引燃用镍丝的校正:

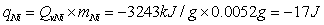
(2) 棉线的校正:

(3) 量热计常数的计算:
苯甲酸燃烧反应式:
对于气体产物而言 =-0.5
=-0.5
已知苯甲酸恒压热容为:
则
燃烧物质质量
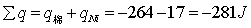
认为体系中已经将氮气排尽从而忽略由于形成硝酸造成的误差,计算可得

7、 计算蔗糖的恒容燃烧热 和恒压燃烧热
和恒压燃烧热
(1)引燃用镍丝的校正:


(2) 棉线的校正:

(3) 蔗糖恒容燃烧热:

已知
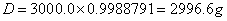



(4) 蔗糖的恒压溶解热:
由方程: ,可知
,可知
于是
误差分析
由查阅文献可知,蔗糖燃烧热为-16490(J/g)。相对偏差

实验值与理论值较为接近。
1. 定量误差分析
(1) 质量称量误差
以万分天平计,称量误差为0.0002g,镍丝质量为差值法得到,误差应为0.0004g。
镍丝燃烧误差:
 (刻意多保留一位有效数字)
(刻意多保留一位有效数字)
棉线燃烧误差:
 (刻意多保留一位有效数字)
(刻意多保留一位有效数字)
燃烧物称量误差:
累计加和来看,
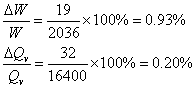
由此分析,称量本身系统误差对最终结果造成影响较小。
值得一提的是,在实验过程中称量结束至燃烧过程中,需使用棉线及镍丝固定待测物;这一过程中难免会有待测物压片散块造成质量偏差。这是实验中非常重要的一个误差来源,其质量偏差将会线性传递至最终误差里。
在实际操作中,为了减少这类误差;可以在结束后将栓系绳子的工作放于一称量纸上完成,将待测物固定完成后再称量纸上洒落样品。从而弥补由于样品易散造成的误差。
(2) 水的体积测量造成的误差
为便于讨论,假设两次使用2000mL及1000mL容量瓶会累计造成5mL误差(认为容量瓶本身存在千分之一误差,再考虑挂壁、溅出等影响)


由此可见,加入水量的误差在极大估计条件下(5mL)也不会对最终结果造成太大影响。
(3) 温度波动造成的误差
在实验的非加热段,由数据显示温度波动为0.01K,则


本实验中,由温度波动0.01K即可对最终结果造成1%误差,由此可见温度波动是实验误差的另一主要因素。因此,采用雷诺校正是很有必要的。
(4)是否进行酸校正的定量分析:
假设氧弹内容积为1L(偏大估计),即含有790mL氮气。本实验中反复冲入氧气至1MP再放气至常压,重复三次除去氮气。则剩余氮气量可计算为790*0.13=0.79mL
换算为物质的量n(氮气)=0.033mmol

由氮气产生的热效应
此数值仅与镍丝称量误差带来的影响大致相同,对于整个实验体系可以忽略不计。因此本实验省略酸校正分析是合理的。
2.定性误差分析
(1)热容值变化的讨论
理论上,热容随温度变化而变化;因此c=c(T)并非一个常量。在本实验中,通过计算水当量表征仪器的吸热效应,同时控制燃烧标准物质和待测物质时体系上升大致相同的温度。同时,体系整体温度上升幅度并不大(1.1℃左右),因此粗略地认为热容随温度变化幅度可忽略是合理的。
(2)待测物质量
本实验定量分析过程中可发现,待测物质量大小对最终的误差有很大影响。在实验过程第一次压片过程中,由于操作并不熟练,压制得到的苯甲酸固体质量偏小;仅仅0.6g,计算发现由此导致的系统误差是较大的。因此,在蔗糖燃烧实验中改进了压片手法,增加了待测物质量,分析得到的系统误差显著下降。
实验操作讨论
在实验过程中,我认为有如下操作值得反思和注意
(1)压片操作
如果压片过松,则所得药片的强度较差,不宜成型,遇到外部振动或者在移动过程中会出现碎裂、散落现象。如果压片过紧,则压片器容易卡主,在取出样品过程中可能又会造成样品的损坏。
相较而言,苯甲酸标准物质颗粒较小,分布均匀,较为容易压片。而蔗糖晶体必须充分研磨成细末状再进行压片才会相对容易。
(2)固定压片的操作
将压片与点火器件稳定固定在氧弹中是本实验中最难的操作。首先需要明确,镍丝的作用是产生火花引燃体系,棉线的作用是将镍丝与待测物空间上固定在一起,同时起到引燃的作用。讲义上指出可以将镍丝压入样品内,但在本实验中受限于设备限制,以下操作更为合理:压出的样品用棉线固定捆住,同时棉线本身提供镍丝的固定支撑点,令镍丝穿过细线并环绕住压片。
同时在固定操作中,建议在下方放置称量纸。以便于收集散落的待测物,称量后校正得到正确的燃烧物质量。
(3)对于氧弹的清洁操作
两次测定之间除了需要擦净量热桶内壁、氧弹外壁的水分外,还需要将氧弹内筒仔细擦干净,除去上一次燃烧过程中产生的水,减少误差。
结论
本实验通过在氧弹式量热计中燃烧苯甲酸,通过使用雷诺校正,计算出水当量的方法作为基准,求得了蔗糖的恒压(恒容)燃烧热为1.640*104J/g。之后通过定量、定性误差分析,讨论了实验过程中应当特别注意的细节。
思考题
1. 雷诺图解法的本质和适用范围
在量热实验中,量热计与周围环境的热交换无法完全避免,对温差测量值的影响可用雷诺(Renolds) 温度校正图校正。

如图所示,图中B点意味着燃烧开始,热传入介质;HG为线延长并交温度曲线于E点,其间的温度差值即为经过校正的 。E点认为是环境均衡温度。图中(G-A)为开始燃烧到温度上升至室温这一段时间内,由环境辐射和搅拌引进的能量所造成的升温,故应予扣除。同理(H-C)由室温升高到最高点这一段时间内,热量计向环境的热漏造成的温度波动,计算时必须考虑在内。故可认为,HG两点的差值较客观地表示了样品燃烧引起的升温数值。
在量热实验中,如果无法保证体系完全与外界隔绝热交换,则需要用雷诺校正法扣除环境影响。同时在某些情况下,量热计的绝热性能良好,但搅拌器功率较大,可能由于搅拌造成温度波动,也需要用雷诺校正减小误差。
总之,雷诺校正的目的是使实验中温差变化能客观反映仅仅由燃烧产热而不受环境影响的结果。
2. 标准物质苯甲酸的恒压燃烧热Qp=-26460J/g,恒容燃烧热为多少?
见实验部分数据呈现及处理。
3. 搅拌过快或过慢有何影响?
搅拌过快可能造成由机械搅拌做功导致体系温度升高,从而引入不必要误差;搅拌过慢会使得温度计受热不均,测量值与真实值产生偏差。
4. 本实验中苯甲酸的作用是什么?可否将一定量的苯甲酸与蔗糖混合在一起只进行一次测量求蔗糖的燃烧热?
不可。
这样求蔗糖的燃烧热。由公式 可知,若将苯甲酸和蔗糖一起燃烧,则存在有W和Qv(蔗糖)两个未知数,无法单独求出蔗糖的燃烧热。
可知,若将苯甲酸和蔗糖一起燃烧,则存在有W和Qv(蔗糖)两个未知数,无法单独求出蔗糖的燃烧热。
如果适当改进,至少进行两次测定并严格计算二者比例,可以通过解方程组确定蔗糖的燃烧热
5. 实验中“准确量取低于环境温度为1℃的自来水3000mL,顺筒壁小心倒入内筒”,为什么加入内筒的水温度要选择比环境低1℃左右?
由雷诺校正定义可知,应当使得环境温度处于燃烧前后温度差之间;若超出此范围,则雷诺校正无效。
参考资料
[1] 韩德刚,高执隶,高盘良.物理化学.高等教育出版社.2001
[2] 物理化学实验第4版.北京大学出版社.2001
