
思考与讨论:
1.海带提碘的基本化学原理是什么?可以用其他氧化剂代替氯水吗?请查阅资料,举出实例。
2.用分液漏斗进行萃取或分液要注意些什么?为什么能用CCl4来萃取碘水中的碘,作用是什么?
…… …… 余下全文

思考与讨论:
1.海带提碘的基本化学原理是什么?可以用其他氧化剂代替氯水吗?请查阅资料,举出实例。
2.用分液漏斗进行萃取或分液要注意些什么?为什么能用CCl4来萃取碘水中的碘,作用是什么?
…… …… 余下全文
从海带中提取碘
一、实验目的
1.掌握萃取、过滤的操作及有关原理。
2.了解从海带中提取碘的过程。
3.复习氧化还原反应的知识。
二、实验原理
把干海带燃烧后生成的灰烬,海带会中的碘元素以碘离子的形式存在。加入去离子水并煮沸,使碘离子溶于水中,过滤取滤液,调节滤液pH为中性(海带灰里含有碳酸钾,酸化使其层中性或弱酸性对下一步氧化析出碘有利。但硫酸加多了则易使碘化氢氧化出碘而损失)。蒸干滤液,将得到的白色固体与重铬酸钾混合均匀,研磨。在高筒烧杯中加热混合物,此时碘单质会升华出来,用注满冰水的圆底烧瓶盖在烧杯口处,碘就会凝华在烧瓶底部。刮下生成的碘,称量计算产率。

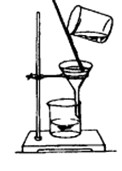 三、实验装置图
三、实验装置图

四、仪器与试剂
仪器:电子天平,天平,圆底烧瓶,高筒烧杯,烧杯(50ml、250mL),酒精灯,剪子,带盖坩埚,泥三角,坩埚钳,蒸发皿,脱脂棉,研钵,pH试纸,定量滤纸,吸滤瓶,导管,橡皮管,小刀。
试剂:干海带(50g),蒸馏水,自来水,H2SO4溶液,重铬酸钾(s)。
五、实验方法
1.取50g食用干海带,用刷子把干海带表面附着物刷净,不要用水洗。将海带剪碎,用酒精润湿放入瓷坩埚中,把坩埚置于泥三角上。
2.用酒精灯灼烧盛有海带的坩埚,至海带完全烧成炭黑色灰后,停止加热,自然冷却。
3.将海带灰倒在烧杯中,依次加入50ml、30ml、10ml蒸馏水熬煮,每次熬煮后,倾泻出上层清夜,抽滤。将滤液和三次浸取液合并在一起,总体积不宜超过40ml。 再加入15mL蒸馏水,不断搅拌,煮沸4min~5min,使可溶物溶解,10分钟后过滤。
4.向滤液里加H2SO4溶液酸化,调节pH值显中性。把酸化后的滤液倒入蒸发皿中,蒸发至干并尽量炒干,将固体转移至研钵中,加入2g重铬酸钾固体,研细。
5.将上述混合物放入干燥的高筒烧杯中,将自来水冷却的烧瓶放在烧杯口上,在烧杯的缺口部位用脱脂棉赛紧,加热烧杯使生成的碘遇热升华。碘蒸气在烧瓶底部遇冷凝华。当在无紫色碘蒸气产生时,停止加热。取下烧瓶,将烧瓶凝聚的固体碘刮到小称量瓶中,称重。计算海带中碘的百分含量。
…… …… 余下全文
从海带中提取碘
一、实验目的
1.掌握萃取、过滤的操作及有关原理。
2.了解从海带中提取碘的过程。
3.复习氧化还原反应的知识。
二、实验原理
把干海带燃烧后生成的灰烬,海带会中的碘元素以碘离子的形式存在。加入去离子水并煮沸,使碘离子溶于水中,过滤取滤液,调节滤液pH为中性(海带灰里含有碳酸钾,酸化使其层中性或弱酸性对下一步氧化析出碘有利。但硫酸加多了则易使碘化氢氧化出碘而损失)。蒸干滤液,将得到的白色固体与重铬酸钾混合均匀,研磨。在高筒烧杯中加热混合物,此时碘单质会升华出来,用注满冰水的圆底烧瓶盖在烧杯口处,碘就会凝华在烧瓶底部。刮下生成的碘,称量计算产率。

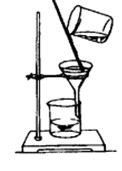 三、实验装置图
三、实验装置图


四、仪器与试剂
仪器:电子天平,天平,圆底烧瓶,高筒烧杯,烧杯(50ml、250mL),酒精灯,剪子,带盖坩埚,泥三角,坩埚钳,蒸发皿,脱脂棉,研钵,pH试纸,定量滤纸,吸滤瓶,导管,橡皮管,小刀。
试剂:干海带(50g),蒸馏水,自来水,H2SO4溶液,重铬酸钾(s)。
五、实验方法
1.取50g食用干海带,用刷子把干海带表面附着物刷净,不要用水洗。将海带剪碎,用酒精润湿放入瓷坩埚中,把坩埚置于泥三角上。
2.用酒精灯灼烧盛有海带的坩埚,至海带完全烧成炭黑色灰后,停止加热,自然冷却。
3.将海带灰倒在烧杯中,依次加入50ml、30ml、10ml蒸馏水熬煮,每次熬煮后,倾泻出上层清夜,抽滤。将滤液和三次浸取液合并在一起,总体积不宜超过40ml。 再加入15mL蒸馏水,不断搅拌,煮沸4min~5min,使可溶物溶解,10分钟后过滤。
4.向滤液里加H2SO4溶液酸化,调节pH值显中性。把酸化后的滤液倒入蒸发皿中,蒸发至干并尽量炒干,将固体转移至研钵中,加入2g重铬酸钾固体,研细。
5.将上述混合物放入干燥的高筒烧杯中,将自来水冷却的烧瓶放在烧杯口上,在烧杯的缺口部位用脱脂棉赛紧,加热烧杯使生成的碘遇热升华。碘蒸气在烧瓶底部遇冷凝华。当在无紫色碘蒸气产生时,停止加热。取下烧瓶,将烧瓶凝聚的固体碘刮到小称量瓶中,称重。计算海带中碘的百分含量。
…… …… 余下全文
综合实验3 海带中碘元素的提取和检验
实验目的
1.了解从海带中分离和检验碘元素的基本原理。
2.知道从海带中分离和检验碘元素的操作流程。
3.理解萃取的原理及萃取方法的适用范围。
4.掌握溶解、过滤、萃取、分液等基本操作的要点。
5.了解物质分离、提纯方法选择的基本原则及一般思路,初步形成用化学实验解决问题的能力。
实验原理
海带、紫菜等海藻中含有碘元素,将海带灼烧成灰,在灰分中加入水,碘元素便以I-的形式进入溶液,用适量的氧化剂(如氯水、过氧化氢溶液等)将I-氧化成I2。I2能与淀粉的水溶液作用显蓝色。有关的化学反应方程式为:2I-+Cl2=I2+2Cl- 2I-+H2O2+2H+==I2+2H2O
萃取是利用溶质在互不相溶的溶剂里溶解度的不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液里提取出来的方法。萃取后往往需要用分液漏斗将这两种不相溶的液体分开,这一操作称为分液。
碘单质易溶于四氯化碳、苯等有机溶剂。用与水不相溶的有机溶剂可以把碘单质从碘的水溶液中萃取出来。
实验用品
仪器:试管、烧杯(两只)、量筒、铁架台、漏斗、滤纸、玻璃棒、酒精灯、火柴、分液漏斗、石棉网
试剂:2 mol·L-1 H2SO4溶液、6%H2O2溶液、CCl4、淀粉溶液、蒸馏水,海带灰
实验步骤
1.检查分液漏斗是否漏水
向分液漏斗中加入少量水,检查旋塞处是否漏水。用右手食指按住分液漏斗上口玻璃塞,将漏斗倒转过来,检查玻璃塞是否漏水。若漏水,须在旋塞芯(或玻璃塞)上涂一层薄薄的凡士林(注意不堵塞上面的小孔),将旋塞芯塞进旋塞内(或将玻璃塞塞进上口),旋转数圈,使凡士林均匀分布。
确信分液漏斗不漏水后,将分液漏斗置于铁架台的铁圈上备用。
2.制取海带灰的浸取液
在小烧杯内取一药匙海带灰,再向其中加入30 mL 蒸馏水,煮沸1~2 min,过滤,得滤液(若滤液稍显浑浊,可重新过滤一次)。
…… …… 余下全文
海带多糖的提取和鉴定实验报告
—0943713 王欢
实验伙伴:0943623魏爽
蛋白质、酶、核酸、多糖等生物大分子的结构与功能的研究是探求生命奥秘的中心课题。为了进行结构与功能的研究,首先必须解决制备问题,制备完毕要进行鉴定。
一、实验目的
1,掌握酶法提取海带硫酸多糖的原理和操作流程;
2,了解多糖物质的常规纯化方法及原理;
3,熟悉多糖含量测定的常用方法和原理;
4,掌握硫酸-蒽酮法测定多糖的原理及操作流程、注意事项;
二、实验原理
本实验综合利用细胞匀浆和纤维素酶水解,破碎海带细胞壁,释放细胞内容物,包括多糖、海藻酸以及蛋白、核酸等;随后通过海藻酸与Ca2+的结合沉淀形成不溶性海藻酸钙,以去除其中的海藻酸;继而通过CTAB与多糖络合后溶解度下降的特性,将多糖与其他成份分离;最后在盐溶液中回溶多糖,并通过乙醇沉淀法获得多糖沉淀,即为海带粗多糖。可采用硫酸-蒽酮法测定多糖的含量
三、实验材料及试剂
实验材料:干海带
实验试剂:纤维素酶、1mol/L氯化钙溶液、硫酸、蒽酮、 十六烷基三甲基溴化铵(CTAB)、 葡萄糖、 DE-23、DE-41、Sepharose(2B 4B 6B)等
仪器:组织匀浆机、水浴锅、台式高速离心机、分光光度计等
(下面是一些仪器和设备的照片)



四、实验步骤
海带多糖的提取
1.干海带加水浸泡过夜,充分溶胀后,加入1/3体积的水,放入组织匀浆机中,粉碎成海带浆。取约100ml海带浆,调PH值为4.5-5.0,加入0.3g纤维素酶,于50度温浴水解4-6小时,间或搅拌,促进细胞壁水解。(这个过程我们的指导老师已经提前做好)
2..在海带浆中加入50ml水,搅拌均匀,沸水浴5min,使纤维素酶失活,冷至室温,用6层纱布过滤,收集滤液(注:1、这个时候一定不要混入海带渣,防止对后面测量结果的影响, 2、过滤过程中可戴手套挤纱布,但是不要太用力使海带渣意外流出)
…… …… 余下全文
1从海带中提取碘
实验相关内容
实验目的
了解从海带中提取碘的生产原理。
实验原理
海带有含有碘化物,利用H2O2可将I-氧化成I2。本实验先将干海带灼烧去除有机物,
剩余物用H2O2-H2SO4 处理,使得I-被氧化成I2 。生成的I2又与碱反应。
2I-+H2O2+2H+ = I2+2H2O
3I2+6NaOH=5NaI+NaIO3+3H2O
疑点难点
干海带表面附着物不要用水洗,是为了防止海带中的碘化物溶于水而造成损失。
实验演示与步骤
1. 称取3g干海带,用刷子把干海带表面的附着物刷净(不要用水洗)。 将海带剪碎, 酒精润湿(便于灼烧)后,放在坩埚中。
2. 用酒精灯灼烧盛有海带的坩埚,至海带完成成灰,停止加热,冷却。
3. 将海带灰转移到小烧杯中,再向烧杯中加入10ml蒸馏水,搅拌,煮沸2min-3min,使可溶物溶解,过滤。
4. 向滤液中滴入几滴硫酸,再加入约1ml H2O2溶液。观察现象。
5. 取少量上述滤液,滴加几滴淀粉溶液。观察现象。
6. 向剩余的滤液中加入1ml淀粉溶液,振荡、静置。观察现象。 7. 向加有淀粉的溶液中加入NaOH溶液,充分振荡后,将混合液倒入指定的容器中。
2从海带中提取碘
1、 称取40g干燥的海带,放在铁皿中焙烧,使海带完全灰化。
2、 将海带灰倒在烧杯中,依次加入40ml、20ml、10ml蒸馏水熬煮,每次熬煮后,倾泻出上层清夜,抽滤。将滤液和三次浸取液合并在一起,总体积不宜超过30ml。
3、 往滤液里加2mol/L 硫酸溶液酸化至pH值显中性。(海带灰里含有碳酸钾,酸化使其层中性或弱酸性对下一步氧化析出碘有利。但硫酸加多了则易使碘化氢氧化出碘而损失)。
4、 把酸化后的滤液在蒸发皿中蒸发至干并尽量炒干,研细,并且加入2g重铬酸钾固体与之混合均匀。
5、 将上述混合物放入干燥的高筒烧杯中,将装有水冷却的烧瓶放在烧杯口上。加热烧杯使生成的碘升华。碘蒸气在烧瓶底部凝聚。当在无紫色碘蒸气产生时,停止加热。取下烧瓶,将烧瓶凝聚的固体碘刮到小称量瓶中,称重。计算海带中碘的百分含量。
…… …… 余下全文
实验三 海带中碘的提取及分析
一、实验目的
1. 掌握碘离子和单质碘的化学反应。
2. 熟悉萃取、减压抽滤等基本操作。
3. 掌握碘量法测定海带中碘的含量的实验原理和方法。
二、背景介绍
碘是人体必须的元素之一,缺碘会患甲状线肿大。海带中含有丰富的碘,可用来纠正因长期缺引起的甲状腺功能不足,使肿大的甲状腺体缩小,又有促进炎性渗出物吸收,并使病态组织崩溃、溶解。多食海带能防治此病,还能预防动脉硬化,降低胆固醇与脂的积聚。
三、实验原理
海带中的碘主要以碱金属碘化物和有机碘化物形式存在。利用灰化法将海带中有机碘化物转化为碘化物的形式,溶解过滤。在碱性条件下,海带中I-离子被KMnO4氧化为IO3-(过量的KMnO4在弱酸条件下用(COOH)2溶液除去)。然后在酸性条件下,加入KI与IO3-反应生成I2,再用Na2S2O3溶液滴定。 所涉及的化学反应方程式为:
I- + 6MnO4- + 6OH- = IO3- + 6MnO42- + 3H2O
5(COOH)2 + 2 MnO4- + 6H+ = 2Mn2+ + 10CO2 + 8H2O
IO3- + 5 I- + 6H+ = 3I2 + 3H2O
I2 + I- = I3-
I2 + 2S2O32- = 2I- + S4O62-
三、仪器与试剂
1.仪器
真空泵,布氏漏斗,抽滤瓶,碱式滴定管,锥形瓶。
2. 试剂
海带,0.10 mol/L NaOH,0.10 mol/L KMnO4溶液,1.0 mol/L HCl,0.10 mol/L KI溶液,1%淀粉指示剂,5.0×10-3 mol/L Na2S2O3溶液,10% (COOH)2溶液。
四、实验步骤 1. 海带中碘的提取
将市售海带洗净、烘干、粉碎。称取5.0克海带样品,于酒精灯上完全灼烧至灰白色海带灰,冷却后转移至烧杯中,加适量蒸馏水溶解,过滤得滤液。将滤液和洗液移入锥形瓶中加入1.0 mL 0.10 mol/L NaOH和2.0 mL 1.0 mol/L KMnO4溶液,摇匀后反应5min,之后加入1.0 mL 1.0 mol/L HCl溶液,边摇边加入(COOH)2溶液至溶液中高锰酸钾的颜色恰好消失。加入5.0 mL 0.10 mol/L KI溶液,溶液将变为黄色。
…… …… 余下全文
