《无机化学》各章小结
第一章 绪论
 平衡理论 :四大平衡
平衡理论 :四大平衡

 理论部分 原子结构
理论部分 原子结构
1.无机化学 结构理论:, 分子结构,
晶体结构
元素化合物
2.基本概念:体系,环境,焓变,热化学方程式,标准态
…… …… 余下全文
《无机化学》各章小结
第一章 绪论
 平衡理论 :四大平衡
平衡理论 :四大平衡

 理论部分 原子结构
理论部分 原子结构
1.无机化学 结构理论:, 分子结构,
晶体结构
元素化合物
2.基本概念:体系,环境,焓变,热化学方程式,标准态
…… …… 余下全文
第一章物质存在的状态………………………………………………………………2
一、气体... 2
二、液体... 3
①溶液与蒸汽压... 3
②溶液的沸点升高和凝固点的下降... 3
③渗透压... 4
④非电解质稀溶液的依数性... 4
三、胶体... 4
第二章 化学动力学初步……………………………………………………………5
一、化学反应速率... 5
二、化学反应速率理论... 6
三、影响化学反应速率的因素... 6
2、温度... 7
第三章 化学热力学初步……………………………………………………………8
一、热力学定律及基本定律... 8
…… …… 余下全文
转载自free kao yan
首先说明一下,我是复习考有机专业的,因为接触无机比较早,也看过一些无机的教材,对无机的知识点略有了解,同时应版主要求,把版中无机的讨论带动起来,故介绍一下个人学的无机的心得,供大家参考,仅代表个人观点.
无机的东西比较杂,并且比较松散,主要可以分为理论部分和元素化合物部分
理论部分主要分为四大结构和四大平衡,以及化学热力学,动力学初步和溶液
四大结构:原子结构,分子结构,配合物结构,晶体结构
四大平衡:酸碱平衡,沉淀溶解平衡,配位离解平衡,氧化还原平衡
如果你考物化的话化学热力学和动力学基础就不用看了,物化讲的比这个透彻得多,平衡的总纲以及溶液部分在物化里面也是讲的很详细;
如果你分析化学学得好的话,四大平衡也可以少看很多,因为分析化学就是建立在四大平衡的基础上的(仪器分析不算,呵呵);
而结构化学里面所涉及到的结构问题又比无机的四大结构深多了,同样如果你在这方面比较强,那四大结构又省了很多事.
但是如果每门掌握的都不透彻怎么办呢?不要担心,无机的理论部分仅仅是是一个大纲性质的东西,也就是总结性的概括.所以每种理论都有,但是每种理论要求都比较简单,按照四大结构-四大平衡-化学热力学初步-化学动力学初步-溶液的顺序自己仔细地过一遍也不是很难的事情,起码我感觉比自学有机容易多了,呵呵
如果你的化学基础比较扎实,也不要在旁边偷偷笑,正所谓"结构决定性质",无机尽管理论比较简单,但是其精髓在于用简单的理论解释大量的现象和物质性质,在你掌握相关理论的基础上要能够灵活地把它们运用到平时见到的单质和化合物的性质解释.这样才算真正掌握了无机的理论.
总的来说无机的理论部分重点在运用.
而无机化学的重点则元素部分,这个也是无机主要讲的东西以及无机的特点.
首先建议周期表最好是背过,认识并且会写除f区以外的元素,镧系最好能背过,一些重要的比如说La Ce也要知道的.
…… …… 余下全文
不含全部配位反应、鉴定反应、要从同类反应(未全包括)中找出规律
1.XeF6 + 3H2O == XeO3 + 6HF
2.NaBrO3 + XeF2 + H2O == NaBrO4 + 2HF + Xe
3.2F2 + 2H2O == 4HF + O2
4.2F2 + 2OH—(2%)== 2F— + OF2+ H2O
5. 2KHF2 电解 2KF + H2↑ + F2↑
6. 2NaCl + 2H2O 电解 2NaOH + H2↑(阴极区)+ Cl2↑
7. 2IO3― +5HSO3— == 5SO42— + I2 +3H+ + H2O
8. CaF2 + H2SO4 (浓) == CaSO4 + 2HF
9. NaCl + H2SO4 (浓) == NaHSO4 + HCl↑
10.Rb[ICl2] ==(加热) RbCl + ICl
11. 2HIO3 ==(加热) I2O5 + H2O↑
12. I2O5 + 5CO == I2 + 5CO2
13. I2+ 10HNO3 == 2HIO3 + 10NO2↑ + 4H2O
14. 2Cl2 + 2Ca(OH)2 == Ca(ClO)2 + CaCl2 + 2H2O
15. IO3―+ 5I― + 6H+ == 3I2 +3H2O
16. 3Cl2 + 6NaOH(850C) → 5NaCl +NaClO3+3HO
17. O3 + 2I― + H2O == O2 + I2 + 2OH—
18. S2O82— + 2H2O == H2O2 + 2HSO4—
19. Cl2 + H2O2 == 2HCl + O2↑
…… …… 余下全文
高中无机化学知识点总结
1、熟悉元素周期表和元素周期律(电子排布和周期表的关系,化合价和最外层电子数、元素所在的族序数的关系(包括数的奇偶性),微粒的半径大小和元素周期表的关系,非金属氢化物的稳定性、酸性和元素周期表的关系)。
熟悉常见的分子或单质、化合物的物质结构(水、氨气、二氧化碳、金刚石、二氧化硅的结构特点,相同电子数的微粒(10电子,18电子,H2O2和H2S,CO、N2、C2H4,O2、CH4))。
2、知道典型的溶解性特征
①加入过量硝酸从溶液中析出的白色沉淀:AgCl,原来溶液是Ag(NH3)2Cl;后者是硅酸沉淀,原来的溶液是可溶解的硅酸盐溶液。生成淡黄的沉淀,原来的溶液中可能含有S2-,或者是S2O32-
②加入过量的硝酸不能观察到沉淀溶解的有AgCl,BaSO4;BaSO3由于转化成为BaSO4而不能观察到沉淀的溶解。AgBr,AgI,也不溶解,但是沉淀的颜色是黄色。
③能够和盐反应生成强酸和沉淀的极有可能是H2S气体和铅、银、铜、汞的盐溶液反应。:
④沉淀先生成后溶解的:CO2和Ca(OH)2,Al3+和氢氧化钠,AlO2-和盐酸,氨水和硝酸银
3、操作不同现象不同的反应: Na2CO3和盐酸;AlCl3和NaOH,NaAlO2和盐酸;AgNO3和氨水;FeCl3和Na2S;H3PO4和Ca(OH)2反应。
4、先沉淀后澄清的反应:
AlCl3溶液中加入NaOH溶液,生成沉淀,继续滴加沉淀溶解:
;
…… …… 余下全文
无机化学及分析化学总结
第一章 绪论
l 系统误差:由固定因素引起的误差,具有单向性、重现性、可校正
l 偶然误差:随机的偶然因素引起的误差, 大小正负难以确定,不可校正,无法避免,服从统计规律
(1)绝对值相同的正负误差出现的概率相等
(2)大误差出现的概率小,小误差出现的概率大。
l 准确度: 在一定测量精度的条件下分析结果与真值的接近程度,用误差衡量
l 精密度):多次重复测定某一量时所得测量 值的离散程度。用偏差衡量
l 准确度与精密度的关系:精密度好是准确度好的前提;精密度好不一定准确度高
l 测定结果的数据处理
(1)对于偏差较大的可疑数据按Q检验法进行检验,决定其取舍;
(2) 计算出数据的平均值、平均偏差与标准偏差等;复习p12例题
l 有效数字及其计算规则
有效数字:实际能测得的数据,其最后一位是可疑的。对于可疑数字一般认为有±1的误差
例: 滴定管读数 21.09 mL 分析天平读数 0.2080 g 最后一位为可疑值
注意: (1) “0”的作用:有效数字(在数字的中间或后面)定位作用(在数字的前面)
(2)对数值(pH、pOH、pM、pK等)有效数字的位数取决于小数部分的位数。
计算规则:(1) 加减法:计算结果小数点后的位数与小数点后位数最少的数据一样。
(2)乘除法(乘方、开方、对数)计算结果的有效位数与有效位数最少的数据一样。
第三章化学热力学初步
l 基本概念:化学反应进度、体系与环境、状态与状态函数(状态函数的特征)、热与功(热与功的符号、体积功的计算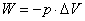 )、内能和热力学第一定律(热力学定律第一定律数学表达式ΔU = Q + W)(p43例3-1)
)、内能和热力学第一定律(热力学定律第一定律数学表达式ΔU = Q + W)(p43例3-1)
…… …… 余下全文
一、离子部分
1、 离子反应的概念
在反应中有离子参加或有离子生成的反应称为离子反应。
2、离子反应的特点
离子反应的反应速率快,相应离子间的反应不受其它离子的干扰。
3、离子反应的类型
(1)离子互换反应(自由移动离子浓度减小)
①生成难溶的物质。如生成BaSO4、AgCl、H2SiO3、Al(OH)3等。 ②生成难电离的物质。如生成CH3COOH、H2O、NH3·H2O、等。 ③生成挥发性物质。如生成CO2、SO2、H2S等。
(2)有离子参加的氧化还原反应(电子转移)
①置换反应的离子反应(Fe与CuSO4溶液反应, Cl2与KBr溶液反应)
②其它有离子参加的氧化还原反应 (MnO2与浓HCl反应制取Cl2;Cu与FeCl3溶液反应生成FeCl2、CuCl2;)
(3)双水解(当弱酸的酸根与弱碱的阳离子同时存在于水溶液中时,弱酸的酸根水解生成的氢氧根离子与弱碱的阳离子水解生成的氢离子反应生成水而使两种离子的水解平衡向水解方向移动)
(4)生成络合物(Fe(SCN)2+, Ag(NH3)2+)
4、注意事项/特例:
多元弱酸的酸式盐的酸根离子在离子方程式中不能拆开写。如NaHS03溶液和稀硫酸反应: 对于微溶物的处理有三种情况;
①在生成物中有微溶物析出时,微溶物用化学式表示。
②当反应物里有微溶物处于溶液状态(稀溶液),应写成离子的形式。 ③当反应物里有微溶物处于悬浊液或固态时,应写成化学式。
5、离子反应过量问题
一、多元弱酸盐与酸的反应
例:a. 将碳酸钠溶液滴加到稀盐酸溶液中 b . 将稀盐酸溶液滴加到碳酸钠溶液中 解析:a中盐酸过量,以碳酸钠为“标准”
化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑
离子方程式为:CO32-+2H+=H2O+CO2↑
b中碳酸钠过量,以盐酸为“标准”
化学方程式为:HCl+Na2CO3=NaCl+NaHCO3
…… …… 余下全文

无机及分析化学心得
姓名: 班级:
学号:
无机及分析化学心得
经过一个学期对《无机及分析化学》这门课程的学习,我的感触颇多。因为我是一名转专业的学生,所以在大二的时候才开始上这门课。从一开始的自我想象容易,到自我感觉良好,到有点小小的紧张,再到立志要开始认真的学习,到感觉状态有所好转,再到充满自信。这其中的纠结、艰辛和自豪,不是一两句话就可以描述清楚的。再加上因为我想要获得保研的资格,因此我对于将这门课学好是持着一种前所未有的坚定心情。下面我就将会将我这一学期所收获的一一讲来。
…… …… 余下全文
